

"Among several commercial services who have claimed to be specialized to generate mouse models with genetic modifications, I recognize that Cyagen is one of the best. We are looking forward to having more cooperation with them."
Korea Brain Research Institute (KBRI)영업일 기준 1-2일 내에 답변해 드리겠습니다.

Rat는 생리학 연구를 위한 이상적인 모델 동물로, 연구자들은 이미 대량의 순계 rat를 얻었으며, rat의 행동, 세포, 생리학, 생화학, 약리학 및 독성학에 대한 많은 양의 데이터를 축적했습니다. 뿐만 아니라 rat는 인간의 고혈압, 당뇨병, 유방암 및 신경계 질환을 연구하기 위한 이상적인 모델 동물입니다. Rat는 유방암과 같은 종양이 형성되었을 때 호르몬 반응이 사람과 매우 비슷합니다. 어떻게 보면, rat는 현재 인간 질병 연구에 있어서 가장 적합한 모델 동물 중의 하나로, 게놈과 기능을 결합할 수 있는 모델 동물입니다.
또한, rat는 약리학적 연구를 위해 우선적으로 선택된 동물로 심혈관 질환 및 운동 질환의 연구에도 널리 활용되고 있습니다. Rat는 거의 모든 알려진 인간 질병을 simulation하는 데 사용될 수 있으며, rat의 유전적 구조를 이해한다면 연구원들이 질병과 관련된 유전자를 발견하도록 도울 수 있으므로 유전자와 환경이 인간의 건강에 미치는 영향을 더 명확하게 밝혀내게 될 것입니다. Rat는 약의 효력과 안전성 테스트에 널리 사용되어 왔는데, rat의 게놈 서열에 대한 이해는 약물 간섭에 대한 새로운 목표를 제공할 것이며, 이는 신약 개발에 커다란 촉진 작용을 일으킬 것입니다.
현재 Cyagen에서 선택이 가능한 rat strains 및 해당 특징은 다음과 같습니다:
(1)SD Rat: 강한 생식력, 빠른 성장 및 강한 질병 저항력을 가지고 있습니다. 자발적인 종양 발생률이 낮고 성호르몬에 대한 민감도가 높습니다. 영양학, 내분비학 및 독성학 등의 연구에 종종 사용됩니다.
(2)Wistar Rat: 성주기가 안정적이고 생식력이 강하며 성장과 발달이 빠릅니다. 천성이 온순하고 질병 저항력이 강하며 자발적인 종양 발생률이 낮습니다. 영양학, 생리학, 약리학, 독성학 및 병리생리학 연구에 널리 사용됩니다.
(3)F344(CDF) Rat: 회전 운동성이 좋지 않고 혈청 인슐린 함량이 낮으며 뇌하수체가 큽니다. 다양한 종양의 이식과 성장을 가능하게 하며, 암 발생 연구에 많이 사용됩니다.
(4)Long evans Rat: 행동학, 영양학, 신경학, 독성학 그리고 안과 쪽의 연구에 널리 사용되고 있습니다. 호흡기 질환에 쉽게 걸리지 않고 흡입마취 시간을 연장해야 하는 외과 수술에 큰 이점이 있습니다.
(5)Brown Norway Rat: 야생 Norway Rat의 변종으로 털은 갈색을 띠며 유전학 연구에 최초로 사용되었습니다. 실험적 알레르기성 뇌척수염(experimental allergic encephalomyelitis) 및 자가면역 복합 사구체 신염(autoimmune complex glomerulonephritis)에 내성이 있습니다.
제작 원리
Transgenic Rat를 만드는 데 가장 흔히 사용되는 한 가지 방법은 DNA pronuclear micro-injection(DNA 원핵 미세주입)입니다. DNA pronuclear micro-injection이란 exogenous DNA(외래 DNA)를 미세주입을 통해서 수정란의 원핵에 주입하고, 주입된 DNA가 rat 수정란의 게놈에 통합되어 자손에게 안정적으로 유전되는 것을 말합니다. Cyagen이 PiggyBac 시스템 DNA micro-injection을 사용하여 제작한 Transgenic Rat의 양성 유전자 발현율은 conventional plasmid DNA micro-injection으로 제작한 Transgenic Rat의 2배 이상입니다!
PiggyBac 시스템으로 효율적인 Transgenic 서비스 제공!
PiggyBac 기술 원리:
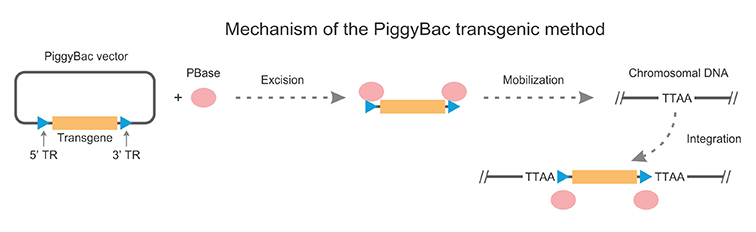
PiggyBac(PB) 시스템은 PB Transposon 특유의 ‘잘라 내기 및 붙여 넣기(cut and paste)’ 메커니즘을 이용하여 DNA 단편이 vector와 genome 사이에서 자유롭게 이동하도록 함으로써 외래 DNA 단편이 genome으로 통합되는 것을 효과적으로 중재합니다. 전위 시, PB 트랜스포아제(PB transposase)는 transposon vector의 양 끝에 위치한 특정 transposon 역 말단 반복 시퀀스(inverted terminal repeat sequences, ITRs)를 인식하며, transposon의 말단에 결합하여 짧은 헤어핀 구조를 형성하고 ‘잘라 내기’를 한 후에 genome의 TTAA 부위에 ‘붙여 넣기’를 합니다. Cyagen 실험 데이터에 따르면 PiggyBac 시스템의 양성 유전자 발현율은 Conventional plasmid DNA micro-injection보다 2배 이상 높습니다!
PiggyBac (PB) 시스템의 5대 장점:

Rat Strain:
SD Rat: 심혈관, 신경계 및 기타 기관의 발달을 연구하기 위해 흔히 사용되는 모델 동물입니다.
Transgenic Rat 종류:
프로모터와 타겟 유전자를 포함한 벡터를 제작한 후에 rat 수정란에 microinjection합니다. 벡터 제작 시 상이한 Conventional/Tissue-specific/Inducible 프로모터를 사용하여 유전자가 rat 내에서 Conventional/Tissue-specific/Inducible 하게 발현되도록 하여 연구 목적을 달성합니다.
일반적으로 U6/H1을 사용하여 shRNA을 발현하도록 하며 타겟 시퀀스를 설계하여 shRNA 벡터를 제작하여 microinjection으로 shRNA벡터를 수정란에 주입합니다. 유전자 발현 과정에 shRNA의 방해 작용으로 타겟 유전자의 발현을 침묵 억제시키며 유전자 기능을 연구할 수 있습니다.
벡터를 수정란에 microinjection하여 microRNA의 과발현 혹은 억제 할 수 있습니다.
프로모터-lox-stop-lox-TG유전자 벡터를 제작 후 microinjection하여 조직특이성 rat 모델을 제작합니다. 일반적으로는 TG 유전자는 발현하지 않으며 Cre/CreERT2 rat와 브리딩하면 stop 시퀀스가 삭제되어 TG 유전자가 특정된 조직에서 발현이 가능합니다.
Bacterial artificial chromosomes(BACs)은 Large Fragment DNA를 조작하는 중요한 수단입니다. 유전자의 완전성때문에 유전자 변형의 중요한 기능을 더 잘 설명할 수 있습니다. 따라서 완전한 시공간 특이성 유전자 발현, 유전자 구조 및 regulatory element 등을 연구하기 위해 BAC에서 직접 Pronuclear Microinjection(약 수십~수백Kb)을 하거나 이를 개조해 rat의 수정란에 주입해 유전자 변형 rat를 얻을 수 있습니다.
1. Pronuclear Microinjection은 타겟 유전자를 랜덤으로 rat 또는 랫드 유전자에 삽입하기 때문에 생산한 1세대 F0 rat는 삽입 위치가 다른 여러가지 rat를 얻을 수 있습니다. 타겟 유전자의 발현량도 다릅니다. 그리고 생산한 1세대 F0 rat를 단독 line으로 보고 같은 line끼리 브리딩을 진행하여야 합니다. 또한 외부 유전자는 diploid 동물에서 하나의 염색체에만 삽입할 수 있기 때문에 hemizygote이며 후대 중 일부 개체만 hemizygote이므로 선별검증이 필요합니다.
2. Pronuclear Microinjection 후에 PCR 양성 F0 heterozygous rat를 얻습니다.
3. F0 rat가 성숙된 후에(8주령) 야생형 rat와 교배하여 F1 rat를 생산합니다.
4. 생산한 F1 rat를 유전자 검사를 통하여 선별해 냅니다. 이론상 F1 세대 rat 중 50%는 heterozygote이고 50%는 야생형입니다.
주의 사항:
1) F0 rat마다 유전자형이 다르기 때문에 F0 사이에 브리딩 할 수 없고 야생형하고만 브리딩 할 수 있으며 유전자형이 일치한 F1 rat를 선별해야 합니다.
2) F1 rat를 얻은 후, 단백질 발현 검사를 진행하여 발현이 안정적인 rat를 선별하여 계속 브리딩을 진행해야 합니다.
