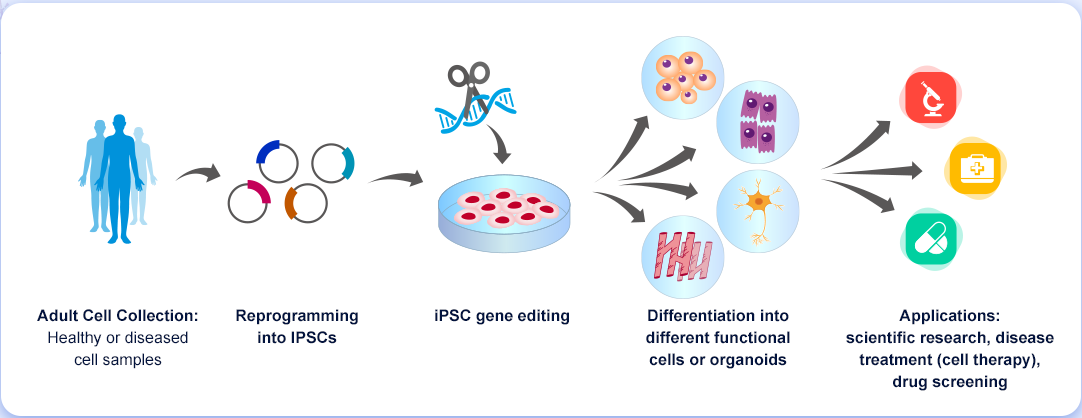
유도만능줄기세포(iPSC)는 특정 세포 유형, 조직 및 기관으로 재분화할 수 있기 때문에 유전자 편집 기술과 결합하면 질병 발병 메커니즘을 탐구하여 새롭고 효과적인 약물 및 세포 치료법을 개발하는 데 사용할 수 있습니다. Cyagen은 첨단 세포 재프로그래밍, 유전 공학 및 세포 분화 기술을 통해 iPSC를 위한 원스톱 체외 서비스 플랫폼을 제공합니다. Cyagen의 원스톱 표현형 분석 플랫폼을 통합하여 다양한 질병 응용 분야에 걸쳐 iPSC를 위한 in vitro 모델 개발 및 테스팅 서비스를 제공할 수 있습니다.
연구 응용을 위한 iPSC 모델의 장점
·기초 연구: 발생생물학 연구를 위한 강력한 도구로, 배아줄기세포(Embryonic stem cells, ESCs)와 관련된 윤리적 논란을 피하고 이론적으로 in vitro에서 무한한 확장과 분화가 가능하여 대규모 약물 스크리닝과 구하기 어려운 단일세포계(Primary cell line)의 대체에 유용합니다.
·약물 개발: iPSCs는 이론적으로 인체의 모든 세포 유형으로 분화할 수 있고, 인간 질환의 발생을 더 잘 시뮬레이트할 수 있으며, 약물 안전성 및 효능 연구에 적합합니다.
·혁신적인 치료법: iPSCs는 환자 자신의 세포에서 유도되어 잠재적인 면역 거부 문제를 해결하고, 단일 유전적 배경을 가진 세포주를 생성하여 다른 유전적 배경의 차이로 인한 표현형 변이를 줄일 수 있습니다.
·자가 치료법: iPSCs의 분화 잠재력을 바탕으로 손상되거나 퇴화한 장기 및 조직의 복구에 적용하기 위해 많은 임상 시험이 완료되었거나 진행 중입니다.
iPSC 기술 서비스 및 제공 기준
|
유형 |
프로젝트 |
표준 납품물 |
품질관리(QCs) |
소요기간 |
|
|
|
|
|
|
|
Gene Edited Cell Lines (iPSCs) |
Knockout (KO) |
1 monoclonal heterozygous cell line, 2 tubes (10^6/tube), experiment report |
PCR and sequencing, immunofluorescence |
Starting from 8 weeks |
|
Point mutation (PM) |
Starting from 12 weeks |
|||
|
Knock-in (KI) |
Starting from 12 weeks |
|||
|
Transfected Stable Cell Lines (iPSC) |
Transfection stable Knockdown expression |
Transfected stable cell lines, 2 tubes/strain (10^6/tube), including control cell lines, experiment report |
qPCR, immunofluorescence |
Cell pool: 9-11 weeks; Monoclonal: 13-15 weeks |
|
Stable overexpression strain |
Cell pool: 8-10 weeks + gene synthesis; Monoclonal: 12-14 weeks + gene synthesis |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cyagen iPSC 기술 서비스의 특징
|
기술적 도전 |
Cyagen의 솔루션 |
|
Reprogramming: 초기 방법은 레트로바이러스(retroviruses)와 렌티바이러스 벡터 등에 의존했지만, 바이러스 게놈 통합으로 인해 전이유전자가 재활성화될 위험이 있었습니다. |
에피솜 벡터(추가 플라스미드)를 이용한Reprogramming은 non-integrated 인간 iPS 세포를 생산하면서 다능성 줄기세포 유전자를 전사하고 발현하는 데 사용됩니다. 이 방법은 게놈이 통합된 바이러스 벡터를 사용하는 것보다 안전성이 더 높습니다. Cyagen은 거의 iPSC Reprogramming의 모든 측면을 개선했습니다: 업그레이드된 Delivery vector는 최대 50%의 HDR 효율, 50% 이상의 transfection 효율, 그리고 80% 이상의 transfection viability를 제공하고, RNP 전달이 최대 90%의 KO 효율을 달성하였습니다. |
|
세포 배양: Harsh culture 조건은 유전자 편집 과정에서 세포가 다능성을 잃고 분화할 수 있습니다. |
Cyagen은 18년의 줄기세포 배양 경험을 바탕으로 컴팩트한 내부, 균일한 크기 등의 특징을 가진 이상적인 iPSC colony를 배양할 수 있는 첨단 iPSC 편집 및 배양 시스템을 개발했습니다. |
|
iPSC 유전자 편집: 서로 다른 개인 또는 조직에서 얻은 iPSC 간의 유전적 차이가 크고 정밀한 유전자 수정을 수행하기가 매우 어렵습니다.
|
Cyagen의 유전자 편집 플랫폼은 iPSC 연구 프로젝트의 성공을 위해 개발되어 다음과 같은 장점을 제공합니다:
|
|
단일 클론 형성: 안정적인 단일 클론 iPSC 배양과 낮은 cloning 비율을 위한 복잡한 준비과정이 있습니다. |
Cyagen만의 유일한 단일 세포 스크리닝 기술을 사용하면 단일 클론의 형성률이 30% 이상에 달할 수 있으며, 한 번의 스크리닝으로 충분한 양의 positive clones를 얻을 수 있습니다. |
|
직접 분화: 다양한 출처의 iPSC 세포주 간에는 분화 능력과 증식 속도에 차이가 있습니다.
|
목표 분화 세포 유형에 더 적합한 iPSCs를 우선으로 선택하고 배지와 첨가제를 최적화함으로써 분화의 특이성과 효율성을 크게 향상시켜 미성숙 또는 미분화 세포의 비율을 효과적으로 줄일 수 있습니다. |
iPSC Reprogramming
Cyagen은 혈액에서 채취한 체세포 샘플을 reprogramming하여 non-integrating 인간 iPSC를 생성할 수 있는 첨단 체세포 reprogramming 기술을 보유하고 있습니다.
iPSC Reprogramming 서비스의 프로세스

iPSC Reprogramming 서비스
|
유형 |
프로젝트 |
방법 |
내용 |
|
Establishment of iPSC Lines from Somatic Cells |
Reprogramming |
Episomal Plasmid |
Establishment of iPSC Lines from Peripheral Blood |
|
|
|
|
|
|
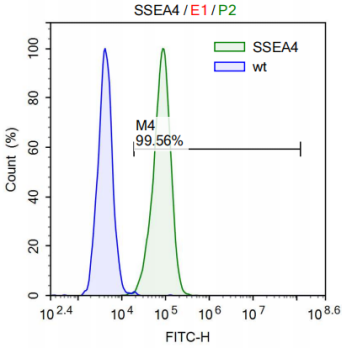
Flow Cytometry |
|
||
|
|
|
|
|
|
|
|
|
|
|
Cell Source Identification |
STR Profiling Test |
Verification of Homology with the Starting Cells |
|
|
|
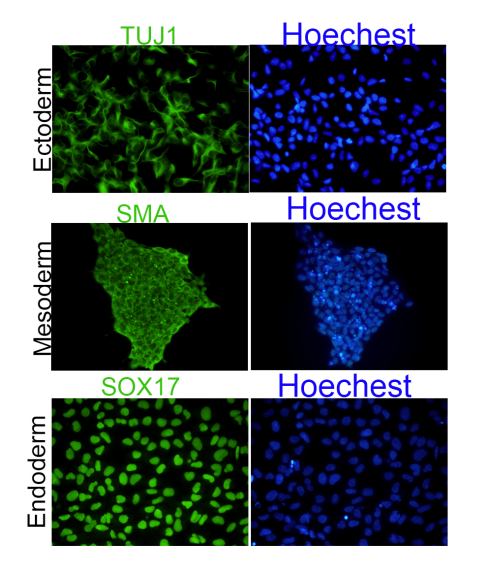
Tri-lineage Differentiation |
In Vitro Differentiation Capacity Verification |
|
|
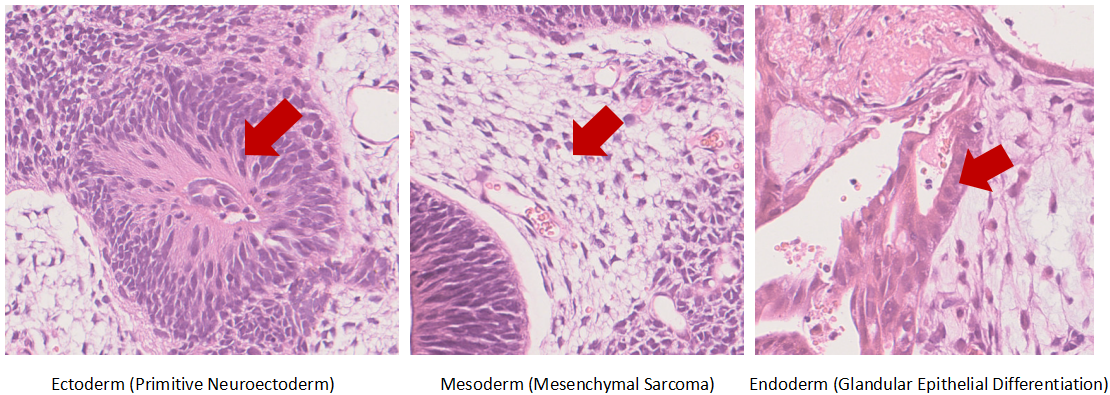
Teratoma Formation Assay of iPSC In Vivo Differentiation Capacity |
In Vivo Differentiation Capacity Verification |
||
|
|
PCR |
|
iPSC 검출 및 기능 식별
- Cell Morphology

- Karyotyping

- STR Profiling

- Cell-Specific Markers

- Flow Cytometry Analysis

- In Vitro Tri-lineage Differentiation
- Teratoma Formation Assay
iPSC Reprogramming 서비스의 장점
- Somatic cells extracted from blood are used to produce high-quality iPSCs with a success rate of up to 99%.
- Utilization of stable episomal vectors in non-integrative reprogramming ensures non-integrated human IPS cells while preserving downstream experiments.
- Standardized operational procedures compatible with various culture systems enable large-scale production of high-purity cells.
- We provide complete customization options to meet researchers' specific needs.
- 혈액에서 추출한 체세포를 사용하여 최대 99%의 성공률로 고품질의 iPSC를 생성합니다.
- Non-integrative reprogramming에서 안정적인 에피솜 벡터를 활용하여 non-integrated human IPS 세포를 보장하는 동시에 downstream 실험을 보존할 수 있습니다.
- 다양한 배양 시스템과 접합하고 표준화된 조작 절차로 고순도 세포의 대량 생성이 가능합니다.
- Cyagen은 연구자의 특정 요구 사항을 충족하기 위해 완벽한 맞춤형 옵션을 제공합니다.
iPSC 유전자 편집
유전자 편집 기술과 결합하면 iPSCs는 질병의 메커니즘을 탐구하고 효과적인 신약 및 세포 치료법을 개발하는 데 사용될 수 있습니다. Cyagen의 iPSC 질환 모델 연구 플랫폼은 성숙한 유전자 편집 기술과 줄기세포 배양 시스템을 갖추고 있으며, 현대의 중개 및 재생 의료 연구에 필요한 iPSC 배양, 유전자의 변형 및 단일 클론화와 관련된 많은 어려움을 극복해 왔습니다. Cyagen의 특허 프로세스는 맞춤형 iPSC 모델의 거의 모든 측면을 개선했으며, 업그레이드된 delivery vector는 최대 50%의 HDR 효율, 50% 이상의 transfection 효율, 80% 이상의 transfection viability, 그리고 최대 90%의 KO 효율로 RNP delivery 등을 실현할 수 있습니다.
Cyagen의 프로세스는 강력한 AI 알고리즘을 활용하여 강화되었습니다. 예를 들면, 희귀질환 데이터 센터(RDDC)의 지원을 받아 개발된 RNA splicing 모델 도구가 WB-negative 클론을 선별하는 데 도움을 줄 수 있습니다. 또한 Smart-CRISPR™ 세포 유전자 편집 시스템은 유전자 knockout 및 기타 유전자 편집 전략을 신속하게 설계할 수 있어 편집 효율이 90%에 달합니다.
iPSC 유전자 편집 기술 프로세스
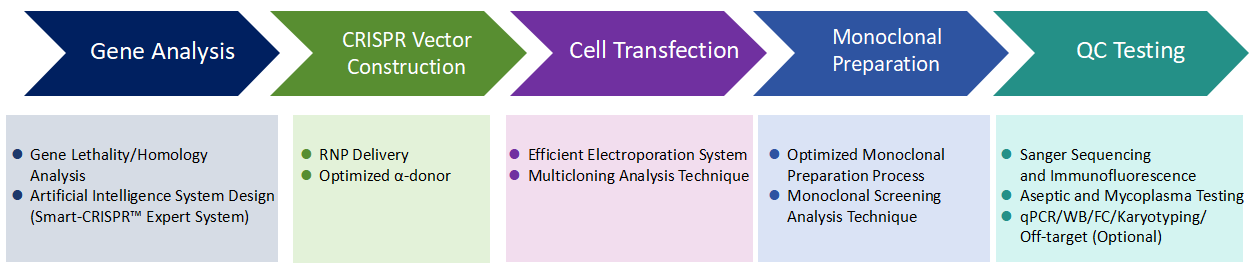
iPSC 유전자 편집 서비스
|
유형 |
프로젝트 |
표준 납품물 |
품질관리(QCs) |
소요기간 |
|
Gene Edited Cell Lines (iPSCs) |
Knockout (KO) |
1 monoclonal heterozygous cell line, 2 tubes (10^6/tube), experiment report |
PCR and sequencing, immunofluorescence |
From 8 weeks |
|
Point mutation (PM) |
From 12 weeks |
|||
|
Knock-in (KI) |
From 12 weeks |
|||
|
Transfected Stable Cell Lines (iPSCs) |
Transfection stable Knockdown expression |
Transfected stable cell lines, 2 tubes/strain (10^6/tube), including control cell lines, experiment report |
qPCR, immunofluorescence |
Cell pool: 9-11 weeks; Monoclonal: 13-15 weeks |
|
Stable overexpression strain |
Cell pool: 8-10 weeks + gene synthesis; Monoclonal: 12-14 weeks + gene synthesis |
iPSC 유전자 편집 서비스의 사례 연구: EGFP Knock-in AAVS1 세포주 모델
유전자 편집 기술을 사용하여 유도만능줄기세포(iPSC)의 AAVS1 유전자좌에 EGFP 유전자를 knock-in 하였습니다. 그림과 같이 sgRNA와donor를 RNP 방법을 통해 iPSC에 transfect 한 후 HDR pathway를 통해 EGFP 서열을 AAVS1 유전자좌에 삽입했습니다.
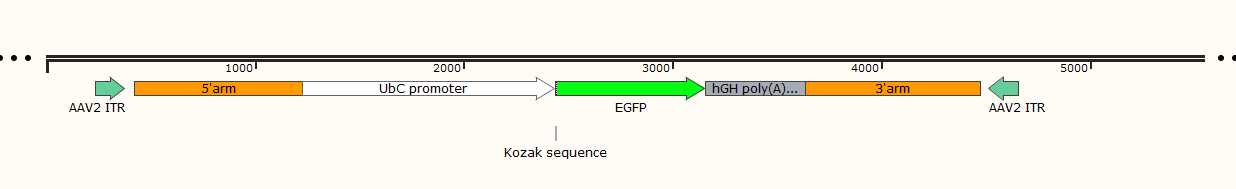
그림 1. EGFP Knock-in 전략 설계
PCR 및 염기서열 식별을 통해AAVS1 유전자좌에 EGFP가 knock-in 된 homozygous iPSC 세포주를 얻었고, 형광 현미경으로 100% EGFP 발현이 관찰될 수 있습니다. 세포 배양 후 G-banding을 사용하여 수행한 염색체 핵형 분석 결과는 46개의 정상 염색체 수를 보였으며 뚜렷한 구조적 이상은 없었습니다. 세 가지의 다능성 markers NANOG, OCT4, SOX2에 대한 면역 형광 염색 결과는 positive signal이 검출되어 knocked-in 세포의 다분화능(stemness)을 나타냈습니다.
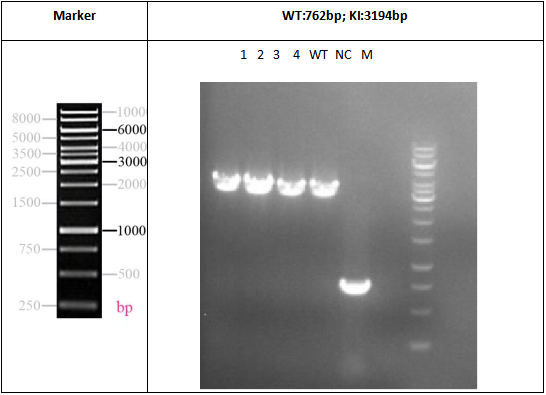
그림 2. iPSC-EGFP Knock-in의 Gel Electrophoresis 식별 결과
참고: 프라이머(primer) 설계 전략은 전체 EGFP와 게놈 위치의 upstream과 downstream에서 부분 염기서열을 증폭하는 것을 목표로 했습니다. EGFP를 삽입하지 않은 band는 762bp에 있었고, EGFP를 성공적으로 삽입한 band는 3194bp에서 관찰되었습니다. 그 결과 4개의 monoclonal lines에서 band가 3194bp에 나타나 EGFP와 homozygous clones가 성공적으로 삽입되었음을 나타냅니다.

그림 3. iPSC-EGFP Knock-in의 시퀀싱 결과
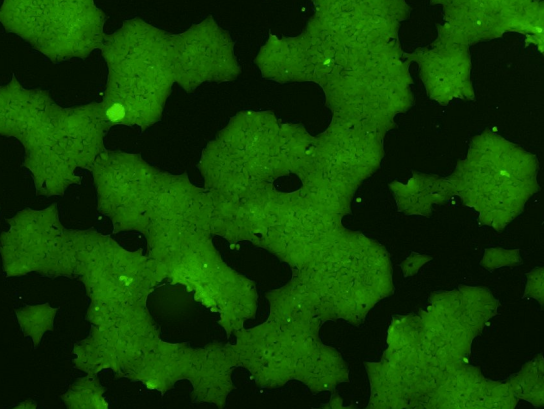
그림 4. iPSC-EGFP Knock-in Homozygous Clone의 형광 이미지
(iPSC Homozygous Clones에서 100% 발현된 EGFP)

그림 5. iPSC-EGFP Knock-in의 핵형 분석
(세포 배양 후 G-banding을 이용한 염색체 핵형 분석 결과, 뚜렷한 구조적 이상 없이 46개의 정상 염색체 수를 보입니다)

그림 6: iPSC-EGFP 면역 형광 - 다분화능 검출: 다능성 markers NANOG, OCT4 및 SOX2에 대한 면역 형광 염색은 positive signal을 감지하여 knocked-in 세포의 다분화능을 나타냅니다.
Cyagen iPSC 유전자 편집 서비스의 장점
iPSC 직접 분화
직접 분화란 특정 실험 조건과 세포 배양 시스템을 통해 신경세포, 심근세포, 간세포 등과 같은 특정 유형의 체세포로 전환하도록 iPSC를 유도하는 것을 말합니다. Cyagen은 다양한 질환 모델 개발 및 약물 스크리닝 기능을 제공하여 연구자들에게 고품질의 iPSC 모델 서비스를 제공할 수 있습니다.
iPSC 직접 분화 서비스
|
프로젝트 |
표준 납품물 |
품질관리(QCs) |
소요기간 |
|
|
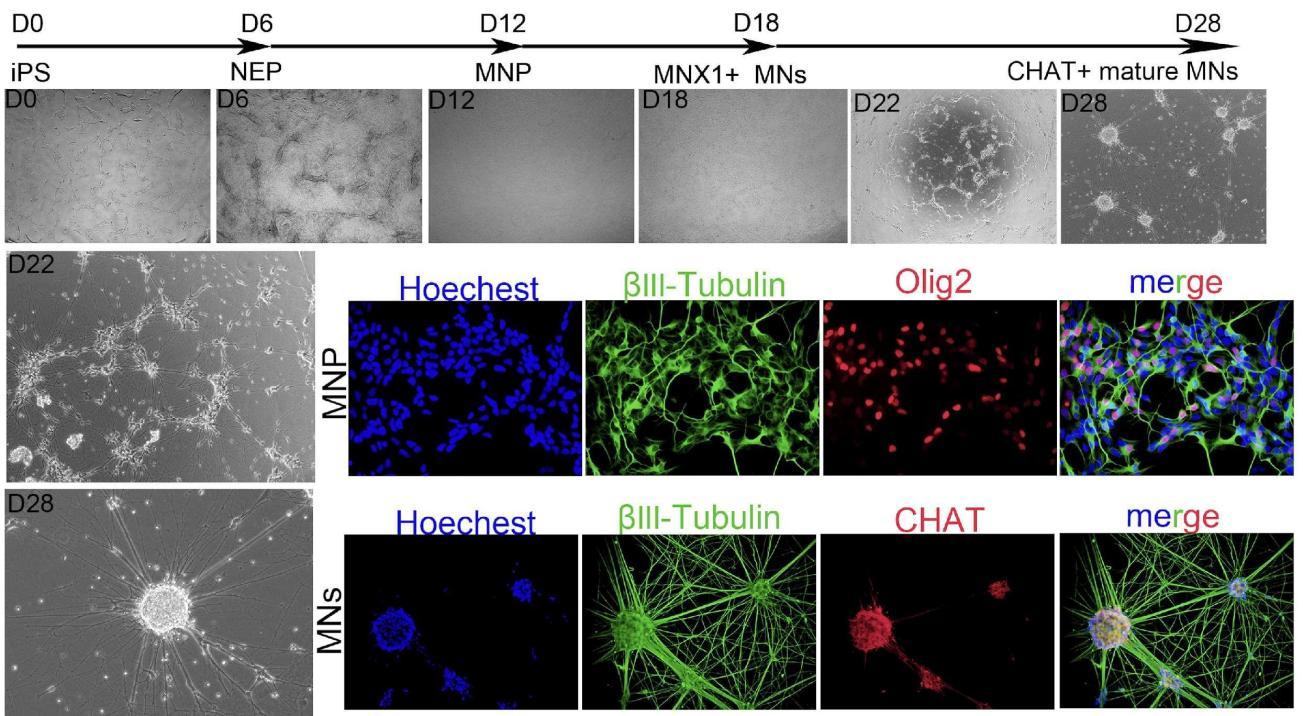
Motor neuron precursor cells and mature motor neuron differentiation kit for 10^7 cells |
Immunofluorescence (MNP Oligo2/MNs CHAT) |
From 6 weeks |
|
CD34+ Differentiation |
Two vials of cryopreserved cells (1x10^6 cells/vial) |
qPCR, flow cytometry, immunofluorescence |
From 3 weeks |
|
|
Two vials of cryopreserved cells (1x10^6 cells/vial) |
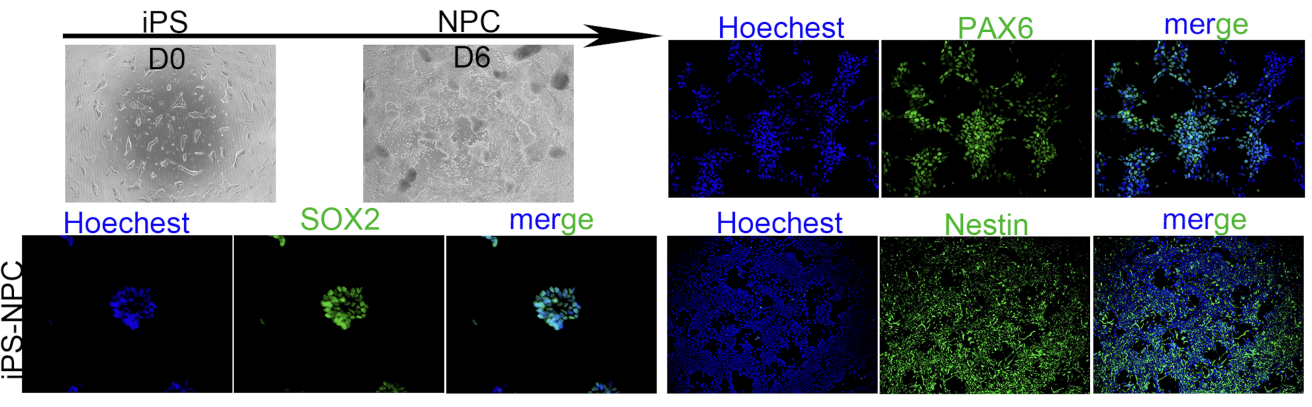
Immunofluorescence (SOX2/PAX6/Nestin) |
From 2 weeks |
|
|
|
|
|
|
Liver Organoid Differentiation |
One vial of cryopreserved liver organoids (1 set - 10 units) |
qPCR, flow cytometry, immunofluorescence |
From 8 weeks |
iPSC 직접 분화 서비스의 사례 연구: iPSC 모델 분화 능력