

현재 세포 치료는 주로 종양학 분야에서 사용되며, 치료 효과를 평가하기 위해 안정적인 종양 세포 모델과 동물 모델을 구축해야 합니다. 감염 효율, 배양 조건, 그리고 세포 유형 등 여러 가지 요인이 CAR-T 세포의 효과에 영향을 미칩니다. In vitro 세포 모델은 CAR-T 치료의 효과와 특이성을 평가하는 데 다양한 검출 방법을 제공합니다. In vivo 평가 모델의 경우, CAR-T 세포 거부 반응을 일으키지 않도록 연구 모델은 해당 면역 환경을 갖추고, 실험 동물은 안정적인 생활 환경이 있어야 합니다. 또한 homologous 종양 이식 마우스 모델도 CAR-T의 기전과 치료 원리를 검증하는 데 사용할 수 있습니다.
Cyagen은 유전자 편집 세포와 동물 모델의 제작에 전념해 왔고, 경험이 많은 전문가팀과 성숙한 기술 플랫폼을 보유하고 있으며, 타겟 유전자의 발현 조절을 위한 세포 모델 및 동물 모델을 제공합니다. CAR-T 및 세포 치료 연구의 요구를 맞추어, Cyagen은 종양 면역 연구에 적용한 수천 개의 세포 및 마우스 모델을 포함한 카탈로그를 구축했습니다. 그리고 국내외 제약 회사, 생명 공학 회사, 연구 기관 및 병원을 대상으로 전임상 in vivo/in vitro 약리 평가 서비스를 제공합니다. 예를 들어, NKG 마우스는 Cyagen에서 개발한 중증 복합 면역결핍(Severe combined immunodeficiency, SCID) 모델로, 마우스의 T/B/NK 세포가 없고 골수 성분 결함이 있습니다. NKG 마우스는 다양한 CDX 모델을 구축할 수 있고, 마우스 모델에서 인간 면역 시스템을 재구성하는 데 적용할 수 있습니다.
|
유형 |
모델 |
|
Cell Model |
Tumor cells expressing CAR-T targets |
|
Luciferase labeled tumor cells |
|
|
CAR-T cell construction |
|
|
Overexpression stable transgenic cell Line services |
장점
사례 연구
1. D19-293T cell line 구축
A 293
렌티바이러스 감염을 통해 CD19가 안정적으로 발현되는 T cell line을 구축하고, 유세포 분석법(Flow cytometry)으로 CD19 항원의 고발현이 검출되었습니다. 아래와 같은 결과가 나타났습니다.
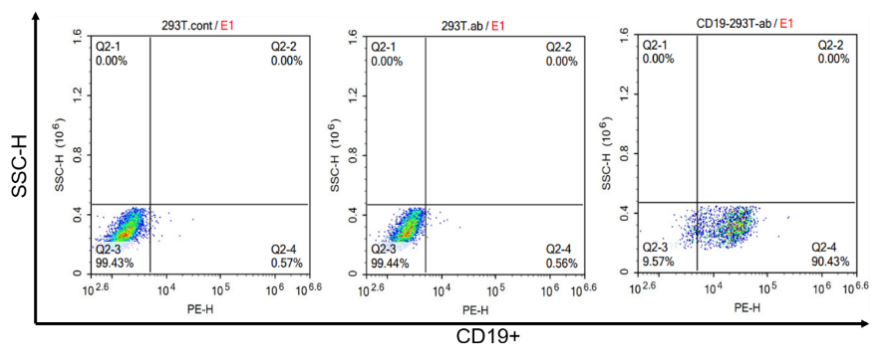
그림 1. CD19-293T가 안정적으로 감염된 cell line에서 CD19 항원 발현의 유세포 분석 검출.
2. CAR-T 세포 표현형 분석 및 CAR positive rate 테스트 결과
활성화 및 확장된 PBMC를 모니터링한 결과, 고순도의 T 세포가 성공적으로 확보되었으며, 이는 선별된 세포의 90% 이상을 차지했습니다. T 세포의 subtype 분석 결과, CD4+ 세포와 CD8+ 세포의 비율은 각각 35.93%와 49.45%로 나타났습니다. 또한, lentiviral transduction을 통해 FMC63 CAR-T 세포를 구축하였고, FMC63 scFv 항체로 FMC63 CAR-T 세포를 표지하였습니다. FMC63 CAR의 positive rate는 16.99%로, FMC63 CAR-T 세포가 성공적으로 구축되었음을 나타냅니다.
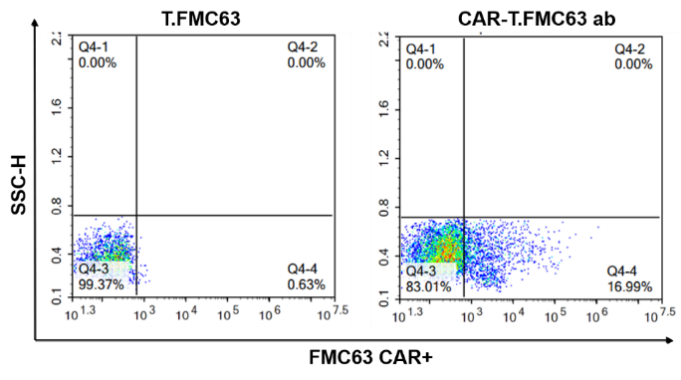
그림 2. T 세포 표현형 분석 및 FMC63 CAR-T 세포 positive rate 검출. (A) PBMC 활성화 및 증식 10일째의 T세포 비율과 표현형 분석 결과. (B) FMC63 CAR-T 세포 CAR positive rate 검사 결과.
In vivo 평가 모델
서비스
|
유형 |
모델 |
서비스 |
|
Animal model |
Immunodeficient Mice |
BALB/c nude mice, NOD scid mice, NKG mice |
|
Humanized immune system mice |
Hu-PBMC mice, Hu-HSC mice |
|
|
Cell Line-derived Tumor Xenograft (CDX) model |
Subcutaneous solid tumor model, In situ solid tumor model, Hematoma model |
|
|
Homologous tumor mouse model |
Lung cancer, colorectal cancer, breast cancer, melanoma, and other homologous tumor models |
|
|
Humanized immune checkpoint mouse model |
hCTLA-4/hPD-1, hPD-L1mice |
키메라 항원 수용체(CAR)-T 세포 치료는 강력하고 지속적인 임상 결과를 제공함으로써 혁신적인 시대를 열었습니다. CARs는 림프구, 주로 T 세포를 재프로그래밍하여 지정된 타겟 항원을 발현하는 세포를 감지하고 제거하도록 설계된 엔지니어링 합성 수용체입니다. CARs는 주조직 적합성 복합체(Major Histocompatibility Complex, MHC) 수용체와 독립적으로 세포 표면의 특정 항원에 결합하여 강력한 T 세포 활성화와 항종양 반응을 유도합니다[1].
NKG 마우스는 Cyagen에서 개발한 심각한 면역결핍 모델로, 마우스의 T/B/NK 세포가 없으며 골수 성분 결함이 있습니다. Cyagen은 다양한 고형 종양과 혈액계 종양을 포함하는 세포주 유래 이종 이식(Cell line-derived tumor xenograft, CDX) 모델 라이브러리를 개발하였습니다. 이는 CAR-T 세포 치료의 효과를 연구하는 데 필요한 다양한 서비스를 제공합니다.
Cyagen의 CAR-T 치료 플랫폼은 완전한 검출 장비를 갖추고 있어 포괄적인 효능 서비스를 제공할 수 있습니다. 마우스 종양 모델 및 전이성 종양 모델을 감지하는 데 사용되는 마우스 in vivo in situ 이미징 시스템을 제공하며, 다양한 in vitro 분석의 downstream도 지원합니다.
사례 연구
1.1 CAR T 세포 치료
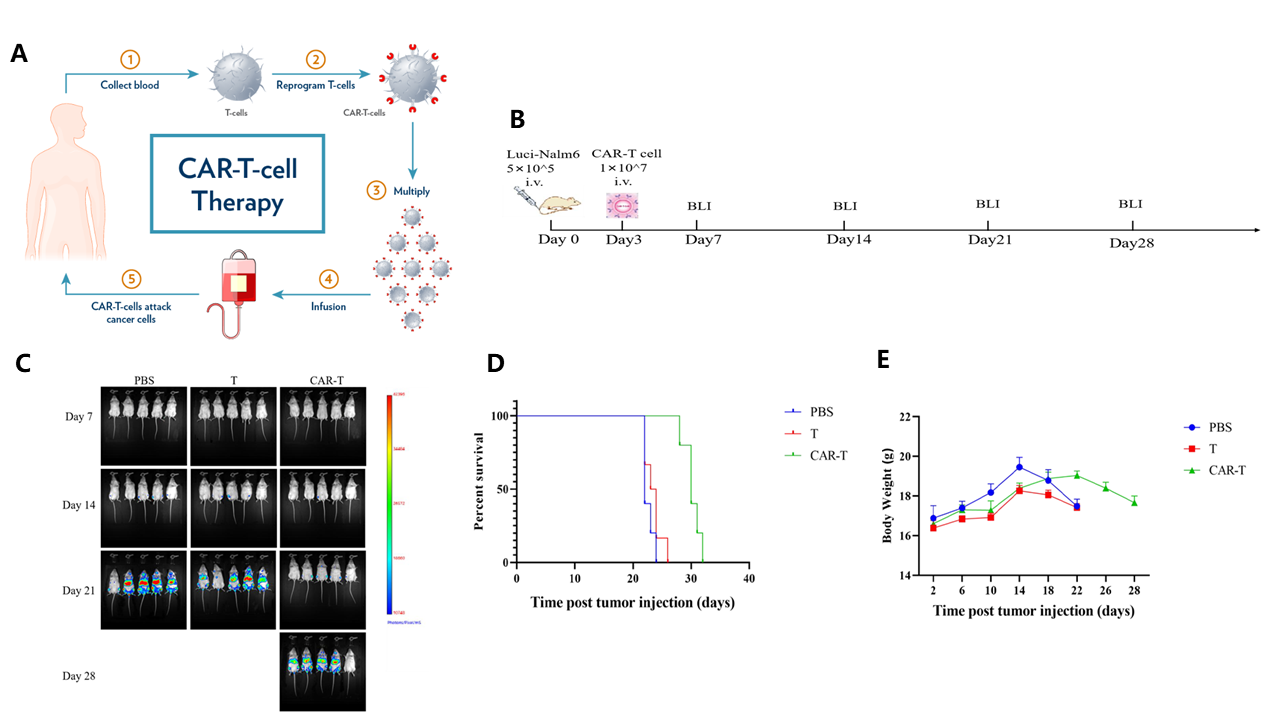
0일에 꼬리 정맥 주사를 통해 Nalm6-Luciferase 세포를 NKG 마우스에 접종한 후 3일째에 CAR-T 세포를 주입했습니다. 7일, 14일, 21일, 28일째에 in vivo 이미징을 사용하여 종양 부하(tumor load)를 평가했습니다. In vivo 이미징의 신호 강도에 따라 마우스의 종양 진행을 결정했습니다.
(A) CAR-T 치료 도식, 출처:
(B) Nalm6 세포 xenograft NKG 마우스 종양 모델에서 CD19 CAR-T 세포 치료의 실험 흐름도; (C) 종양 성장을 억제하고 마우스의 생존을 연장할 수 있는 CD19 CAR-T 세포의 효과를 보여주는 라이브셀 이미징(Live-cell imaging) 모니터링 결과; (D) 마우스 생존 곡선; (E) 마우스 체중 증가 곡선.
참고문헌:
1.2 항체 효능 평가
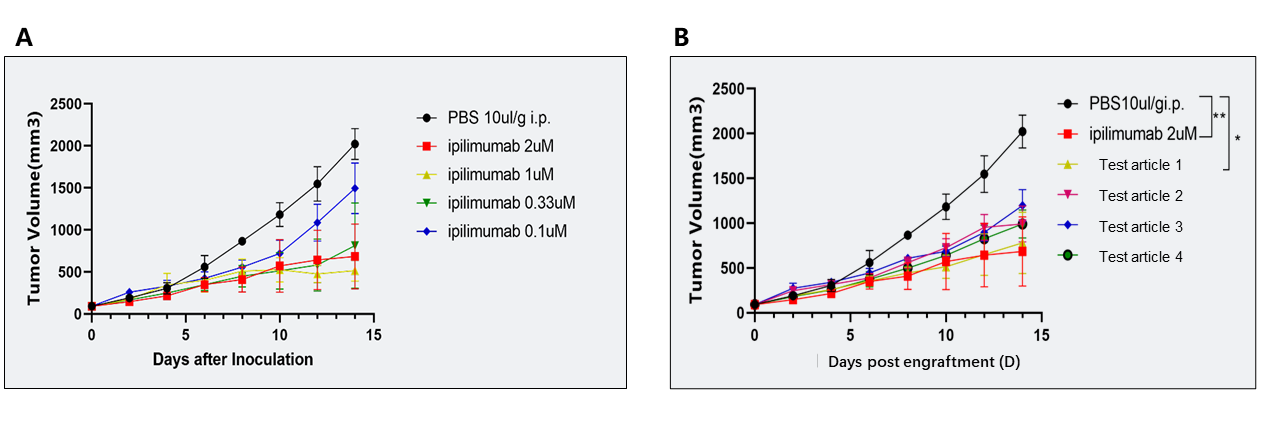
B6-hCTLA4 마우스에 MC38 마우스 대장암 세포를 이식하여 ipilimumab 및 테스트 약물의 항종양 효능을 평가했습니다.
(A) Ipilimumab에 의한 종양 용적 억제; (B) 약물에 의한 종양 용적 억제
2. 인간화 면역 시스템(Humanized Immune System, HIS) 마우스 모델의 범주
일반적인 인간화 면역 시스템 마우스 모델
대표적인 인간화 면역 시스템 마우스 모델로는 인간화 PBMC (huPBMC) 마우스와 인간화 HSC (huHSC) 마우스가 있습니다. Cyagen의 NKG 면역 결핍 마우스는 PBMC 또는 HSC를 이식하여 매우 효과적인 인간 면역 시스템 마우스 모델을 구축할 수 있는 다양성을 제공합니다.
이 혁신적인 접근법은 인간 면역 반응을 더욱 정확하게 시뮬레이션하여 종양 면역학, 자가면역 질환 및 특정 감염성 질환을 포함한 다양한 분야의 전임상 연구에 탁월한 모델을 제공합니다.
|
모델명 |
이식물 출처
|
프로젝트 기간 |
면역 재구성 상태 |
연구 응용 분야 |
|
Human peripheral blood mononuclear cells (PBMC) |
Achieving a humanization ratio of over 40% within 3 weeks. |
Predominantly T cells, accounting for over 90%. |
Tumor immunology research; anti-GvHD drug research; infectious disease research; gene therapy; drug target research without cross-reactivity; immunogenicity assays. |
|
|
Human hematopoietic stem cells (HSC) from umbilical cord blood. |
Reaching a humanization ratio of over 50% within 6 weeks. |
Reconstruction of various immune cells. |
Tumor research; immunology research; autoimmune disease research; drug metabolism and toxicity research. |
|
|
Human hematopoietic stem cells (HSC) from umbilical cord blood. |
Rapid reconstruction achieved in the 3rd week post-transplantation; |
Reconstruction of various immune cells, especially effective reconstruction of human-derived NK cells; |
Studies on NK cell development mechanisms, development of NK cell-related tumor immunotherapy, studies on antibody-dependent NK cell-mediated cytotoxicity (ADCC); research on human immune and hematopoietic systems. |
연구 사례
2.1.백신 효능 평가
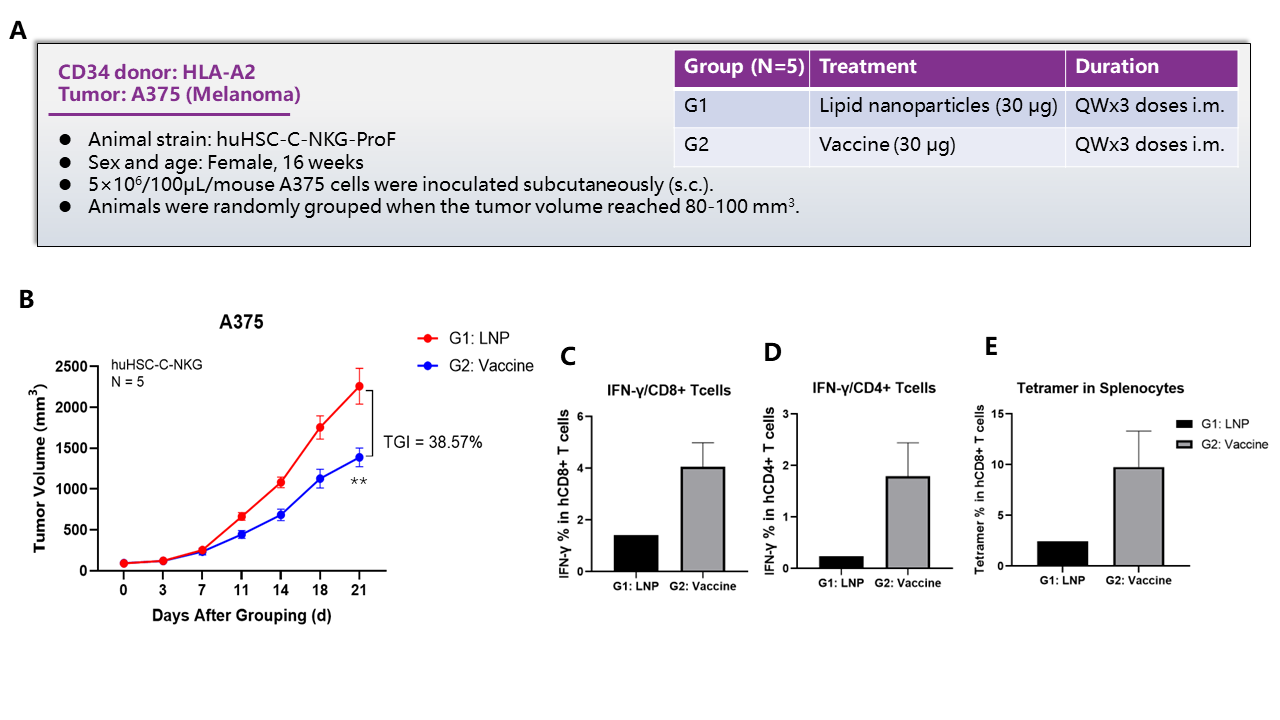
huHSC-NKG-ProF 마우스에 A375 접종 시 종양 용적의 감소를 유도하는 백신의 능력이 효능 평가의 데이터에서 보여줍니다. 이 백신은 CD8+ 및 CD4+ T 세포에서 IFN-γ 발현을 증가시키고 비장 세포(splenocyte)에서 tetramer를 증가시킬 수 있음을 보여줍니다.
(A) 연구 설계 계획; (B) 종양 용적; (C) CD8+ T 세포의 IFN-γ%; (D) CD4+ T 세포의 IFN-γ%; (E) 비장 세포(splenocyte)의 tetramer
3. 세포주 유래 이종이식(Cell line Derived Xenografts, CDX) 모델
세포주 유래 이종이식 모델(CDX 모델)은 인간 유래 종양 세포를 마우스에 이식하여 효능을 평가하거나 in vivo 종양 관련 연구를 수행하는 모델입니다. Cyagen은 폐암, 대장암, 방광암 등 다양한 암을 포괄하는 인간 CDX 종양 모델의 방대한 라이브러리를 구축하여 새로운 항암 치료제의 전임상 시험을 지원하고 있습니다. 이러한 모델들은 아래 표에 나열된 다양한 효능 연구 요구를 충족할 수 있습니다.
장점
세포주 유래 종양 이종이식(CDX) 모델
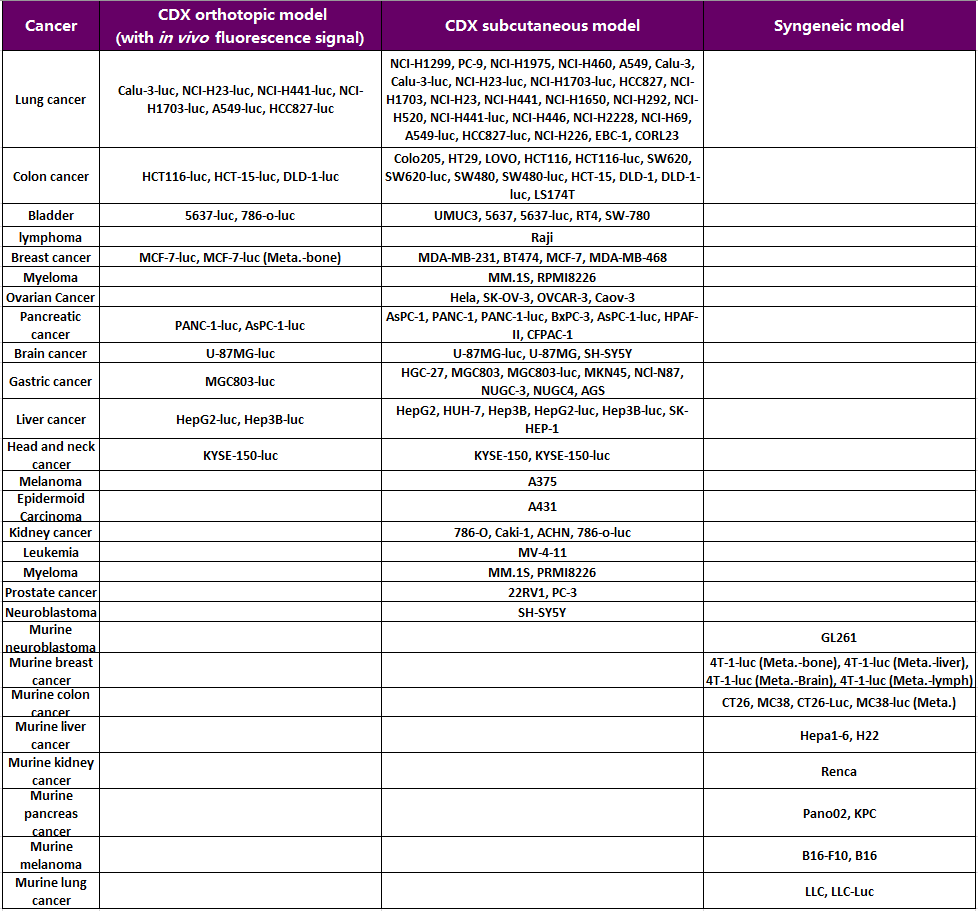
연구 사례
3.1. 유방암 및 암전이 모델
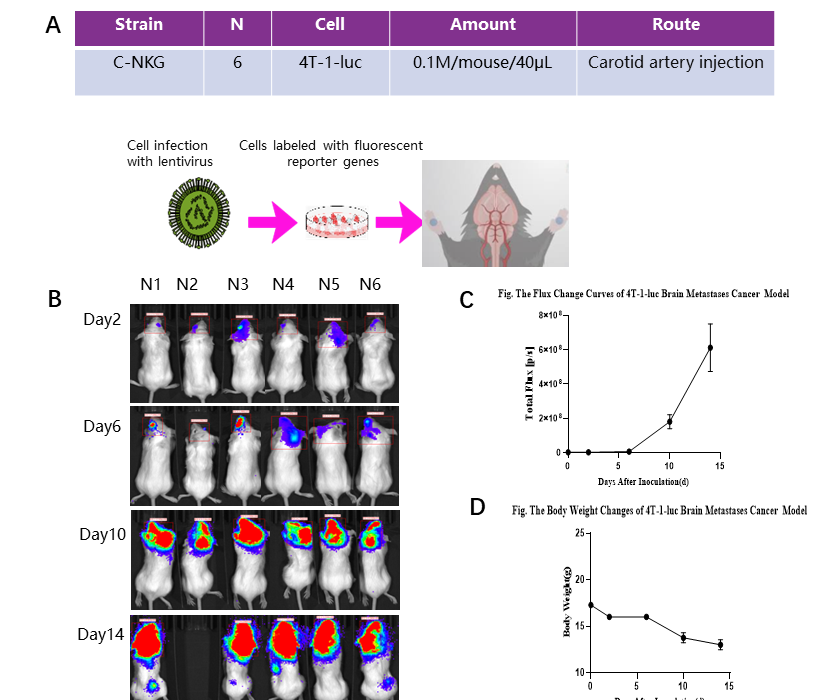
NKG 마우스에 경동맥 주사를 통해 4T-1-luc 세포를 접종했습니다. 2일째에 뇌 전이 신호가 감지되었습니다.
(A) 연구 설계; (B) In vivo 이미징 검출; (C) 4T-luc 뇌 전이 암의 플럭스(flux) 변화 곡선; (D) 체중 변화
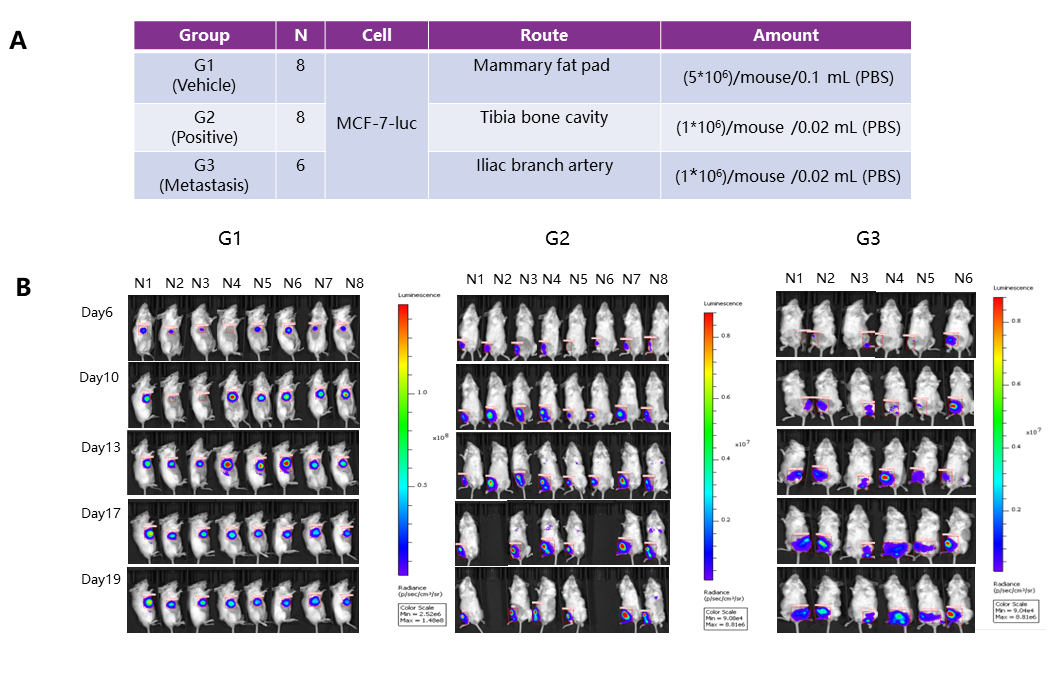
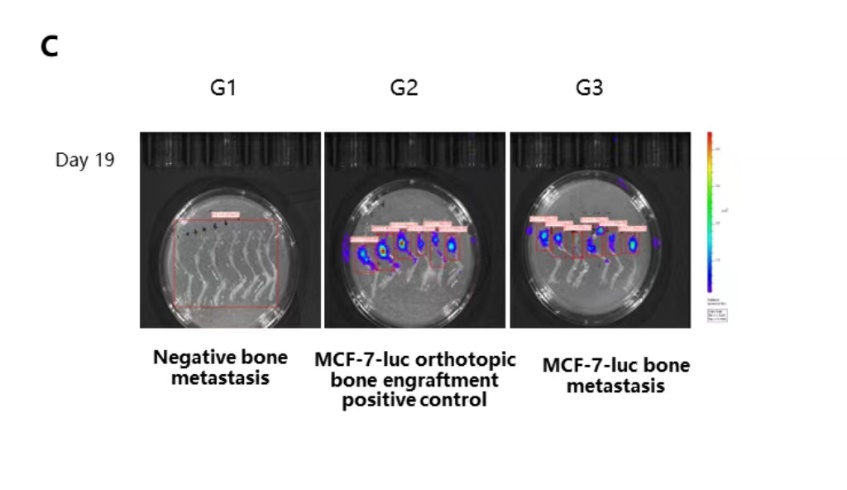
유선 지방 패드(mammary fat pad), 경골 골강(tibia bone cavity), 장골 분지 동맥 주사(iliac branch artery injection)를 통해 MCF-7-luc 세포를 접종하여 골전이(bone metastasis) 모델을 구축했습니다. 19일째에 장골 분지 동맥 주사(iliac branch artery injection)를 받은 그룹에서 골전이가 관찰되었습니다.
(A) 연구 설계; (B) In vivo 이미징 검출; (C) 골전이 이미징 검출
3.2. HCC827-LUC 인간 폐선암(lung adenocarcinoma) 동소이식 모델
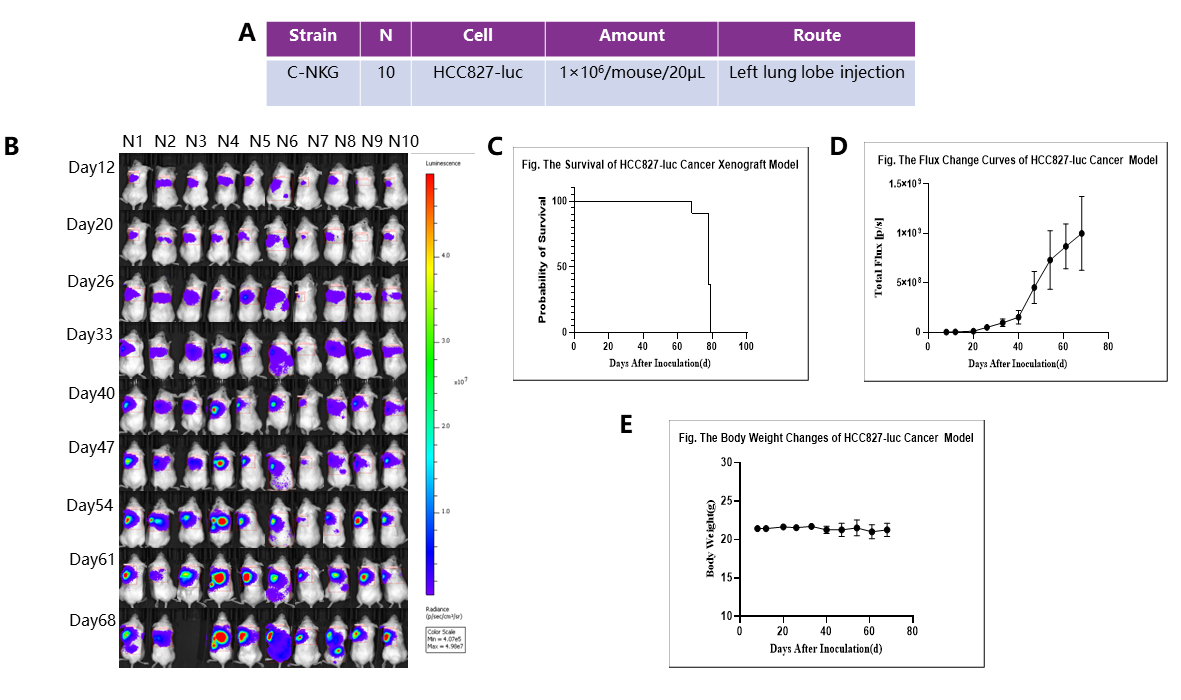
좌측 폐엽 주사를 통해 HCC827-luc 세포를 접종하여 폐 동소이식 모델을 구축했습니다. 12일째에 이 그룹에서 종양을 관찰하었습니다.
(A) 연구 설계; (B) In vivo 이미징 검출; (C) 생존율; (D) 플럭스(flux) 변화 곡선; (E) 체중 변화
3.3.1 MC38 암 동종 모델
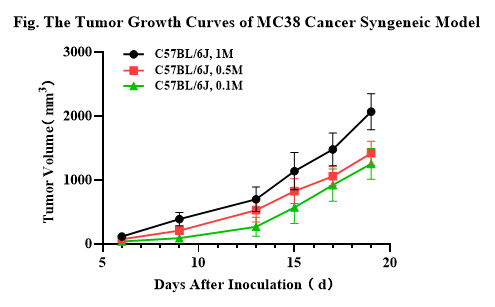
마우스 체내 MC38 대장암 세포의 피하 이식 종양 및 체중 증가 곡선 (n=8). 7주령의 C57BL/6J 마우스에 암세포 피하 접종을 하였으며, 다양한 시간대에 종양 용적을 측정했습니다. 세포 접종량은 각각 1×10^6/마우스, 5×10^5/마우스, 1×10^5/마우스였습니다. 데이터는 Mean ± SEM으로 제시됩니다. 결과는 MC38이 C57BL/6J 마우스에서 쉽게 모델링될 수 있음을 나타냅니다. 종양 용적은 접종 후 6일째에 100~200mm^3, 실험 종료 시점인 접종 후 19일째에 2,000mm^3에 도달할 것으로 예상됩니다. 치료 범위(therapeutic window)는 약 13일로 추정됩니다.
3.3.2 4T1 암 동종모델
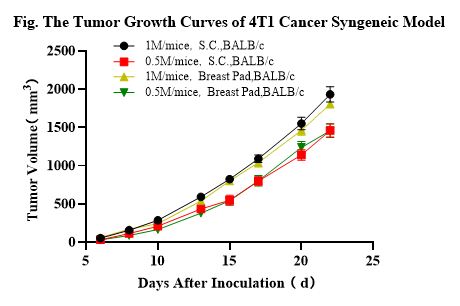
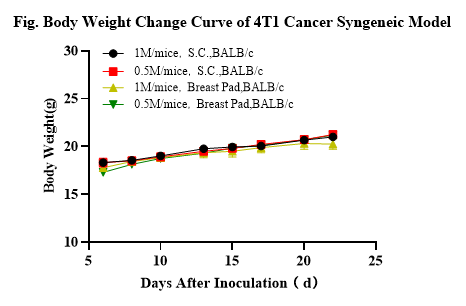
4T1 마우스 유방암 세포의 피하 이식(subcutaneous transplantation) 및 정위 이식(orthotopic transplantation)과 종양 용적 및 체중 증가 곡선 (n=10). 7주령의 BALB/C 마우스에 피하 주사와 유선 지방 패드 정위 주사(mammary fat pad orthotopic injection)를 통해 세포를 접종하고 다양한 시점에 종양의 용적을 측정했습니다.
세포 접종량은 마우스당 각각 1×10^6 및 5×10^5이었으며, 데이터는 Mean±SEM으로 제시됩니다. 결과는 4T1이 BALB/C 마우스에서 쉽게 모델링될 수 있음을 보여줍니다. 종양 용적은 접종 후 8일째에 100~200mm^3, 실험 종료 시점인 접종 후 22일째에는 2,000mm^3에 도달할 것으로 예상됩니다. 치료 범위(therapeutic window)는 약 14일로 추정됩니다.
문의 및 견적 요청
Cyagen은 무료 견적 문의를 제공합니다. 지금 바로 문의 신청하세요!
문의 양식을 제출하시거나 전화(010-5575-9973) 또는 이메일(service-apac@cyagen.com)로 연락해 주시면, 신속한 답변을 드리겠습니다.