

랫드의 배아를 통제하는 사람들의 능력 향상과 CRISPR/Cas9 기술의 출현으로 랫드를 기초 연구, 약물 스크리닝 및 전임상 약물 평가에서 실험 동물로 적용하는 범위가 확대되었다. 그러나 가장 중요한 유전자 조건부 발현 방안으로 Cre-LoxP 시스템에서 랫드 품종이 마우스 품종보다 훨씬 적어 랫드에 대한 활용을 크게 저해하고 있다. Cre-LoxP 시스템은 마우스에서 널리 사용되어 왔고, 많은 유전자에 상응하는 LoxP 마우스가 있으며 특정 프로모터를 가진 Cre 마우스 종류도 상당히 풍부하다. 그러나 랫드의 경우 유전자 편집 기술이 발달하지 않아 현재 LoxP 랫드이든 조직 특이성의 프로모터에 연결된 Cre 랫드이든 그 종류가 마우스보다 훨씬 적다.
과배란 rat는 수정된 배아의 비율이 낮을 뿐만 아니라 기형 배아의 비율이 높고, 난세포의 strain과 개체 간 차이가 심하며, rat의 핵막과 원형질막이 더 두껍고 더 탄력성이 있어 주입하기가 더 어려워진다. 이와 같은 다양한 어려운 문제에 대하여 Cyagen은 제작 과정의 모든 측면을 지속적으로 최적화하고 생산 기술의 여러 방면에서 상당한 개선 및 발전을 이루었으며, 이러한 개선을 통하여 더 복잡한 유전자 변형 rat 모델의 제작을 가능하게 만들었다. 또한, Cyagen은 Knock-Out, Point mutation, Knock-In 등 다양한 유전자 변형 rat 제작 서비스를 제공할 수 있을 뿐만 아니라 SD, Wistar, Long Evans, F344, Brown Norway 와 같은 다양한 품종의 rat도 선택 가능하다. 이 외에도, Cyagen은 전세계의 연구자들이 이용할 수 있는 다양한 rat line을 포함한 Cre model repository를 구축하고 있다.

*Note: 위에 나열된 Cre line 외에도 다른 품종의 rat 모델이 필요한 경우 Cyagen에 연락주시고 맞춤형 서비스를 받으세요.
Conditional 유전자 변형 동물을 얻기 위해서는 Cre rat가 LoxP rat와 1~2 세대 outbreeding을 진행해야 하며, Cre 효소의 낮은 효율과 일정한 누출 가능성도 연구 진행에 영향을 미칠 수 있다. 따라서 연구 요구에 부응하여, 바이러스에 의해 유도된 과발현/ Knock-Out/ Point mutation/ Knock-In rat 모델이 출현하였다.
현재 주로 사용되는 바이러스 발현 시스템은 아데노바이러스, 렌티바이러스 및 아데노연관바이러스 세 가지 발현 시스템으로 나누며 각각 장단점이 있다.
1) 아데노바이러스의 장점은 발현 효율이 높고, 발현 시작 시간이 빠르며, 상대적으로 큰 packaged DNA 단편이 있다는 것이다. 그러나 아데노바이러스는 면역원성과 독성이 강하여 일반적으로 분리된 세포의 트랜스펙션에 적합되며 in vivo 동물에 사용되면 동물 사망률이 높고 실험 윈도 피리어드가 짧다.
2) 렌티바이러스는 DNA로 역전사되어 숙주 유전자에 영구적으로 통합되기 때문에 표적 유전자가 장기간 안정적으로 발현될 수 있다. 렌티바이러스는 가장 일반적으로 사용되는 유전자 전달 바이러스 시스템이며 아데노바이러스보다 훨씬 적은 면역원성을 가지고 있다. 또한 렌티바이러스는 in vivo 트랜스펙션에도 사용될 수 있지만 역가, 효율성 및 면역원성이 더 우수한 아데노연관바이러스에 비해 부족한 점이 있다.
3) 아데노연관바이러스의 가장 큰 장점은 극도로 낮은 면역원성이 가능한 한 숙주와의 장기적인 공존을 보장할 수 있다는 것이며, 생물안전성도 높아 생물안전성 등급이 낮은 실험실에서 실험을 할 수 있다. 다양한 혈청형으로 조직에 대한 친화도가 달라 전신주사인 경우에도 조직특이성이 강하며, 국소주사(localized injection)으로 보완하면 실험에서 조직 세포의 정확도를 크게 향상시킬 수 있다. 아데노연관바이러스는 in vivo 실험에 가장 적합한 tool 바이러스이지만 클로닝 용량이 부족하다는 문제가 있다.
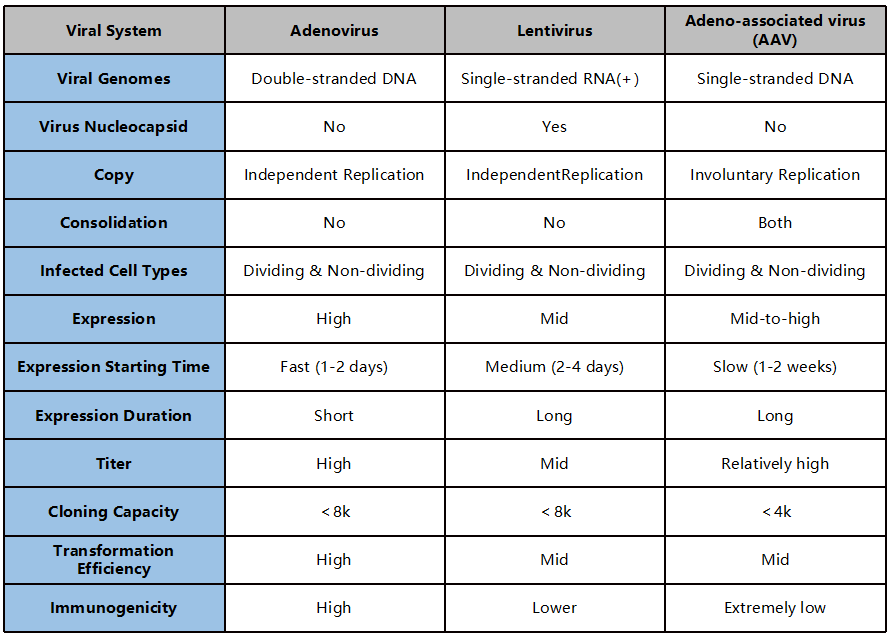
그림1. 세 가지 일반적인 바이러스 벡터 비교
Conditional 유전자 변형 동물 모델 생성을 위한 위의 세 가지 바이러스 벡터 발현 시스템의 장단점을 비교 한 결과, AAV 벡터에 의해 매개된 tissue-specific 발현이 다른 두 바이러스 시스템보다 더 나은 효과를 갖는다는 결론을 내릴 수 있다.
여기서 주의해야 할 점은 AAV 주입에 의해 생성된 특이성 발현은 단순히 시간을 절약하기 위한 미봉책이 아니다. 생명과학 연구에서 생체 내 실험의 불확실성과 현재 개발된 연구 방법의 다양화로 인해 여러 방법을 사용한 교차 검증은 연구 결과를 뒷받침하고 논문의 질을 향상시킬 수 있다.
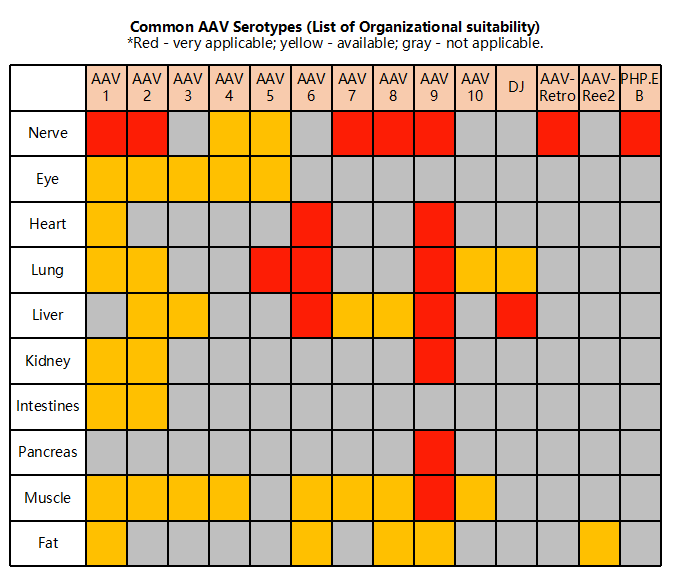
그림2. 다양한 AAV의 조직특이성
또한, 아데노연관바이러스(AAV)는 종종 Cre 또는 LoxP 랫드와 함께 사용된다. 연구자들이 더 많은 LoxP 및 Cre 랫드를 개발하고 있지만 이 과정은 하루아침에 이뤄지지 않는다. Conditional 유전자 변형 동물을 얻기 위해서는 Cre rat가 LoxP rat와 1~2 세대 outbreeding을 진행해야 하며, Cre 효소의 낮은 효율과 일정한 누출 가능성도 연구 진행에 영향을 미칠 수 있다. 따라서 현재 가장 안정적인 전략은 Cre rat와 LoxP rat를 개발하면서 AAV 바이러스를 이용해 기존 LoxP rat에서 조직 특정 작업을 수행하는 것이다. 바이러스 벡터의 제작 시간은 동물이 실험에 사용 가능한 수량으로 번식하는 데에 필요한 시간보다 훨씬 짧기 때문에 이러한 방법을 통해 동물의 표현형을 최대한 빨리 연구하고 검증할 수 있으며, 후속 연구 전략과 방향을 가능한 한 빨리 결정할 수 있어 연구 프로젝트 시간을 크게 절약할 수 있다.
최근 몇 년 동안 Cre-LoxP 동물은 유전자의 공간 특이성에 대한 연구에서 성숙했지만 전입된 프로모터가 여러 조직에서 동시에 발현되는 경우도 있으며, 이때 하나의 조직에만 초점을 두면 다른 조직에서 Cre의 발현이 여전히 우리의 연구 정확성에 방해를 줄 수 있다. 이 문제를 완벽하게 해결할 수 있는 방법은 AAV의 fixed-point 주입이다. 왜냐하면 우리가 연구하고자 하는 조직에 바이러스를 주입하기만 하면 되고 구역 특이성이 매우 강하기 때문이다.
유전자 변형 마우스를 더 잘 활용하기 위해 AAV 주입의 방안은 2가지로 나눌 수 있다. 하나는 LoxP rat가 있는 경우, AAV 벡터 조직특이성 Cre를 주입할 수 있다. 반대로 Cre rat가 있는 경우, LoxP 부위에 연결된 표적 유전자 또는 다른 요소를 packaging한 바이러스를 주입할 수 있다. 하지만 일반적으로 조직특이성 Cre에 대한 AAV 벡터가 더 흔하다.
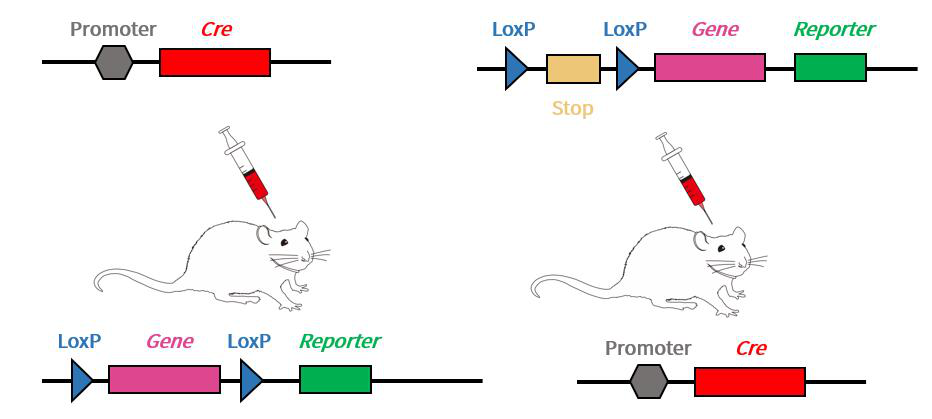
그림3. 조건부 발현을 위해 마우스와 결합된 AAV 바이러스 패키징 DNA
AAV에 의해 매개된 Conditional 유전자 변형에는 위에서 언급한 많은 장점이 있지만 단점도 있다.
1) 크기 제한: AAV 주입의 단점은 패키징 단편의 길이가 짧다는 점이며, 이는 일부 큰 유전자 단편에 대한 적용 범위가 제한된다. 이러한 크기 제한은 종종 리포터 유전자와 같은 부속 유전자 요소에 대한 취사선택이 필요하고 프로모터의 선택에도 제한을 받는다.
2) Injection training: High-precision AAV주입은 일관된 모델링을 보장하기 위해 적절한 연습이 필요하며, 이는 실험을 시작하기 전에 추가 비용과 시간을 발생시킨다. 특정 뇌 부위를 정확하게 조준해야 하는 뇌 주사의 경우, 상대적으로 쥐의 뇌 크기가 작을수록 AAV 투여가 더욱 어려워진다. 바이러스는 세포 자체에서 생성되지 않는 외부 물질이기 때문에 주사 부위의 농도분포가 불균일하게 일어나 실험 결과에 영향을 미칠 수 있다. 주사 중앙의 바이러스 함량이 주변 영역보다 높다는 것은 잘 알려져 있지만 유전자 변형의 위치를 정확하게 파악하려면 여전히 추가 연습이 필요할 수 있다.
3) 비용 문제: 대부분의 경우Conditional 발현을 위해 AAV를 사용하는 비용은 Cre-LoxP 마우스의 비용보다 저렴하지만 다음과 같은 두 가지 예외가 있다.
a. 전신 주입-엄청난 양의 바이러스 벡터가 필요하며, 바이러스가 주입되는 동물의 수가 증가함에 따라 비용은 선형적으로 증가한다.
b. 하이브리드 마우스– 큰 초기 투자 비용과 동물 사육 단계 비용이 발생하지만, strain이 성공적으로 제작되었으면 이변이 없는 한 지속적으로 사용할 수 있고 후기비용은 소폭 감소한다.
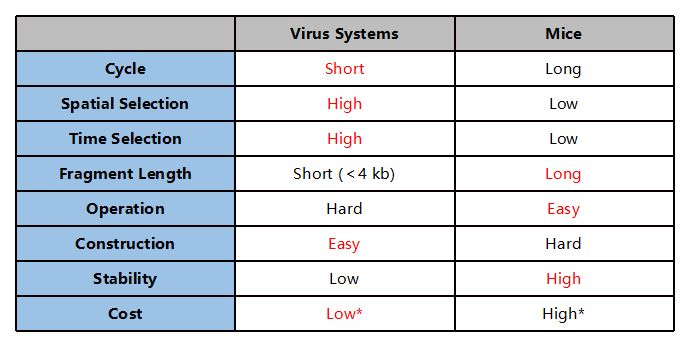
* Positional injection 및 단기실험 비용에는 장점이 있다.
그림4. 바이러스 및 Conditional Knock-Out 마우스 비교
결론적으로, 두 가지 방법의 장단점을 충분히 고려해야 연구에 적합하는 최적의 사용을 보장하는 데 도움이 될 수 있다. 조건이 허용되면 AAV-assisted Conditional Knock-Out 동물과 전통적인 Cre-LoxP 동물은 상호 보완적이며 상호 검증 가능하다. 게다가 rat가 대사, 심혈관 및 신경학적 측면에서 무한한 잠재력을 가지고 있기 때문에 이러한 질병에 대한 보다 완전한 모델을 제공하고 생의학 연구에 없어서는 안될 조력자가 된다.
References:
1. Dietrich, M.R., R.A. Ankeny, and P.M. Chen, Publication trends in model organism research. Genetics, 2014. 198(3): p. 787-94.
2. Haery, L., et al., Adeno-Associated Virus Technologies and Methods for Targeted Neuronal Manipulation. Front Neuroanat, 2019. 13: p. 93.
3. Tsien, J.Z., Cre-Lox Neurogenetics: 20 Years of Versatile Applications in Brain Research and Counting. Front Genet, 2016. 7: p. 19.
4. Meek, S., T. Mashimo, and T. Burdon, From engineering to editing the rat genome. Mamm Genome, 2017. 28(7-8): p. 302-314.
5. Balakrishnan, B. and G.R. Jayandharan, Basic biology of adeno-associated virus (AAV) vectors used in gene therapy. Curr Gene Ther, 2014. 14(2): p. 86-100.
6. Kim, H., et al., Mouse Cre-LoxP system: general principles to determine tissue-specific roles of target genes. Lab Anim Res, 2018. 34(4): p. 147-159.




영업일 기준 1-2일 내에 답변해 드리겠습니다.