

Dr. Liu
동화 속 이야기는 모두 거짓이지만, 누구나 마음속에 있는 동화는 아름답고 희망과 기대감으로 가득 차 있다. COVID-19에 직면했을 때, 바로 이러한 희망이 모두를 끊임없이 견지하고 분투하도록 지탱하고 있다. 과학자들은 현재까지 자체 연구개발과 단체협력을 통해 중화항체 약물 개발 및 백신 II기 임상시험에 성공해 후속 실험에서 인간과 바이러스의 전쟁에서 좋은 결과를 기대하고 있다.
본문에서 중화항체 및 백신 설계와 관련된 문제를 논의 하려고 한다: 중화항체 연구의 의의가 무엇일까? 백신의 현재 성과는 무엇이 있을까? 어떻게 하면 우리가 실험동물을 통해 백신의 안전성과 유효성을 검증할 수 있을까?
바이러스가 인체에 침투할 때, 인체는 상응하는 항체를 발생시켜 바이러스를 중화시키고, 바이러스의 인체 침해를 감소시키며, 병원 미생물이 표적세포 수용체에 달라붙어 세포에 침입하는 것을 막는다.
일반적으로 COVID-19 같은 신종 전염병 연구는 3급 이상 생물안전실험실에서 해야 한다. 그러나 바이러스학 연구에서 연구자들은 가상 바이러스의 응용이 바이러스 중화성 항체 약물 및 백신을 탐구하는 연구에 유용하고, 가상 바이러스가 전파력이 없기 때문에 해당 바이러스에 대한 연구 환경은 특별히 엄격하지 않고 생물안전 2급 이상이면 조작할 수 있다.
SARS-CoV-2 가상 바이러스 중화항체 연구를 말하려면 SARS부터 말하여야 한다. SARS는 2005년에 폭발하였으며 사람들을 당황하게 했다. 사스 바이러스가 빨리 오고 가는 바람에 관련 연구가 난항을 겪었지만 여전히 많은 프로젝트가 진행되고 있어 오늘날의 SARS-CoV-2에 대한 연구에 도움이 된다. 먼저, 2005년 영국 런던대학교의 Robin A. Weiss 교수팀이 Emerging infectious Disease에 발표한 문헌 ‘Longitudinally Profiling Neutralizing Antibody Response to SARS Coronavirus with Pseudotypes’를 살펴보자. SARS-CoV 글루텐S는 중화항체의 주요 표적으로, 레트로바이러스S 관련 가상 바이러스를 구축해 SARS-CoV의 중화항체 제작에 성공했으며 이 항체가 환자 SARS-S 단백질에 중화반응을 보인다는 사실을 밝혀냈다. 이 연구는 자연감염 과정에서의 중화항체 효가와 백신 임상 전 평가에 중요한 의미를 갖는다. 또한 연구자가 마우스와 햄스터에서 실시한 임상 전 연구에서 중화항체가 살아 있는 바이러스의 공격에 취약하다는 사실을 발견하였고, 이러한 연구 결과는 중화항체 약물의 연구가 어느 정도 바이러스의 침입에 저항할 수 있다는 것을 보여줬다.
다시 2020년 3월로 시간을 돌려 중국 의과원병원 미생물연구소가 Nature Communication에 발표한 연구논문에 따르면 가상 바이러스 시스템을 이용해 SARS-CoV-2-S 단백질이 바이러스가 세포에 침입할 때 어떤 특징을 보이는지 증명하고 SARS-CoV와 발생하는 면역교차반응에 대해 설명한다. 이 연구는 렌티 바이러스인 SARS-CoV-2-S 가상 바이러스 시스템을 사용해 Huh7, Vero81, LLCMK2, Calu3 등의 세포가 이 시스템에 반응하는 것을 확인했으며 바이러스와 수용체 ACE2가 결합해 세포에 들어가는 경로도 상세히 기술했다. CoV S단백질은 전형적인 I종 바이러스 융합단백질로서 S단백질의 융합잠재력을 활성화시키기 위한 프로테아제 절단이 필요하며 바이러스 S단백의 S1과 S2사이에 절개를 하고 바이러스 주와 세포 유형에 따라 CoV S단백질이 한 종류 또는 몇 가지의 숙주 프로테오신 효소에 의해 잘릴 수 있으며 플린단백질효소, 조직 프로테아제, 트라미노신 프로테아미노신 2(TSSRMPRMP), TRSS-2이들 프로테아제가 표적세포에 존재하는 것은 코로나바이러스가 질막을 통과하는지 아니면 엔도시토시스 작용을 통해 세포에 유입되는지를 크게 좌우한다.
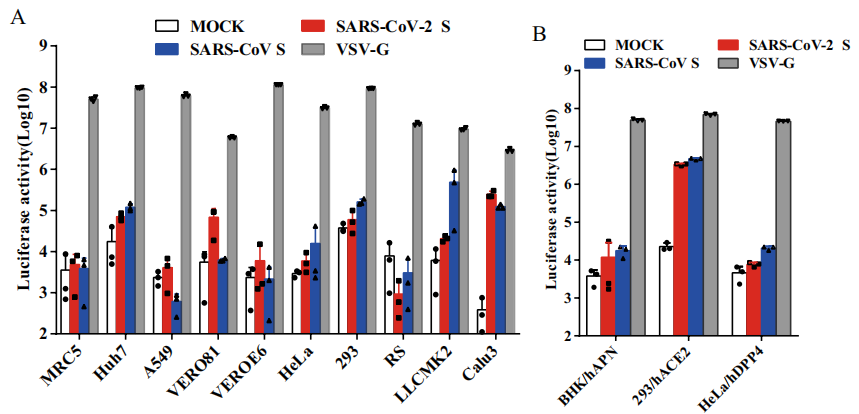
그림1. SARS-CoV-2-S가상 바이러스 세포 침투
(Xiuyuan Ou et al. 2020)
진일보 가용성 hACE2를 사용하는 스트로보의 세포술과 경쟁억제실험 분석은 사스-CoV-2와 사스-CoV 두 바이러스의 S단백질을 모두 hACE2 바이러스로 결합한 수용체로 검증했다.
코로나바이러스 S단백질은 바이러스 독성의 핵심 인자로 바이러스 독성, 친화성, 숙주 범위를 결정하는 핵심 부분이며 중화 항체와 백신 설계하는 주요 표적이다. 그렇다면 SARS-CoV-2-S와 SARS-CoV-S에 미치는 교차면역은 어떻게 나타날까?
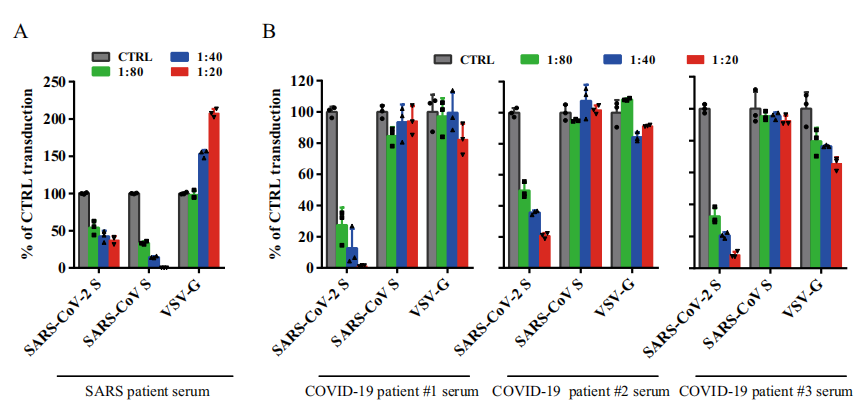
그림2. SARS와 COVID-19환자 혈청에 유한적 교차 중화 반응
(Xiuyuan Ou et al. 2020)
연구에 따르면 회복된 SARS 환자의 혈청은 SARS-CoV S 가상 바이러스 입자의 침입에 강한 억제성을 보이며 SARS-CoV-2 S 가상 바이러스 입자에 대해 적당하게 활성을 중화 시킨다.
시간이 흐를수록 7월에 중화항체 연구 결과가 진전을 보이면서 각종 긍정적인 결과는 역병의 미래에 대한 자신감을 갖게 한다. 베이징대학교 게놈학선진혁신센터(ICG)와 생물의학선봉혁신센터(BIOPIC) 등은 9일 Cell에 발표한 문헌에서 페렴 재활환자의 B세포에 대한 고(高)통량 단세포측정을 통해 SARS-CoV-2에 대한 유효 중화항체를 검출했다고 밝혔다.
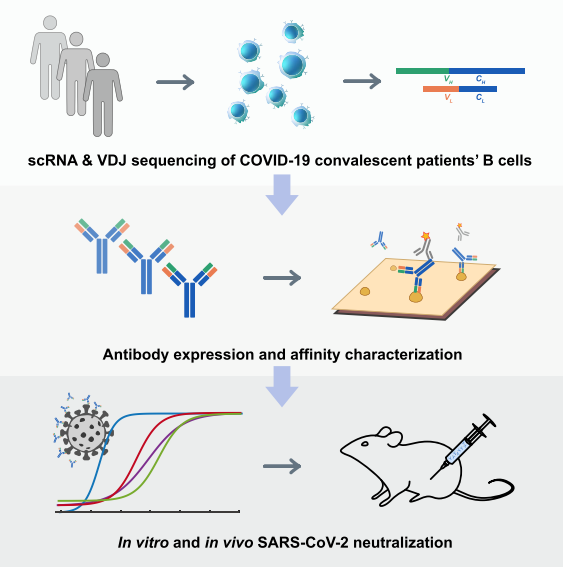
그림3. SARS-CoV-2 중화항체의 생성
(Yunlong Cao et al. 2020)
연구는 고통량 scRNA/VDJ-seq를 통해 8,558개의 IgG1+항원결합복제형을 감정한 결과 60명의 재활환자 중 14가지의 유효한 SARS-CoV-2 중화항체를 SARS-CoV-2 euvirus와 SARS-CoV-2 VSV pseudovirus 시스템으로 검증했으며 그중 가장 효율적인 중화항체 BD-368-2을 발견했다. 또 생물정보학적 분석방법을 이용해 단일 복제항체인 CDR3H 구조를 예측한 결과, mAb에서 사스-CoV와 항체 m396의 높이가 비슷한 CDR3H 구조가 사스-CoV-2에 대해 매우 높은 중화효력이 있음을 확인했다.
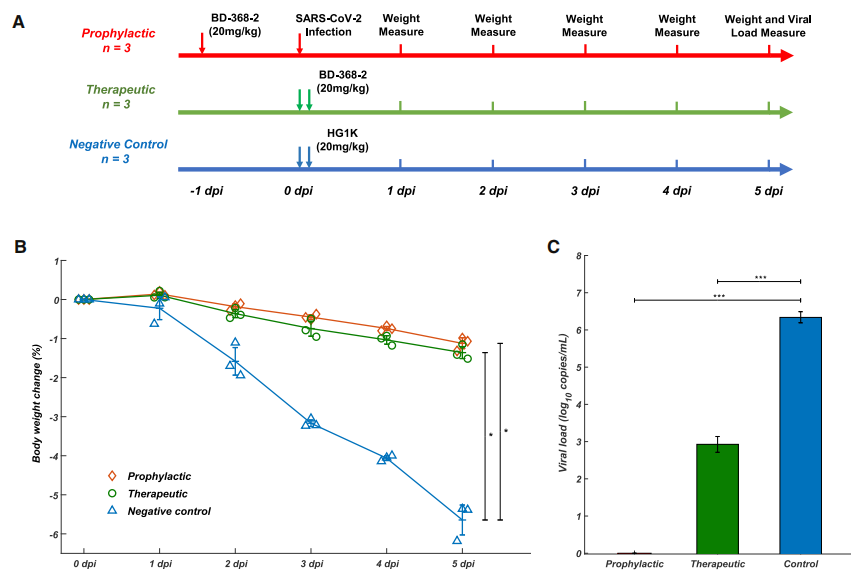
그림4. BD-368-2는 사스-CoV-2에 감염된 hACE2 유전자 변형 마우스에 대한 치료와 예방 효과가 높다.
(Yunlong Cao et al. 2020)
7월 23일 중국과학기술원 생물물리소 왕상희 연구원은 여러 팀과 합작해 식균체 전시기술을 통해 코로나바이러스 항체 bank를 구축한 뒤 β코로나 바이러스에 대해 고통량의 중화 능력을 가진 항체 H014 한주가 검출됐다고 밝혔다.
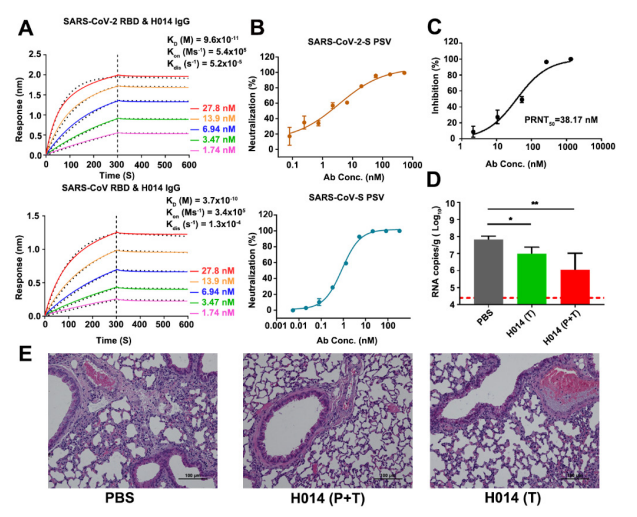
그림5. 교차 중화항체 H014 검증
(Zhe Lv et al. 2020)
인간화 단클론 항체 H014로 S수용체결합역(RBD)과의 결합으로 SARS-CoV-S PSV pseudovirus와 SARS-CoV-2 euvirus를 효과적으로 중화시킨다. hACE2 마우스 모델에서 H014의 급약은 폐에 감염된 사스-CoV-2 바이러스의 drops를 낮춰 폐의 병리 변화를 감소시킨다.
위 연구는 항체 선별을 중화하는 방식과 그에 따른 검증 결과를 제공해 왔으며, 항바이러스 약물 개발의 중요한 지도적 의미와 함께 백신 표적 탐색을 위한 방향을 제시하였다.
7월21일까지 세계적으로 25종의 SARS-CoV-2 후보 백신이 임상시험에 들어갔으며 이 중 최소 4종은 III기 임상시험에 들어갔다.
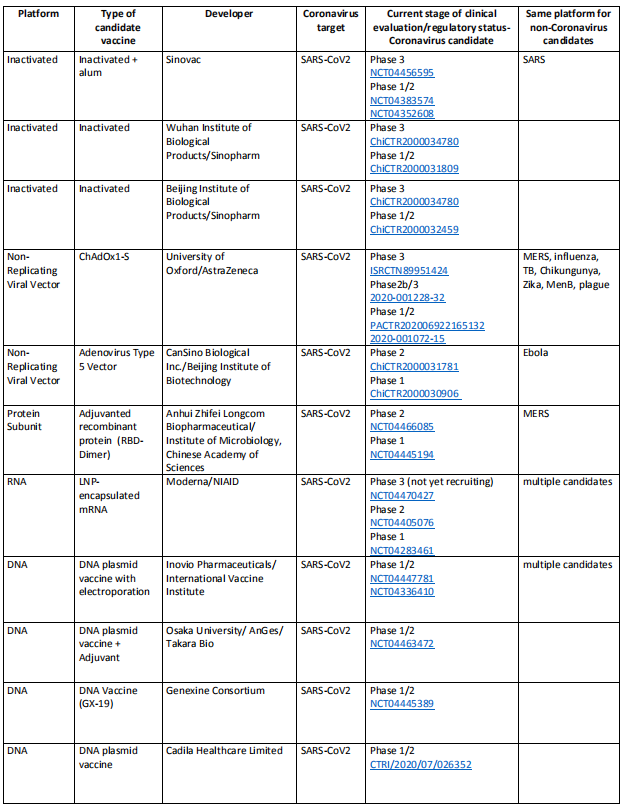
포1. 백신 현황
백신은 병원 미생물을 인공attenuated, inactivation 또는 유전자 공학 등의 방법으로 제작한 전염병 예방에 사용하는 자동면역제제다. 전통적인 백신은 인공능동면역과 피동면역백신, 인공능동면역백신은 사멸백신, attenuated 백신, 독소백신 등 세 종류다.인공 피동면역 방식은 항독, 사람 면역 글로불린 제제, 세포인자 제제, 단일 복제 항체제 등 네 가지다. 두 가지 방식의 면역 모두 인체의 면역을 강화시켜 전염병의 발생을 감소시킨다. 과학의 진보는 백신 제조방식의 혁신을 가져왔으며, 기존에 개발된 새로운 백신 유형으로는 서브유니트 백신, 결합 백신, 합성 펩타이드 백신, 유전자 공학 백신(재조합 항원 백신/ 재조합 벡터 백신/ DNA-RNA 백신/ 유전자 변형 식물 백신)이 있다.
다시 SARS-CoV-2 백신 연구를 말하자면 2020년 7월 14일 미국 모데나사가 개발한 후보 백신 mRNA-1273 사용량이 100mg에서 인체가 좋은 중화항체반응과 Th1 CD4형 세포면역 응답에 치우쳐 상대적으로 불량이 온화해져 후기 임상시험이 진행 중이다. 옥스퍼드대와 군사의학과학원의 천웨이원사 팀은 아데노바이러스 백신 ChAdOx1 nCoV-19(AZD1222) II기 임상 결과 아데노바이러스 어드바이저 후보 COVID-19 백신의 면역원성과 안전성을 평가해 후보 백신 적합 사용량을 다음 단계 유효성 연구에 적용한 것으로 20일 밝혀졌다. 같은 달 20일 독일 바이오엔텍은 미국 화이자 등과 함께 인쇄본 사이트인 medRxiv에 RNA 백신의 1/2기 임상시험 결과를 발표했다. 지질 나노입자 처리를 통한 RNA 백신은 피험자의 세포 면역 응답과 체액 면역 응답을 자극한다. 연구 결과에 따르면 BNT162b1 코딩 SARS-CoV-2 렙틴의 수용체결합역(RBD), BNT162b1로 발현된 RBD 항원과 T4 셀룰로오스에서 파생된 폴드온(foldon) 삼중구조역이 융합돼 다중가재조합을 통해 면역원성을 증가시킨 것으로 밝혀졌다.
이 같은 성과는 과학기술의 발전과 인류의 진보를 보여 주지만 백신 안전효용 평가 과정에서 ADE(antibody-dependent enhancement) 효과를 충분히 감안하지 않을 수 없다.
그렇다면 ADE란 무엇일까? 1964년에 Hawkes 등이 충매 바이러스 연구에서 항체 의존성 감염증이라는 가설을 언급하면서 ADE가 저농도 면역혈청에서의 복제가 억제되지 않고 촉진되는 것으로 나타난 것도 당초 뎅기열 출혈증과 뎅기열 쇼크 증후군의 주요 원인이었다. 그렇다면 SARS-CoV-2에 대해서도 이런 우려가 나올 수 있을까?
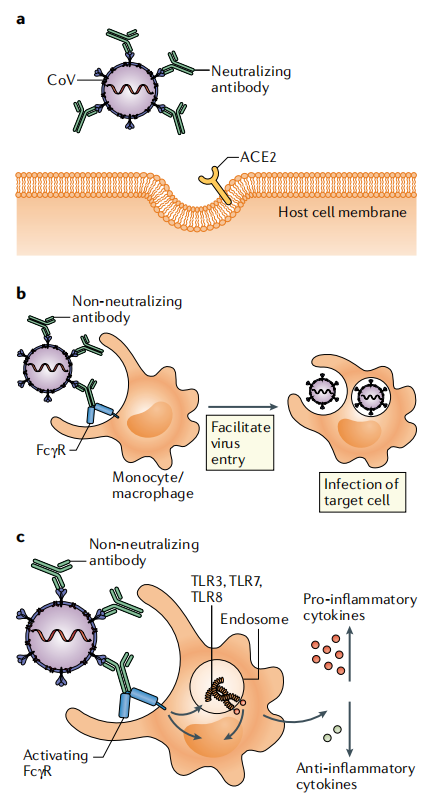
그림6. 코로나바이러스 항체 반응의 잠재적 결과
a. 항체에 의해 매개된바이러스 중화 과정에서 바이러스 spike 단백질에 대한 수용체 결합구조역(RBD) 및 기타 구조역을 결합한 중화항체가 수용체 ACE2에 달라붙는 것을 방지한다.
b. 감염의 항체 의존성 증대 과정에서 낮은 질량, 적은 양, 비중화성 항체가 Fab 구조역을 통해 바이러스 입자와 결합한다.단핵세포 또는 대식세포에 발현된 Fc수용체(FcR)가항체 Fc구조 도메인과 통합하여 바이러스의 유입과 감염을 촉진한다.
c. 항체에 의해 매개된면역증강 과정에서 저품질, 소량, 비중화성 항체와 바이러스 입자가 결합된다.Fc구조역과 수용체가 결합된 후 FcR가 신호를 작동하고, 촉염성 세포인자 상향 조정되며 동시에 항염성 세포인자가 하향 조절된다. 면역복합체와 바이러스 RNA는 톨-유사 수용체3(TLR3) TLR7 또는 TLR8을 통해 숙주세포를 활성화시켜 면역병리학적 현상을 유발한다.
연구에 따르면 SARS-CoV 감염에서 ADE는 바이러스가 다양한 면역 세포(대식 세포,단핵 세포, B 세포 포함)에서 발현된 Fc 수용체( FcR )와 결합하여 발생한 것이다. 미리 존재하는 SARS-CoV 특이성 항체는 바이러스가 FcR를 발현한 세포에 들어가는 것을 촉진할 수 있다. 실제로 ADE를 통한 대식세포 감염은 효과적인 바이러스 복제나 탈락을 초래하지 않는다. 반면에 바이러스 항체면역복합체의 인터널리제이션은 FcRs5를 통한 골수성 세포의 활성화로 염증과 조직손상을 촉진할 수 있다. 이 경로를 통해 유입되는 바이러스는 패턴인식 수용체 TLR3, TLR7 및 TLR8과 결합될 수 있다. 대식세포는 ADE를 통해 SARS-CoV를 흡착하여 TNF와 IL-6의 생산을 증가시킨다. 따라서 백신 개발 과정에서 나타날 수 있는 ADE 효과를 고려하지 않을 수 없다. 그러면 인간에서 이러한 현상을 최대한 피하는 방법은 무엇일까? 그것은 바로 백신 적용 전에 동물 모델의 안전성 검증이다.
약물 개발이든, 백신 개발이든 전임상 In vivo 안전성 평가와 유효성 평가는 실험 동물을 벗어날 수 없다. 생물 과학의 발전을 되돌아 보면, 동물 모델은 성게에서 효모, 선충류, 그리고 이제 질병 연구에 널리 사용되는 마우스에 이르기까지 오랜 과정을 거쳤다. 게놈이 인간과 90% 동일하며 조작이 쉽기 때문에 마우스는 가장 좋은 실험 동물 모델이 되었다.
COVID-19 사태가 벌어진 이래 전통적인 유전자 변형부터 정확한 유전자 삽입에 이르기까지 ACE2(SARS-CoV-2의 수용체) 유전자 편집 마우스가 지속적으로 개발되고 있다. 시간이 지날수록 다양한 유전자 변형 마우스가 등장한다는 것은 COVID-19 사태에 맞서는 데 있어서 반가운 소식이다.
지난 6월, Zhao Jin-cun 교수진이 아데노바이러스 벡터 SARS-CoV-2 마우스 모델을 연구 개발하였다. 실험 검증을 통하여 이 모델이 유효한 중화 항체를 생산할 수 있다는 것을 발견했으며 백신과 약물 평가에 중요한 의의를 가지고 있다. 이와 함께 워싱턴대 의학부도 AdV-hACE2 모델을 이용해 고효율 중화 항체를 만드는 등 7월까지 백신 연구가 잇따라 보도되었고, 미국 Moderna 회사가 개발한 mRNA-1273 및 독일 BioNTech 등이 개발한 나노입자 mRNA 백신은 효율적인 진전이 이루어져 피험자에게 면역 응답을 발생시키고 중화 항체를 생성시켰다. 중국 Chen Wei 연구진과 옥스퍼드대학교가 연합하여 제작한 아데노바이러스 벡터 백신인 ChAdOx1 nCoV-19도 유망한 결과를 낳았다.
이런 연구들은 우리에게 실험 동물의 광범위한 활용을 더욱 기대하게 한다. 과학기술의 발전에 따라 전세계 의료 건강 수준이 새로운 단계로 진입하게 되고, 사람들의 생명의 본질에 대한 이해는 더욱 투철해질 것이다.
동화는 아름답고 우리의 미래도 밝다.
참고문헌:
1. Nigel J. Temperton, Paul K. Chan, Graham Simmons et al. Longitudinally Profiling Neutralizing Antibody Response to SARS Coronavirus with Pseudotypes. Emerging infectious Disease. 2005.
2. Bisht H, Roberts A, Vogel L, et al. Severe acute respiratory syndrome coronavirus spike protein expressed by attenuated vaccinia virus protectively immunizes mice. Proc Natl Acad Sci U S A. 2004.
3. Yang ZY, Kong WP, Huang Y, et al. A DNA vaccine induces SARS coronavirus neutralization and protective immunity in mice. Nature. 2004.
4. Xiuyuan Ou, Yan Liu, Xiaobo Lei, et al. Characterization of spike glycoprotein of
SARS-CoV-2 on virus entry and its immune cross-reactivity with SARS-CoV. Nature communication. 2020.
5. Yunlong Cao, Bin Su, Xianghua Guo,et al. Potent Neutralizing Antibodies against SARS-CoV-2 Identifified by High-Throughput Single-Cell Sequencing of Convalescent Patients’ B Cells. Cell. 2020.
6. Zhe Lv, Yong-Qiang Deng, Qing Ye, et al. Structural basis for neutralization of SARS-CoV-2 and SARS-CoV by a potent therapeutic antibody. Science.2020.
7. Feng-Cai Zhu, Xu-Hua Guan, Yu-Hua Li, et al. Immunogenicity and safety of a recombinant adenovirus type-5-vectored COVID-19 vaccine in healthy adults aged 18 years or older: a randomised, double-blind, placebo controlled, phase 2 trial. The Lancet. 2020.
8. L.A. Jackson, E.J. Anderson, N.G. Rouphael, et al. An mRNA Vaccine against SARS-CoV-2 — Preliminary Report. The new england journal of medicine. 2020.
9. Ugur Sahin, Alexander Muik, Evelyna Derhovanessian,et al. Concurrent human antibody and TH1 type T-cell responses elicited by a COVID-19 RNA vaccine. medRxiv preprint doi: https://doi.org/10.1101/2020.07.17.20140533.
10. Nelson Lee, P.K.S Chan, Margaret Ip, et al. Anti-SARS-CoV IgG response in relation to disease severity of severe acute respiratory syndrome. J. Clin. Virol. 2006.
11. David J DiLillo, Peter Palese, Patrick C Wilson et al. Broadly neutralizing anti-influenza antibodies require Fc receptor engagement for in vivo protection. J. Clin. Invest. 2016.
12. Akiko Iwasaki and Yexin Yang. The potential danger of suboptimal antibody responses in COVID-19. nature Reviews|Immunology. 2020.
13. Jing Sun, Zhen Zhuang, Jian Zheng et al. Generation of a Broadly Useful Model for COVID-19 Pathogenesis Vaccination, and Treatment. Cell. 2020
14. Ahmed O. Hassan, James Brett Case, Emma S. Winkler et al. A SARS-CoV-2 infection model in mice demonstrates protection by neutralizing antibodies. Cell. 2020
15. Shi-Hui Sun, Qi Chen, Hong-Jing Gu et al. A mouse Model of SARS-CoV-2 infection and Pathogenesis. Cell host & microbe. 2020.




영업일 기준 1-2일 내에 답변해 드리겠습니다.