

현재 알츠하이머병(AD) 연구에 사용되는 동물 모델은 주로 유전자 편집 마우스이고, 풍성한 성과를 거뒀지만 이에 따른 약물 시험은 거의 실패했으며, 특히 Aβ 가설을 핵심으로 한 약물 개발은 모두 실패했다고 할 수 있다. 이러한 상황에서 우리는 생각을 조금 조정하고 다른 시각으로 AD 약물 개발을 검토하기 위해 또 다른 모델을 선택하여 연구를 진행하는 것이 어떨까? 그러므로 우리는 랫드 모델에 눈길을 돌렸으며 이유는 주로 다음과 같다.
1. 랫드는 전체적으로 마우스보다 더 똑똑하고 훈련하기 쉬우므로 복잡한 실험을 진행하는 데 사용된다. 이러한 복잡한 실험은 유전자의 변화나 약물에 더 민감하다.
2. 랫드는 마우스보다 사람을 두려워하지 않고, 불안과 우울증 현상을 잘 나타내지 않으며 신경생물학적 행동학 실험에 더 적합하다.
3. 랫드의 모든 조직과 기관은 마우스보다 크며 수술을 수행하는 것이 더 쉽다.
4. MAPT와 같은 AD 관련 유전자는 랫드에서의 다형성은 인간에 더 가깝다.
5. 랫드의 유전자 조작은 날로 간단해진다.
따라서 랫드를 AD의 실험 동물로 선택하면 마우스 실험에서 얻을 수 없는 정보를 얻을 가능성이 높으므로 일부 학자들은 AD 연구를 위한 실험 동물을 랫드로 바꿨다.
AD 연구가 수년에 걸쳐 진행되면서 AD는 두 가지 주요한 특징이 있다는 것을 알게 되었다. 즉, 환자의 뇌에서 Aβ(Amyloid Beta)의 응집에 의해 형성된 아밀로이드 침전물 및 tau 단백질의 응집에 의해 형성된 신경섬유매듭(Neurofibrillary Tangle)이 많이 존재한다는 것이며, 이 중 Aβ는 non-amyloidogenic pathway(α-pathway) 및 amyloidogenic pathway(β-pathway)에 의한 APP의 절단에 의해 연속적으로 생성된다. α-secretase에 의한 APP의 절단은 독성 Aβ를 방출하지 않는 "양호" 절단 방식으로 설명할 수 있는 반면, β-pathway가 지나치게 활성화되면 Aβ 과부하를 유발하여 아밀로이드 침전이 형성된다. non-amyloidogenic pathway(α-pathway)인 경우, APP는 먼저 α-secretase에 의해 절단된 다음에 APP가 분리되어 N 말단의 APPSα(sAPPα라고도 쓸 수 있음)와 C 말단의 α-CTF가 생성된다. 따라서, sAPPα 및 α-CTF의 생성은 α-pathway의 절단 효과의 기준으로 간주될 수 있다.
amyloidogenic pathway(β-pathway)인 경우, APP는 Aβ 서열의 N말단에서 β-secretase에 의해 절단되어 APPSβ(sAPPβ라고도 쓸 수 있음)와 C 말단의 β-CTF로 분리되었다. 또한 Swe 돌연변이는 APP의 β-cutting이 더 쉽게 일어나게 하며 더 높은 수준의 sAPPβ와 β-CTF를 생성한다. β-CTF가 γ-secretase에 의해 절단된 다음에, Aβ의 축적을 통해 뇌에서 신경반(neuritic plaque)이 형성되는데, 이는 β-secretase의 역할로 인해 가능해졌다.
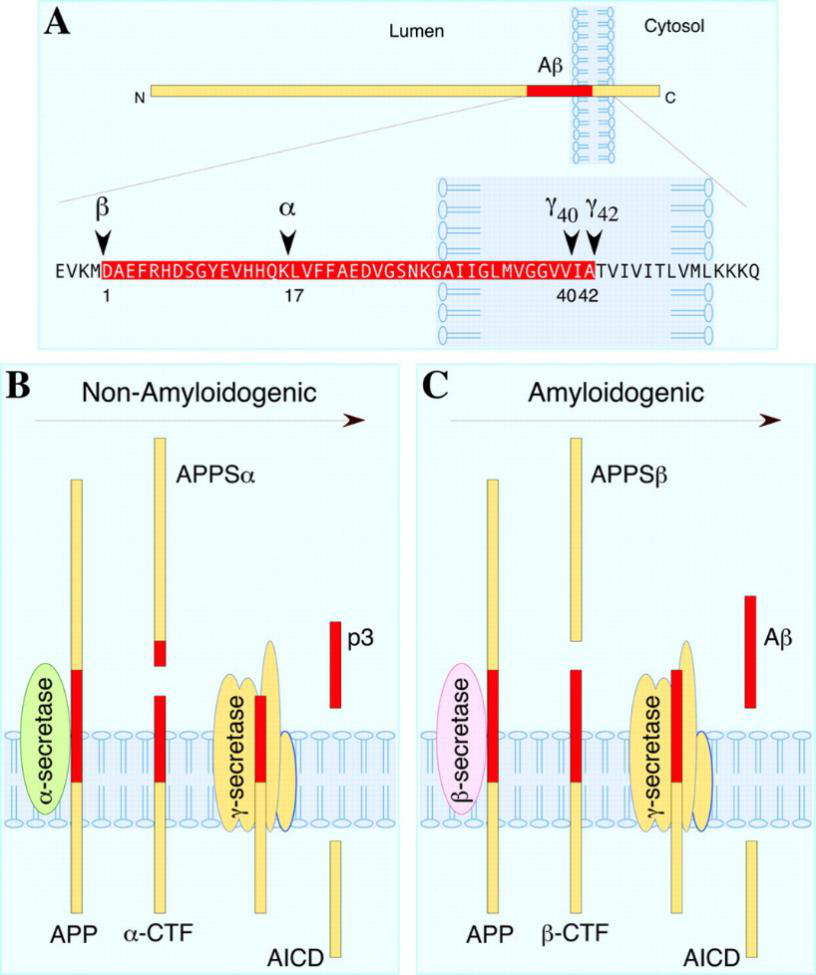
그림1. APP의 절단 과정
그런데, β-secretase와 α-secretase의 절단 위치가 고정되어 있는 반면 γ-secretase는 α-CTF 또는 β-CTF의 절단에 대해 불규칙하다. 따라서 Aβ는 고정된 크기의 조각이 아닌 짧은 펩타이드(36~43개의 아미노산)를 의미한다. 일반적으로 Aβ가 길수록 응집하기 쉽고 독성이 더 크다.
인간 및 일부 영장류의 Aβ 조각만 응집되기 쉽기 때문에 Aβ 조각이 인간화되지 않으면, 설치류에 아무리 돌연변이를 많이 도입되더라도 Aβ 응집체를 생성하기가 어려우며 모델 제작 효과에 영향을 미친다. 그러므로 rat 모델 제작하려면 Aβ 조각의 인간화가 필요하고, 그 다음에 Aβ 인간화된rat를 돌연변이시킨다. 다음으로 세 가지 Aβ 인간화 돌연변이 rat를 소개한다.
Luciano D’Adamio 실험실에서는 세 가지 AD 유전자 편집 rat를 발표했으며, 이 세 가지 rat는 모두 Knock-In(KI) 방법으로 제작된다. 어떤 사람들은 전통적인 유전자 변형 방법(Transgenic, Tg) 대신 KI가 사용되는 이유를 물을 수도 있는데, 이는 유전자 변형 방법(Transgenic, Tg)을 사용한 이전 연구에서 AD 치료제(Aβ 가설에 근거함)가 생산되지 않았기 때문이다. 한편에 KI가 Tg와 비교하면 다음과 같은 세 가지 장점이 있다.
1. KI는 유전자를랜덤으로 삽입하는 Tg와 달리 정해진 site에 삽입하기 때문에 rat 자체의 유전자에 미치는 영향을 최소화 하였다.
2. 다중 copy가 없으며, 인간 질병의 병리학적 특징에 더 가깝다.
3. rat의기존 조절 요소가 여전히 역할을 수행할 수 있도록 대부분의 rat 유전자의 기존 서열을 유지한다.
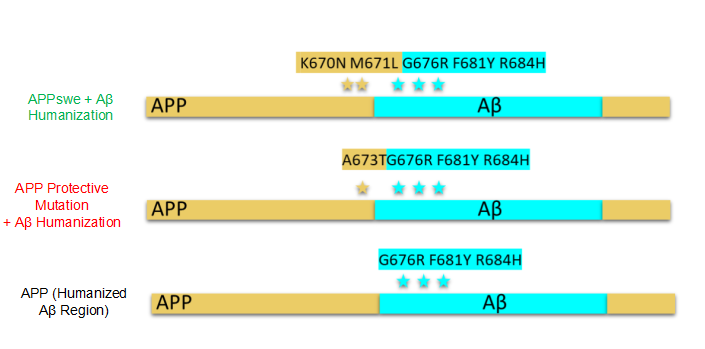
그림2: 세 가지 APP 유전자 편집 rat
저자는 인간화된 Aβ rat에서 두 가지 돌연변이를 만들었다. 하나는 일반적인 Swe 돌연변이(즉 K670N/M671L 돌연변이)이며, 이는 가족성 AD로 이어져 환자의 인지 장애를 유발한다. 다른 하나는 A673T 돌연변이인데, 이는 AD에 의해 야기된 인지 장애에 대한 일정적인 보호 효과를 갖는다.
또한, Luciano D’Adamio 실험실은 인간화된 Aβ 서열을 갖는 Psen1 L435F mutation knock-in (KI) rat(Psen1LF rat)를 제작하였다.

그림3: PSEN1의 L435F 돌연변이 부위
a. AβHumanized & A673T Mutant (Appp) Rats
먼저 아래 그림에서 나온 다양한 rat의 이름에 대해 설명하자면 다음과 같다.
w/w: wild type rat
δ7/δ7: APP with 7 base fragments deleted
s/s : Swe APP mutation (Apps) rat
p/p : A673T mutation (Appp) rat
h/h: humanized Aβ Apph rat
21일째 되던 날, 세 가지 humanized rat의 APP 발현은 변하지 않았다.
그러나 p/p의 sAPPα 수준은 h/h보다 현저히 높은 반면 sAPPβ 수준은 h/h보다 낮다는 것은 rat의 A673T 돌연변이가 β-secretase의 절단을 억제한다는 것을 의미한다. 동시에 β-CTF도 그만큼 줄어든다. 이는 rat의 생후 21일째에 A673T 돌연변이가 APP의 절단 차원에서 특정한 보호 효과를 가짐, 즉 β-secretase가 APP를 절단하는 것을 억제함을 나타낸다.
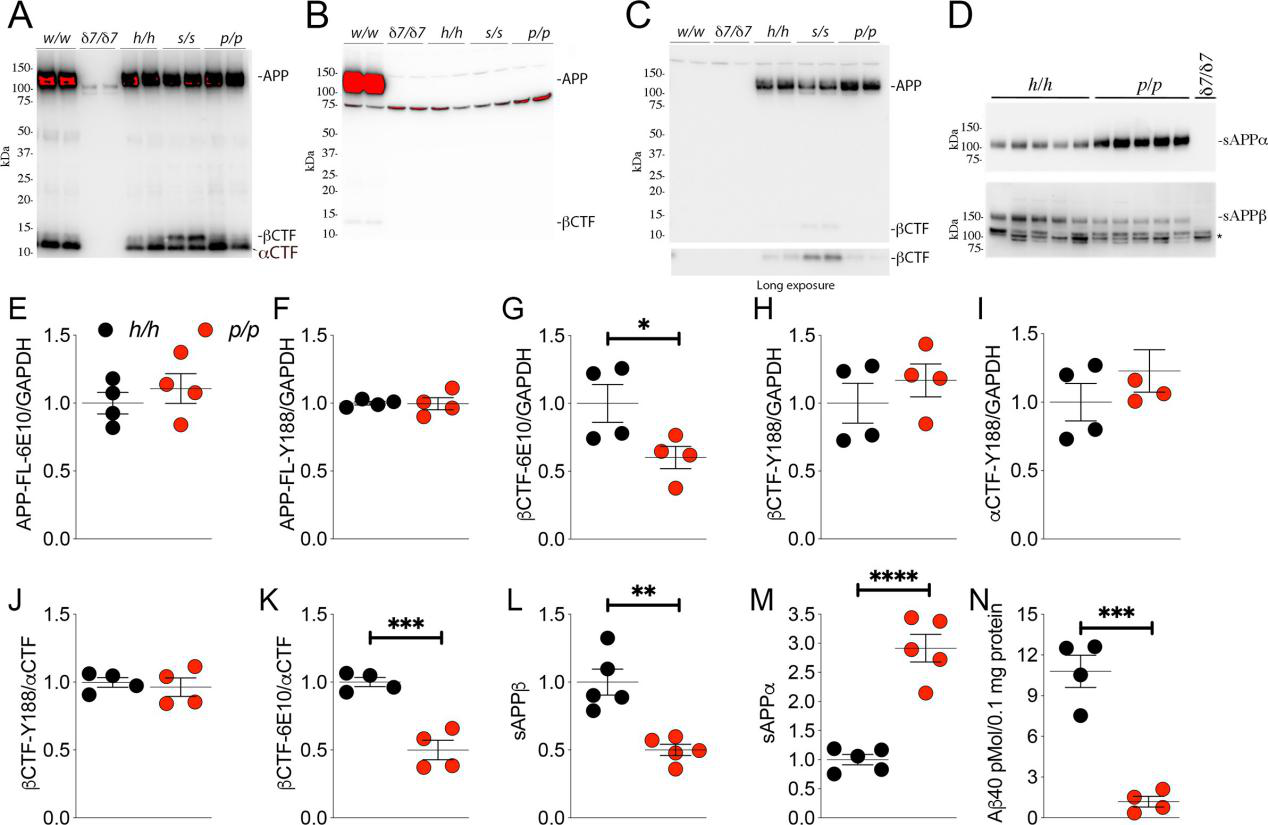
그림4: A673T 돌연변이는 β-secretase의 절단을 억제함【2】
β-secretase의 기능을 억제하는 것 외에, 이론적으로 β-CTF의 감소로 인해 Aβ의 발현도 억제되어야 하는데, 예상대로 생후 28일째에 rat의 각종 Aβ가 현저하게 감소 되었다. 여기서 주목해야 할 것은 이 연구가 또한 rat에 성별 구분하였으며 거의 비슷한 결과가 나온다는 것이다. Western Blot (WB)에 의한 COOH-terminal fragment (CTF)의 검출 결과도 N말단 산물과 유사하며,이는 A673T 돌연변이가 Aβ의 생성을 억제할 수 있음을 보여준다.
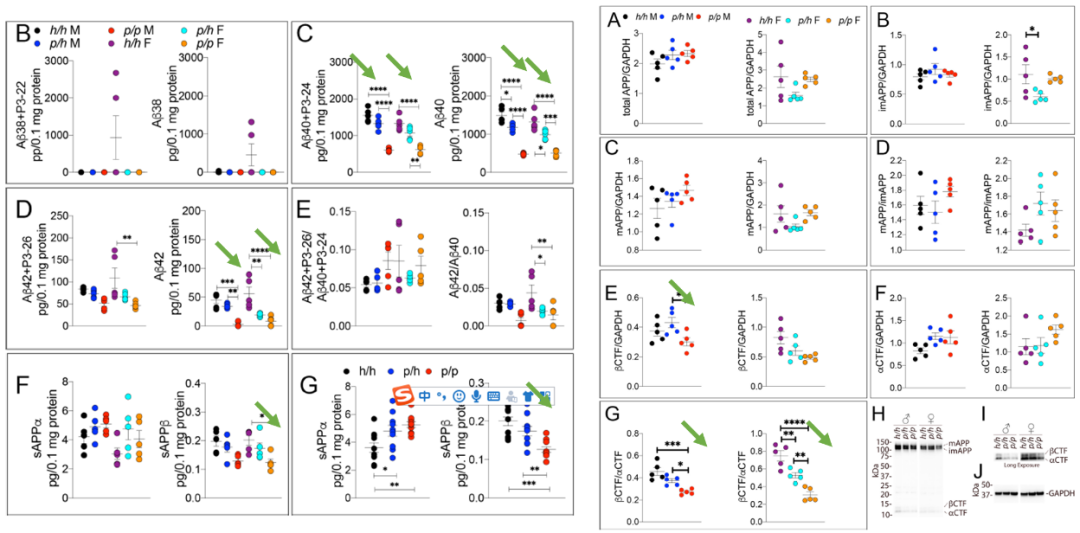
그림5: A673T 돌연변이는 Aβ 생성을 억제【2】
b. Aβ Humanized & K670N/M671L (Swedish) Mutant (Apps)Rats
반면에, K670N/M671L mutant (Apps) rat인 경우, 뚜렷한 β-secretase 절단 및 Aβ 발현이 크게 증가하며, 동시에 β-secretase 절단의 증가로 인해 성숙한 APP의 함량도 낮아진다. 따라서 이 rat 모델은 APP 절단에 있어 AD를 효과적으로 시뮬레이션할 수 있다.
요약하자면, 보호적인 A673T 돌연변이는 β-secretase 절단을 감소시키는 반면, K670N/M671L 돌연변이는 β-secretase 절단을 증가시킨다. 전자는 최종적으로 Aβ를 감소시키고 후자는 Aβ를 증가시킨다.
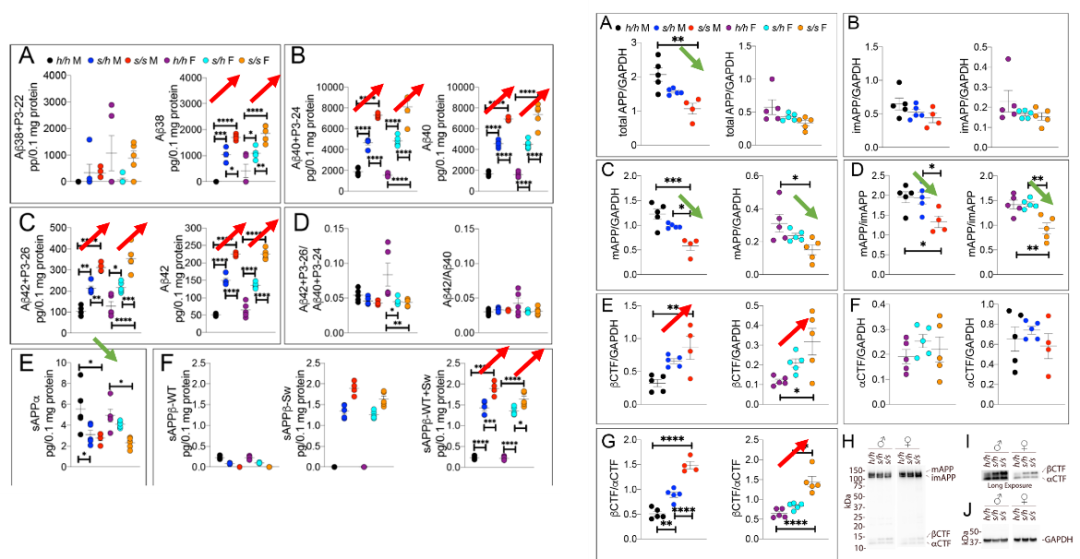
그림6: K670N/M671L 돌연변이에 의한 Aβ 증가【2】
c. Aβ Humanized & PSEN1Mutant (Psen1LF/LF) rats
아래 그림에서 γ-secretase는 4가지 단백질로 구성되어 있는데, 그 중 가장 중요한 구성 요소는 바로 presenilin 1 (PS1)이다. Luciano D’Adamio 실험실은 homozygous L435F 돌연변이를 가진 Psen1 knock-in (KI) rat(Psen1LF/LF)를 개발했다.
이 rat는 L435F 돌연변이를 발현할 수 있는 반면에, 마우스가 PS1에서 이러한 동형 접합 돌연변이를 가지고 있다면 치명적이며 후속 실험을 수행할 수 없다. Psen1LF/LF rat는 생후 27일째에 체중 감소 및 1개월령 때 40%의 사망률을 보이지만, 한 달을 버텨낸 rat는 2개월까지 생존하는 데 기본적으로 문제가 없으므로, Psen1LF/LF rat로 실험을 수행할 수 있다.
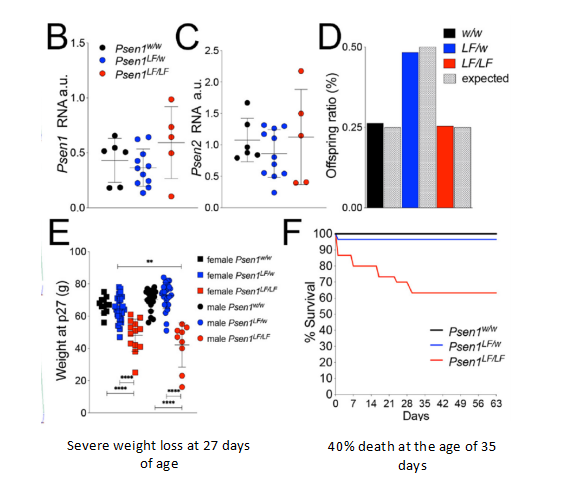
그림7: Homozygous PSEN1 돌연변이는 rat의 체중과 생존율을 감소시킴【1】
rat는 생후 4일이 되면 Aβ38, Aβ40 및 Aβ42의 감소를 초래한 반면에 Aβ43의 증가를 가져온다. 동시에, 고분자량 Aβ 대 저분자량 Aβ의 비율도 돌연변이의 영향에 따라 커질 수 있기 때문에, 이는 PS1-L435F KI가 γ-secretase의 전체 절단 능력을 낮추지만 Aβ43에 대한 절단을 높인다는 것을 보여준다. Aβ의 독성은 Aβ의 abundance뿐만 아니라 다른 Aβ 사이의 비율과도 관련이 있기 때문에 이 결론이 Aβ의 독성에 어떤 영향을 미치는지에 대해서는 더 연구 할 필요가 있다. 또한, 실험에 사용된 rat는 출생한 지 4일밖에 안되기 때문에 γ-secretase의 기능이 연령에 따라 변할지는 아직 미지수다.
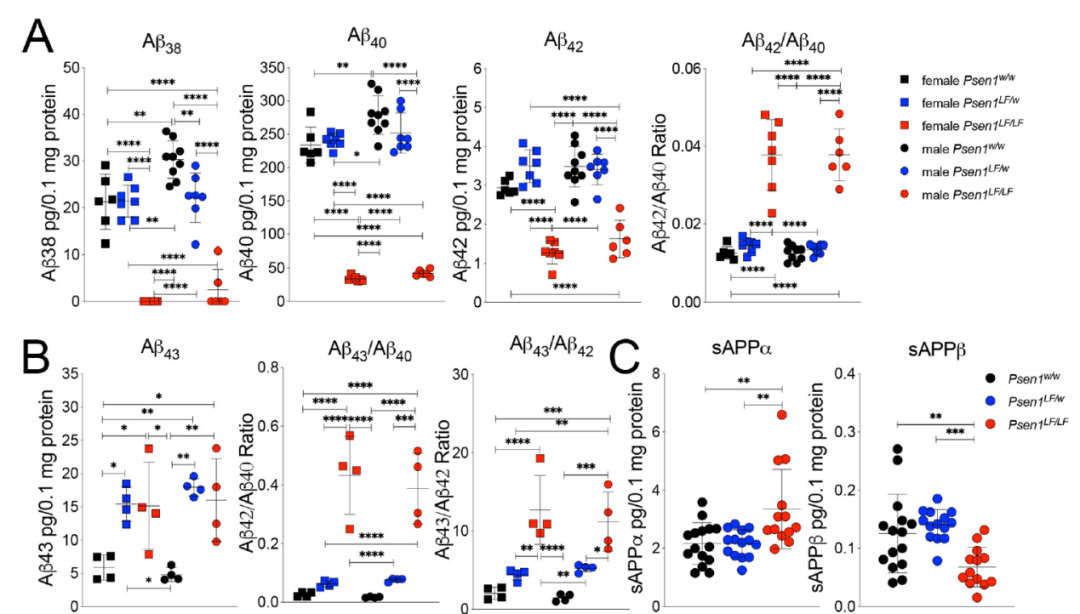
그림8: PS1-L435F 돌연변이에 의한 Aβ43 증가【1】
전체적으로 말하자면 AD 병리학적 특징을 가진 KI rat 모델을 이미 존재하고, rat에서의 유전자 편집 기술의 적용이 성숙해짐에 따라 더 많은 인간 돌연변이를 rat에 도입함으로써 인간 AD의 병리학적 표현형을 시뮬레이션할 수 있게 되었다. 현재, AD rat 모델의 수량은 상대적으로 적지만, AD 연구와 신경 생물학적 연구에서 rat의 장점을 무시할 수 없다.
다만 앞서 언급한 AD rat는 병리학 실험을 수행할 때 나이가 너무 어리기 때문에(최대 실험 연령 28일, 최소 4일) 분자적 차원의 대부분의 변화가 발생하는 데 시간이 많이 걸릴 수 있다는 점이 아쉽다. 또한, 신경생물학에서 가장 중요한 행동 표현형도 특정 연령 이후에 테스트해야 한다는 점이 rat 모델 우열의 관건이기 때문에 rat 모델에서의 후속 행동 연구가 좋은 결과를 얻을 수 있을 것으로 기대된다.
rat는 mouse보다 똑똑하기 때문에 행동 실험에서 분해능이 더욱 향상되어 기존의 분자 및 병리학적 차원의 변화가 더 쉽게 행동으로 반영된다.
또한, 서로 다른 유전자 편집 rat 모델이 제작된 경우, 이 rat들을 outbreeding 시키면 Tg 마우스와 같은 다중 유전자 편집 rat를 얻을 수 있어 더 뚜렷한 병리학적 표현형을 얻는 데 도움이 된다. 따라서, rat 모델의 확립, 개발 및 최적화는 AD 연구, 특히 약물 개발 연구를 위한 강력한 무기를 제공할 것으로 보인다.
Reference:




영업일 기준 1-2일 내에 답변해 드리겠습니다.