

2017년 유전성 망막 영양실조 치료에 처음 사용된 유전자 치료법 럭스터나는 FDA 승인을 받아 표적 RPE65 쌍등위 유전자 돌연변이에 의한 유전성 망막질환(Inherited Retinal Diseases, IRDs)을 얻었다. 이후 더 많은 유전자 요법이 임상에 들어가 안과 유전성 질환 치료의 새 시대를 열었다.
안과 질환의 유전자 치료는 그 나름의 장점이 있다. 하나는 안전성이며, 안구는 독립적으로 폐쇄된 구체로서 전신성 약물이나 중추 계통의 약에 비해 그 국소 주사성과 교체성은 안전성을 보장한다. 둘째, 안과용 복용량이 적고, 원가가 낮으며, 산업화에 유리하며, 안전성도 더욱 높아진다. 유리한 요인 외에도 안과 유전자 치료제의 기초 연구와 임상 전환은 운영이 복잡하고, 모델 제작 주기가 길고, 장비 비용이 많이 드는 등 여러 가지 어려움에 직면해 있다.
Cyagen 안과 질환 마우스 모델은 발병 메커니즘 연구 도움
안정적이고 믿을 수 있는 안과질환의 동물 모델 건립과 공급은 안과질환의 발병 메커니즘 연구, 약물 과녁 연구, 치료 효과 평가 등에 대해 예측할 수 없는 잠재력을 가지고 있다. LCA2형, LCA10형, 색소성망막염, 망막변성, 망막황반 퇴화, 각막내피 영양실조 등의 안과질환에 대해 Cyagen은 일련의 유전자 편집과 인간화 마우스 모델을 개발하였다. 또한 필요에 따라 유전자 편집 마우스 모델 (예: 유전자 녹아웃, 유전자 녹인, 점 돌연변이, 인간화 마우스 모델 및 Rat&mouse 수술 질병 모델) 을 사용자 정의하거나 공동 개발할 수 있다. 또한 눈 주사 투여, 취재, 검측 분석 등 일련의 임상 전 표준화된 연구 서비스를 제공하여 안과 유전자 치료 연구 과정에서의 여러 가지 문제를 해결해 드립니다.
|
질병 이름 |
표적 유전자 |
표적 유형 |
|
황반변성 |
VEGFA |
KI, TG |
|
망막변성 |
ABCA4 (ABCR) |
KO, Humanization |
|
망막변성 |
Tub |
KO |
|
느린 진행형 망막변성 |
Rds (Prph2) |
KO |
|
레버르 선천성 흑암시 2형 |
Rpe65 |
KO, MU |
|
레버르 선천성 흑암시 4형 |
Aipl1 |
KO |
|
레버르 선천성 흑암시 10형 |
CEP290 |
Humanization |
|
레버르 선천성 흑암시 13형 |
Rdh12 |
KO |
|
망막색소변성 |
RHO |
KO, CKO, Humanization, Humanization (Mu) |
|
망막색소변성 |
Mertk |
KO, CKO |
|
망막색소변성 |
Rpgr |
KO |
|
망막색소변성 |
Crb1 |
KO |
|
망막색소변성 |
Rd1(Pde6b) |
KO, Mu |
|
망막색소변성 |
Rd10(Pde6b) |
Mu |
|
망막색소변성 |
RP2 |
KO, CKO |
|
전색맹 |
Cnga3 |
CKO |
|
각막내피 영양실조 |
TCF4 |
CKO, Humanization |
|
선천적 무홍채증 |
Pax6 |
CKO |
|
진행성맥락막위축 |
Chm |
CKO |
|
Usher증후군 |
USH2A |
Humanization |
|
Usher증후군 |
Myo7a |
CKO |
|
vitelliform macular degeneration |
Best1 |
KO |
|
X-linked retinoschisis |
Rs1 |
KO, CKO |
|
망막색소변성 |
Tyr |
CKO |
|
눈꺼풀 백화병 3형 |
RP2 |
KO, CKO |
|
Wolfran증후군 |
RP2 |
KO, CKO |
|
탄력섬유성위황색종 |
Abcc6 |
KO, CKO |
신생혈관성 황반변성(AMD) 마우스 모델
모델 사례: 인간화 VEGF 과표현 유전자변형 마우스(TG)
황반변성은 주로 망막색소상피세포(RPE세포)의 손상과 망막 퇴행성 변화로 인한 비가역적 시력저하 또는 상실 질환이다. 신생혈관성 AMD는 맥락막 신생혈관(CNV)을 특징으로 하며 맥락막에서 시작하여 망막 아래까지 누적되는 신생혈관이 증식하며 삼출, 망막내와 망막하출혈, 망막색소상피이탈, 경성삼출물 또는 망막하섬유반흔을 동반한다.
혈관내피성장인자(VEGF)는 혈관생성과 CNV 형성의 주요 매개체로 VEGF의 과도한 발현은 신생혈관성 AMD의 주요 원인 중 하나입니다. 이에 따라 Cyagen은 C57BL/6J 마우스의 체내에 간상 세포(rod cell) 특이성 프로모터가 인간화 VEGFA 유전자 CDS 서열 표현을 구동하는 모델을 만들어 망막 특이성에서 인간화 VEGFA 유전자를 과표현할 수 있는 유전자 변형 마우스를 확보했다.
현재 항혈관내피성장인자약은 신생혈관성 AMD 의 CNV 진척을 막고 이런 비정상적인 신생혈관누출을 줄이는 주요 치료법이다. Cyagen 신생혈관성 AMD 질환에 대해 구축한 이 인간화 VEGF 과표현 마우스 모델은 자연발생적으로 발병할 수 있으며 완전한 안구구조를 유지한 채 뚜렷한 병변을 가지고 있어 신생혈관성 AMD 질환의 약물평가 및 관련 연구에 활용될 수 있다.
모델 구축 정책:
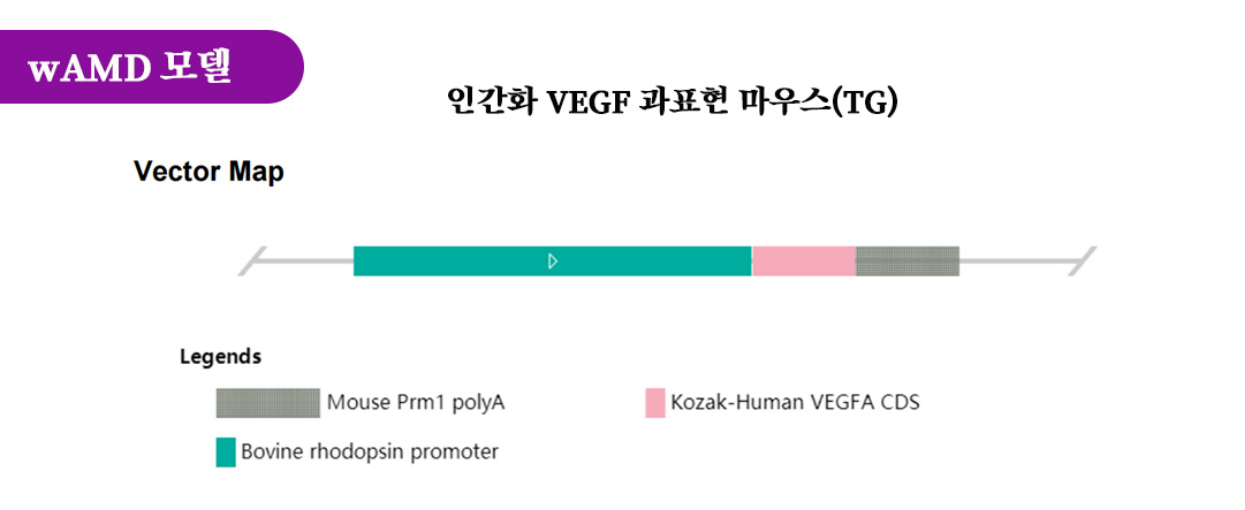
그림 1. hVEGF 과표현 마우스(TG) 구축 전략 설명도
모델 적용 영역:
★신생혈관성 안질환인 신생혈관성 AMD, 고도근시 황반맥락막 신생혈관병변, 망막정맥폐쇄 합병 황반부종, 신생혈관성 녹내장 등 질환 약물의 선별·평가에 적합한다.
★신생 혈관성 눈 질환에 적합한 메커니즘 연구.
모델 검증 데이터:
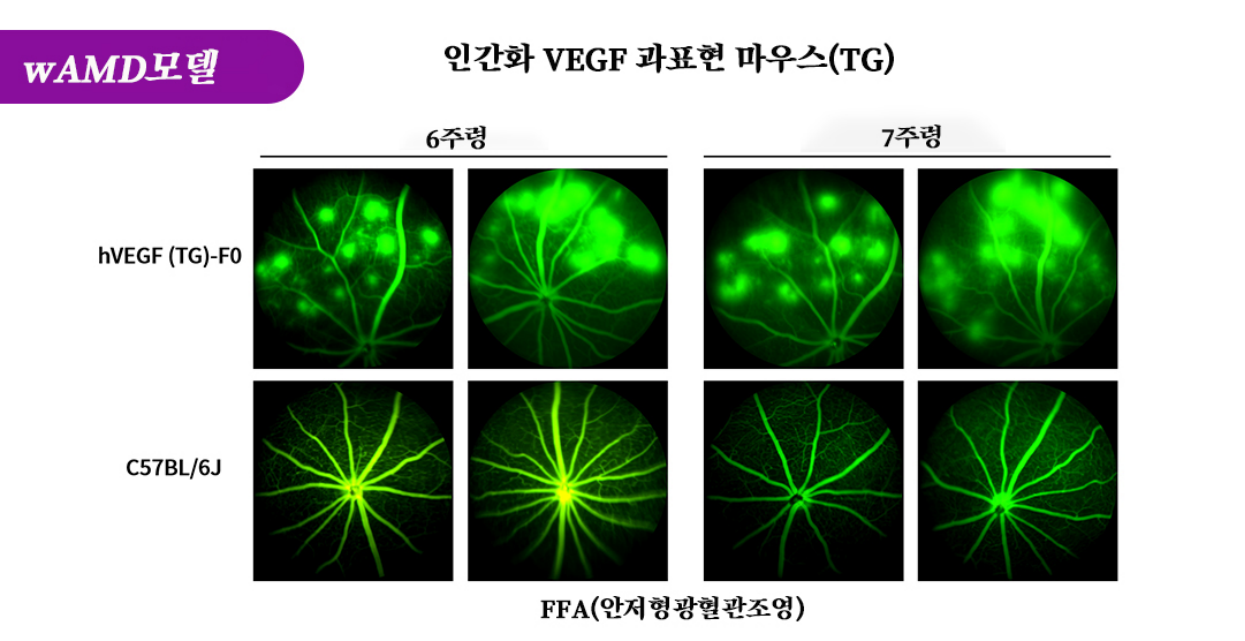
그림 2. 6주령과 7주령 hVEGF 마우스(F0세대, TG)의 FFA(안저형광혈관조영) 결과다. F0세대의 hVEGF 마우스 안구는 FFA 검측에서 뚜렷한 국소형광소 누출을 나타내며 뚜렷한 혈관병변을 나타내며 주령이 증가함에 따라 이 병변은 지속적으로 존재한다.
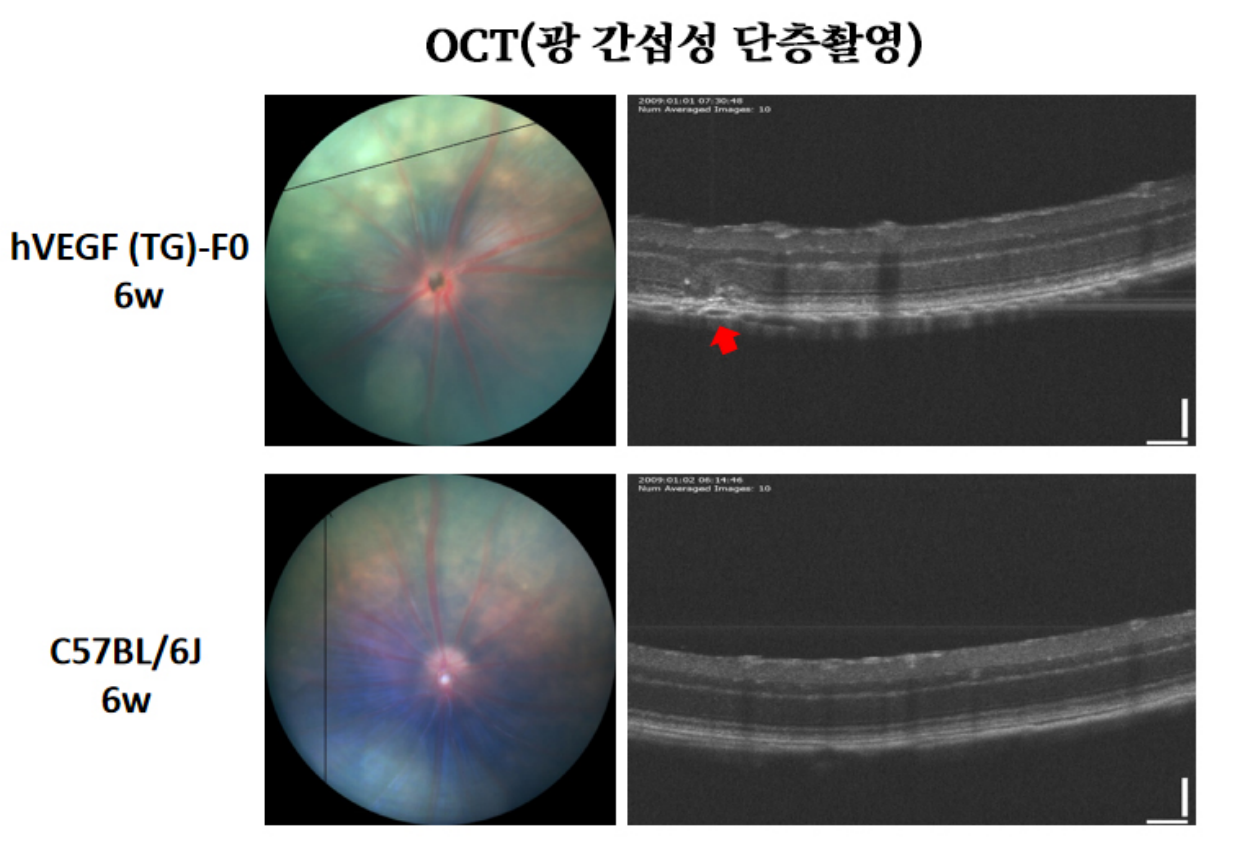
그림 3. 6 주령 hVEGF 마우스(F0세대, TG)의 OCT(광 간섭성 단층촬영) 결과. 같은 주령 C57BL/6J 마우스에 비해 F0세대의 hVEGF 마우스 안구는 OCT검측에서 망막근맥락막측 차원에 국소구조가 흐트러지는 것을 보였다.
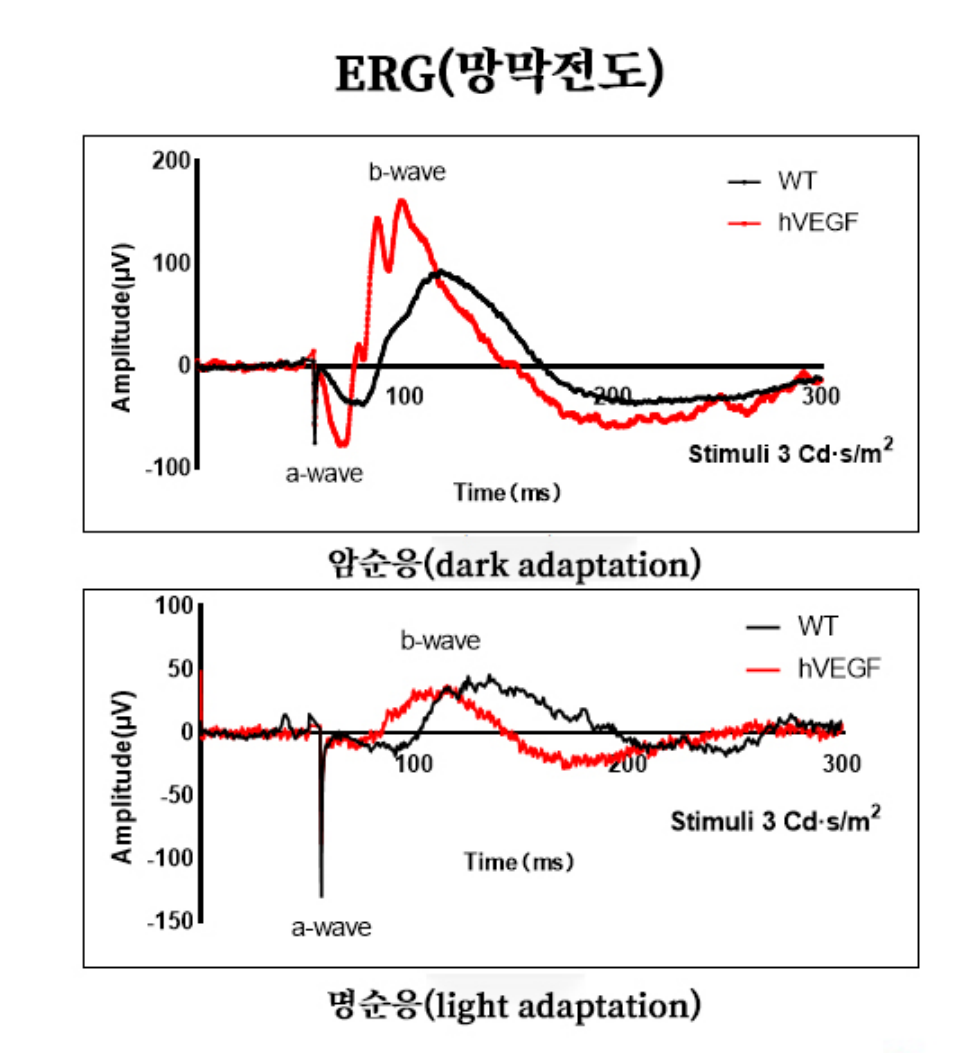
그림 4. 6 주령 hVEGF 마우스(F0세대, TG)의 ERG(망막전도) 결과. 같은 주령 C57BL/6J 마우스에 비해 F0세대의 hVEGF 마우스는 ERG 검측에서 마우스의 a파, b파에 뚜렷한 이상이 없는 것으로 나타나 현재 병변의 정도가 광수용기 세포의 감광기능에 이르지 않았음을 알려준다.
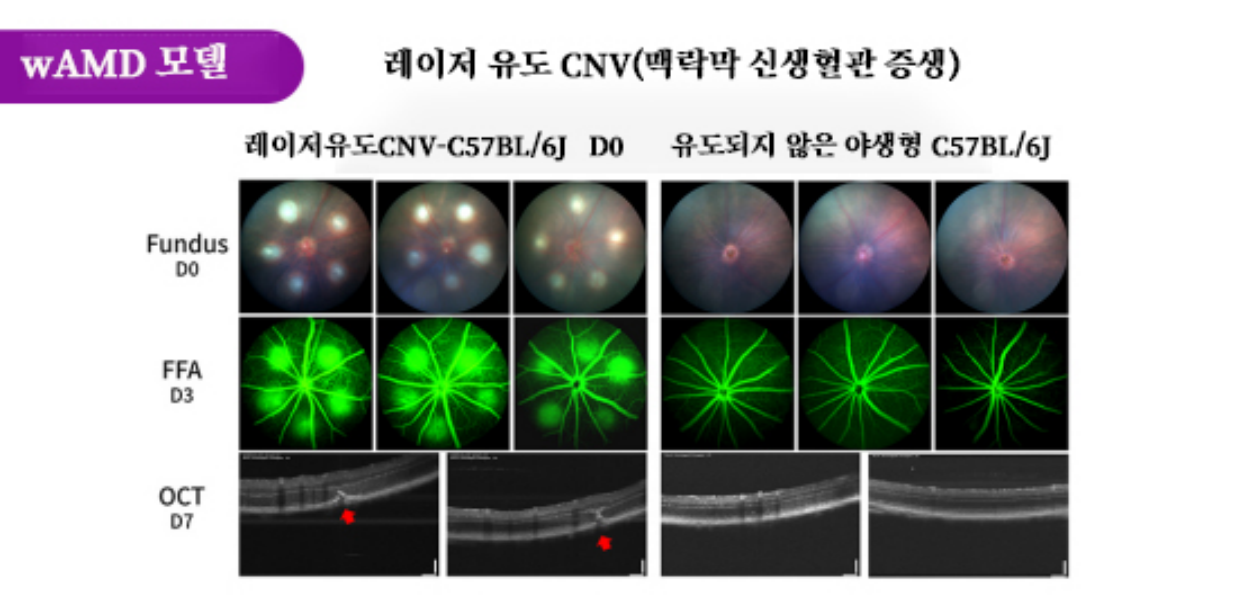
그림 5. 레이저 유도 CNV(맥락막 신생혈관 증생) 결과. RPE와 Bruch막을 통한 안저 레이저 광응고술로 표적 레이저 손상을 입히고, 이 과정은 혈관 생성을 유도해 신생 혈관성 AMD에서 관찰된 상징적인 병리를 시뮬레이션한다. 수술 후 3일간 FFA를 실시한 결과 자극 광반 부위에 현저한 형광체 누출이 나타나 윤곽이 뚜렷했다.그러나 유전자 편집 모델에 비해 유지 기간이 짧고 조작 난이도와 반복성이 높다.
Cyagen 안과 유전자 치료 솔루션
Cyagen는 안과 유전자 치료의 오랜 다방면의 어려움을 해결하기 위해 안과 유전자 치료 플랫폼을 적극적으로 배치하고, 고급 미세화 소형 동물 안과 기기 설비와 베테랑 전문 인력을 배치하였다. 동물 안과 유전자 편집 모델, 눈 주사 약, 취재, 검측 분석 등 일련의 임상 전 표준화 연구 서비스를 제공하여 안과 유전자 치료 연구의 여러 가지 문제점을 해결해 드립니다.




영업일 기준 1-2일 내에 답변해 드리겠습니다.