

앞서 당뇨병 망막병변 (DR) 연구에 대해 언급했고, 이와 관련된 몇 가지 흔한 동물질환 모델을 조사했는데, DR 이 발생한 사람들은 보통 시야에서 계속 떠 있는 반점이 나타나고 시력이 점차 흐려지고 있다. 마치 눈앞의 세계가 모자이크처럼, 시력표에서 가장 큰 E 도 잘 보이지 않는다.
당뇨 망막 병증은 대개 사람에게 점진적인 손상을 초래하며, 병변 정도에 따라 합리적인 치료 수단을 취하는 것이 특히 중요한다. DR 질환 연구 분야에서 두 가지 중요한 치료경로인 수술치료와 유전자 치료에 대해 알아본다.
현재 DR에 대한 치료는 주로 수술에 의존하고 있으며 최근 의료기술의 급속한 발전을 거쳐 레이저 광응고화 등의 치료효과도 더욱 이상적이다.
전망막 레이저 광응고화
1960년대에 제안된 전망막 레이저 광응고화(Pan retinal photocoagulation, PRP)은 증식형 DR 환자의 시력의 추가 저하를 막을 수 있다. PRP 치료의 구체적인 작용기전은 주로 레이저 광응고로 유도된 반흔(scar)이 망막 미세순환의 혈류역학을 완화시켜 망막의 산소 합성을 개선하여 혈관내피성장인자와 기타 인자의 발생을 억제하여 치료목적을 달성한다. 하지만 레이저 자체가 파괴적이기 때문에 PRP 치료에는 시야의 어두운 점 유도, 동시 유리체 출혈, 계발성 신생혈관 등 부작용이 있다.
유리체절제술
증식형 DR에 시력을 위협하는 합병증, 예를 들어 유리 부피혈이나 견인성 망막이 벗겨질 경우 주요 치료법은 섬모체(ciliary body) 평탄부 유리체 절개술을 주로 하며 PRP를 보완한다.
유리체 절제술 (Pars plana vitrectomy, PPV) 은 유리체 절제를 통해 눈내적혈을 제거해 환자의 안저 상태를 드러낸다. 한편 혈관내피성장인자(Vascular endothelial growth factor, VEGF)와 같은 사이토카인의 농도를 감소시켜 흐트러진 눈 속 미세환경을 더욱 개선시켰다. 수술 중 섬유혈관막(Fibrovascular membranes, FVM)의 박리는 견인작용을 해소하여 망막의 해부구조를 회복시킬 수 있으므로 임상증식형 DR환자의 PPV 치료의 의의가 현저한다.
하지만 신생 혈관 영역의 취약성으로 인해 수술 중 안구 내출혈은 피할 수 없는 경우가 많기 때문에 (특히 FVMs 를 벗겨낼 때) PPV 의 수술 난이도가 크게 높아졌다. 과거 임상 안저질환의 경우 의사는 주로 안압이나 전기응고를 증가시켜 수술 중 활동성 출혈을 억제하였으나, 장시간 높은 안압상태는 각막상피부종을 초래하여 수술 시야의 선명도를 떨어뜨릴 수 있다. 유리체절단헤드(Vitreous cutting head)를 이용하여 망막 다부위의 반복 출혈을 제거하거나 FVMs를 분리하면 새로운 망막 열공(retinal tear)이 생기기 때문에 증식형 DR환자는 단순 PPV 진행에 실패율이 있다.
2.유전자 치료
유전자 치료는 전통적인 의학 수단에 비해 혁신적인 연구개발 분야로서 국내외에서 한창 발전하고 있으며, 마찬가지로 DR 질환에 새로운 진료 계기를 가져왔다. 망막의 유전자 요법에 대해서는 몇 가지 연구 사례를 들어 설명한다.
Colella 등 [1]VEGF 유전자변형 마우스 모델을 사용하여 AAV 벡터를 이용하여 가용성 수용체 sFlt-1 코딩 유전자 전이를 매개하고, 이 벡터를 망막하강에 주사함으로써 치료 유전자가 투여된 눈 안에서 발현되도록 함으로써 망막내 미세혈관 이상 발생을 효과적으로 억제하였다.
VEGF의 상향 조정은 눈 속의 신생혈관 형성과 관련이 있는데, Ambati 등[2]은 미숙아망막병증(Premature infant retinopathy, ROP) 마우스를 모델로 하여 각각 아데노바이러스와 AAV 벡터를 이용하여 sFlt-1 유전자 전이를 매개한다. 그 결과 정상 마우스의 눈 부위에는 VEGF가 낮게 발현되고 sFlt-1이 높게 발현되는 동시에 sFlt-1이 VEGF의 발현을 억제하여 눈 부위 보호 작용을 하는 것으로 나타났다. 그러나 ROP 마우스의 눈에서는 VEGF 발현량이 현저하게 높아지고 sFlt-1은 억제되어 실험을 통해 세포 내 sFlt-1 유전자의 높은 발현을 매개하는 바이러스를 통해 ROP 마우스에 치료 작용을 한다.
Díaz-Lezama 등[3] 역시 AAV 담체에 의해 매개되는 혈액-망막장벽 손상 억제제를 사용하여 당뇨병성 황반부종에 대한 치료 효과를 검토하였다. STZ를 이용하여 쥐의 당뇨병을 유도하고 2주 후 안유리체에서 알부민 함량을 측정하여 출혈-망막장벽이 손상되어 알부민 함량이 현저히 증가함을 알 수 있다. 반면 당뇨병을 유도한 지 2주 만에 VEGF 항체인 AAV를 투여한 랫드(Rat)의 눈에 있는 알부민 함량은 정상으로 유지돼 이 유전자 치료법이 혈액-망막 장벽에 대한 보호를 방증했다.
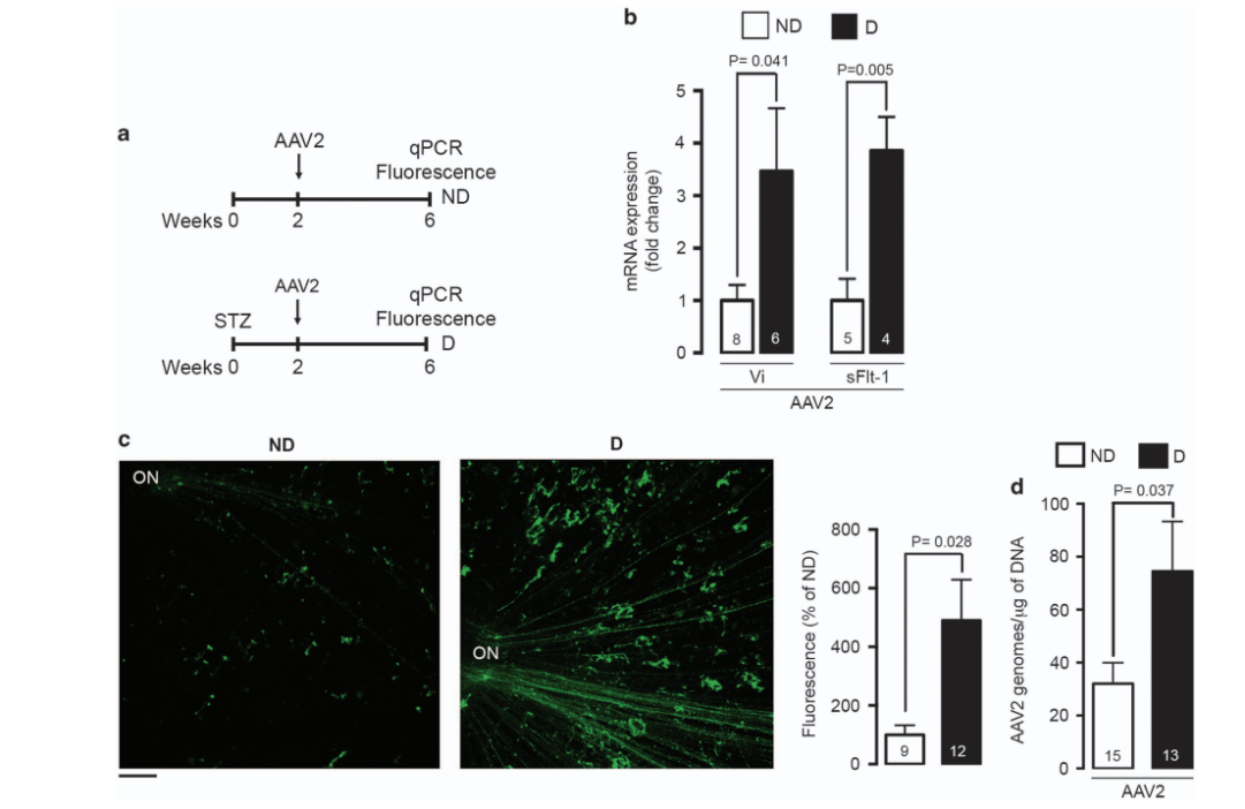
그림 1. 망막 깔개(stretched preparation)와 qPCR 을 통해 AAV2 가 목표 유전자를 성공적으로 전달할 수 있음을 증명한다 [3]
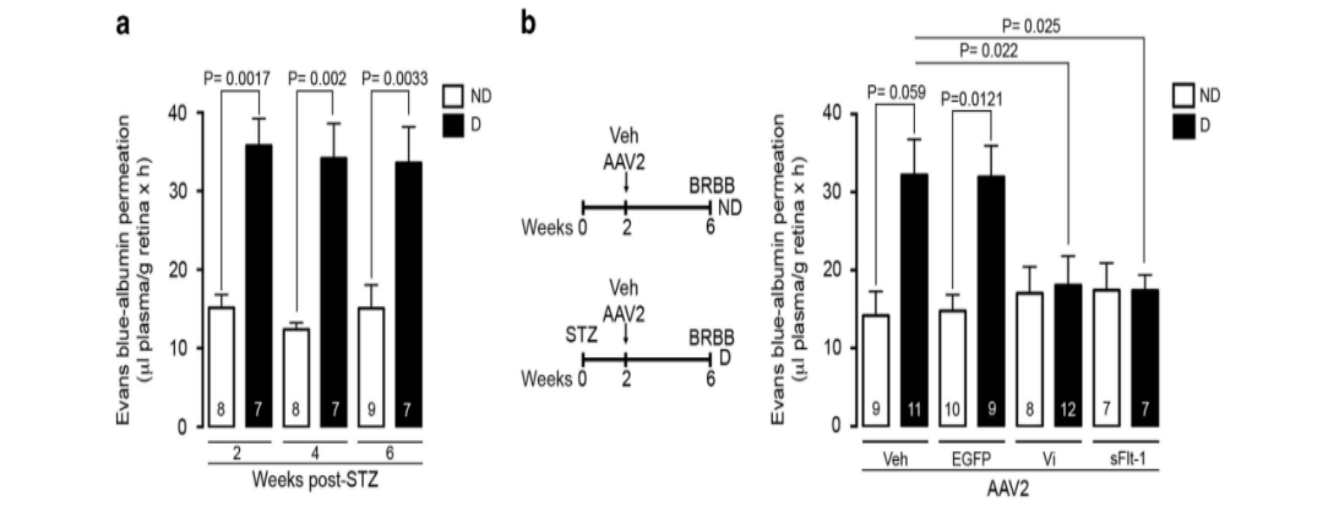
그림 2 당뇨병 Rat는 과표현 VEGF 항체 AAV를 발현하기 전후의 알부민 함량을 주사하였다[3]
참고 문헌:
【1】Colella, P., & Auricchio, A. (2010). AAV-mediated gene supply for treatment of degenerative and neovascular retinal diseases. Current gene therapy, 10(5), 371–380.
【2】Ambati, B. K., Patterson, E., Jani, P., Jenkins, C., Higgins, E., Singh, N., Suthar, T., Vira, N., Smith, K., & Caldwell, R. (2007). Soluble vascular endothelial growth factor receptor-1 contributes to the corneal antiangiogenic barrier. The British journal of ophthalmology, 91(4), 505–508.
【3】Díaz-Lezama, N., Wu, Z., Adán-Castro, E., Arnold, E., Vázquez-Membrillo, M., Arredondo-Zamarripa, D., Ledesma-Colunga, M. G., Moreno-Carranza, B., Martinez de la Escalera, G., Colosi, P., & Clapp, C. (2016). Diabetes enhances the efficacy of AAV2 vectors in the retina: therapeutic effect of AAV2 encoding vasoinhibin and soluble VEGF receptor 1. Laboratory investigation; a journal of technical methods and pathology, 96(3), 283–295.
[1] Methods & Clinical Development, 24, 210-221.
[2]Buck, T. M., & Wijnholds, J. (2020). Recombinant adeno-associated viral vectors (rAAV)-vector elements in ocular gene therapy clinical trials and transgene expression and bioactivity assays. International journal of molecular sciences, 21(12), 4197.
[3]Telias, M., Denlinger, B., Helft, Z., Thornton, C., Beckwith-Cohen, B., & Kramer, R. H. (2019). Retinoic acid induces hyperactivity, and blocking its receptor unmasks light responses and augments vision in retinal degeneration. Neuron, 102(3), 574-586.
[4]Lee, S. H., Kim, Y. S., Nah, S. K., Kim, H. J., Park, H. Y., Yang, J. Y., ... & Park, T. K. (2018). Transduction patterns of adeno-associated viral vectors in a laser-induced choroidal neovascularization mouse model. Molecular Therapy-Methods & Clinical Development, 9, 90-98.




영업일 기준 1-2일 내에 답변해 드리겠습니다.