

관련 배경
유전자 치료는 정상 유전자를 인체 세포에 도입해 유전자 결함과 이상에 따른 질병을 교정하거나 보완하는 것으로 유전병을 치료하는 근본 전략이다. 30년간의 어려운 발전으로 유전자 치료는 이미 인류의 각종 유전성 질병을 치료하는 핵심 수단이 되었다. 아데노바이러스(AAV)는 광범위한 조직에 감염될 수 있고 면역원성과 통합 능력이 낮기 때문에 안전성이 좋은 것으로 평가되며, 이에 따라 AAV는 인체유전자 치료 분야의 최전방, 잠재력, 가장 상용하는 바이러스 매개체 중 하나가 되었다. 세계보건기구(WHO)의 세계시력보고서에 따르면 전 세계적으로 최소 22억 명이 시각장애를 겪거나 실명하고, 최소 10억 명은 예방과 치료가 가능하다고 한다.
눈은 크기가 작기 때문에 적은 용량의 AAV 벡터가 있으면 강력한 전도를 할 수 있다. 혈액망막장벽의 존재로 인해 상대적으로 폐쇄적이며 면역사면 특성을 가지고 있어 국소 투여 안전성이 상대적으로 높으며 안저질환은 단일유전자질환인 경우가 많기 때문에 눈은 유전자 치료에서 매우 인기 있는 기관이 된다.
현재 안과 유전자 치료의 적응증은 주로 단일 유전자 돌연변이와 관련된 유전성 망막질환(Inherited Retinal Diseases, IRDs)으로 망막색소변성, 무맥락막증, Leber 유전성 시신경병변(LHON), 레버르 선천성 흑암시(LCA), Stargardt병, 색맹증(ACHM), X연쇄망막절개열증(XLRS)과 연령관련성 황반변성(AMD) 등이 있다. 이들 환자는 자립생활과 일상활동 능력이 크게 손상돼 의료수요가 크다. 따라서 눈가에 대한 유전자 치료 연구는 줄곧 유전자 치료 연구의 최전방에 있으며, AAV 유전자 치료의 황금 트랙으로 AAV 유전자 치료 임상 실험의 4 분의 1 을 차지하고 있다.
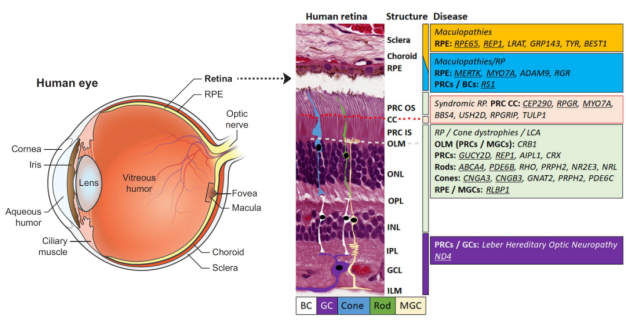
그림 1. 망막 질환을 일으키는 관련 유전자[2]
혈청형 선택과 주사방식
현재 진행 중인 안과 AAV 유전자 치료 임상시험에서는 망막색소상피(RPE), 신경절세포층, 감광세포층 등 안저에 표적화된 다양한 세포 유형이 많다. 실험에 사용된 벡터는 AAV2, 5, 8의 혈청형이 많았지만 최근 몇 년 동안 AAV2-7M8, AAV2-tYF, scAAV 등의 비교적 많은 개조 벡터를 사용하여 임상 연구에 이용되었다.
치료 목적에 따라 AAV 벡터가 매개하는 눈 유전자 전달 경로는 주로 유리체강주사, 망막하강주사, 전방주사, 결막하주사 등이 있는데, 이 중 유리체강주사와 망막하강주사가 많이 쓰인다. 다양한 동물모델에서, 연구에 따르면 AAV벡터 유리체강주사는 주로 신경절세포에 감염되며, 이러한 주사방법은 AAV 의각단백질에 대한 체액면역반응을 일으켜 눈 속의 염증을 일으킨다. 망막하주사는 주로 망막색소 상피세포와 광수용체세포에 감염되어 체액면역반응을 일으키지는 않지만, 주사로 인한 출혈손상 및 잠재적인 망막박리의 위험을 피해야 한다.
예시 전시
본문에서는 눈 부위에 자주 사용하는 주사 방법에 대해 자세히 안내해 드리니 주사 방법 선택 및 조작에 참고하시기 바랍니다.
앞방주사(Anterior chamber injection)
앞방(Anterior Chamber)은 각막과 홍채 사이의 공극으로 방수(aqueous humor )에 차 있다. 마우스의 거대한 수정체는 앞방(Anterior Chamber)으로 융기되어 있었고, 마우스의 앞방(Anterior Chamber)은 인체보다 상대적으로 훨씬 얕았다. 앞방(Anterior Chamber)에 액체나 가스를 주입해 안압을 높이는 녹내장 모델을 만드는 방법 중 하나다.구체적인 동작 단계는 다음과 같다.
▶ 실험 전 준비
마취 마우스: 마우스의 체중 측정 후 복강에서 Pentobarbital sodium1% 용액을 적당량 주사하여 사육 케이지에 넣고 약 5-10분간 마취를 기다린다. 마우스가 저리면 눈동자 표면에 눈동자확장제를 떨어뜨려 동동을 흩어지게 한다.
▶앞방 주사(Anterior chamber injection)
마이크로 주사기로 적당량의 바이러스를 흡입하여 예비하고 마취한 쥐를 조작대에 놓고 눈 부위에 염산리도카인(lidocaine hydrochloride)을 주어 국소마취를 한다. 왼손은 머리를 누르고 안구가 튀어나오게 하고 오른손은 미량의 주사기를 들고 홍채에서 1 ~ 2mm 떨어진 곳에 앞방(Anterior Chamber)을 꽂고 바늘끝이 평행으로 들어간 다음 바이러스를 빠르게 밀어 공기를 형성하여 거품이 바늘에 딱 맞도록 하고 바늘이 새는 것을 막는다. 바이러스 주사를 다 맞으면 천천히 바늘을 빼낸다.
▶동물 소생
마우스를 사육장에 다시 넣어 보온에 주의하고 소생할 때까지 기다린다.
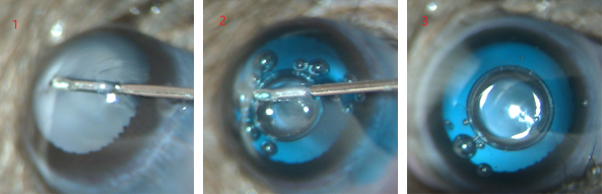
그림2. 앞방 주사(Anterior chamber injection)
유리체강주사(vitreous space)
▶실험 전 준비
마취 마우스: 마우스의 체중 측정 후 복강에서 Pentobarbital sodium1% 용액을 적당량 주사하여 사육 케이지에 넣고 약 5-10분간 마취를 기다린다. 마우스가 저리면 눈동자 표면에 눈동자확장제를 떨어뜨려 동동을 흩어지게 한다.
▶유리체강주사(vitreous space)
마이크로 주사기로 적당량의 바이러스를 흡입하여 예비하고 마취한 마우스를 조작대에 놓고 눈 부위에 염산리도카인(lidocaine hydrochloride)을 주어 국소마취를 한다. 왼손은 머리를 누르고 안구가 튀어나오게 하고 오른손에 미량 주사기를 들고 각막 뒷 가장자리 1mm 위치에서 유리체강(vitreous space) 안으로 삽입하면 바늘 끝이 수직으로 들어가면서 기울어져 천천히 바이러스를 밀어 넣는다.
▶동물 소생
마우스를 사육장에 다시 넣어 보온에 주의하고 소생할 때까지 기다린다.
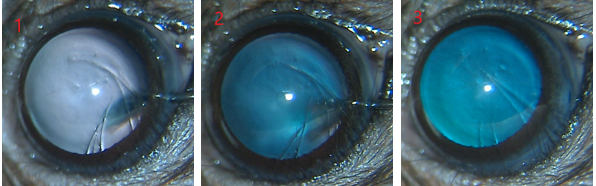
그림3. 유리체강주사(vitreous space)
망막하 주사
마우스의 후반 안구벽은 안쪽에서 바깥쪽으로 망막, 맥락막, 공막으로 나뉜다. 마우스의 망막 구조는 인체와 유사한다(그림 4). 구체적인 주사 절차는 다음과 같습니다.
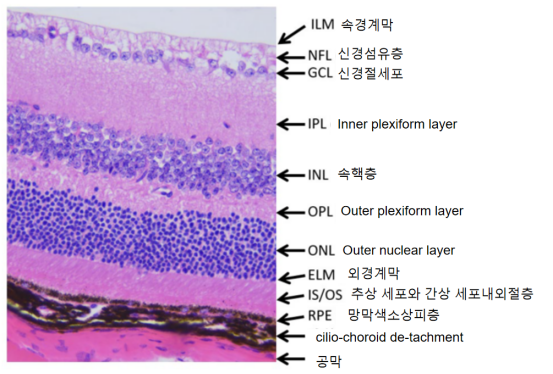
그림 4. C57BL 마우스 망막조직 HE염색도(400×)
▶ 실험 전 준비
마취 마우스: 마우스의 체중 측정 후 복강에서 Pentobarbital sodium1% 용액을 적당량 주사하여 사육 케이지에 넣고 약 5-10분간 마취를 기다린다. 마우스가 저리면 눈동자 표면에 눈동자확장제를 떨어뜨려 동동을 흩어지게 한다.
▶ 바이러스 주사
마이크로 주사기로 적당량의 바이러스를 흡입하여 예비하고 마취한 마우스를 조작대에 놓고 눈 부위에 염산리도카인(lidocaine hydrochloride)을 주어 국소마취를 한다. 왼손은 머리를 누르고 안구가 튀어나오게 하고 오른손에 미량 주사기를 가지고 각막 후연 1mm 위치에서 유리체강(vitreous space)에 삽입하고 바늘 끝이 수직으로 들어가 반대편 망막(유리체강을 통해 주사)까지 기울어져 저항이 있을 때 바늘을 멈추고 바이러스를 천천히 주입한다. 또는 주사기 바늘과 눈축이 15°각인 동물에서 각막 가장자리로부터 1~2mm 떨어진 곳에 있는 공막(sclera)에 공막을 뚫는 통로를 열어주되 RPE를 뚫지 않는다. 주사바늘이 기울어지면 주사(공막을 통해 주사)를 멈추고 바이러스를 천천히 주입한다. 바이러스 주사를 다 맞으면 천천히 바늘을 빼낸다.
▶동물 소생
마우스를 사육장에 다시 넣어 보온에 주의하고 소생할 때까지 기다린다.

결막하 주사
결막하주사는 눈의 국소 투여에 흔히 쓰이는 방법이다. 구체적인 조작 절차는 다음과 같다.
▶ 실험 전 준비
마우스를 마취하고 약 5-10분 정도 기다린 후 눈동자확장제(Mydriatic Drugs)를 떨어뜨립니다.
▶ 바이러스 주사
마이크로 주사기로 적당량의 바이러스를 흡입하여 예비하고 마취한 마우스를 조작대에 놓고 눈 부위에 염산리도카인(lidocaine hydrochloride)을 주어 국소마취를 한다. 핀셋으로 결막을 집어서 결막 안쪽을 따라 3-4mm 찌르면 결막을 통해 바늘의 움직임을 관찰하여 천천히 바이러스를 주사하고, 주사 완료 후 몇 초 동안 머물면서 바늘을 뽑다. 주사 후 볼 결막 아래에 융기가 있고 안구가 돌출되어 있다.
▶ 동물 소생
마우스를 사육장에 다시 넣어 보온에 주의하고 소생할 때까지 기다린다.
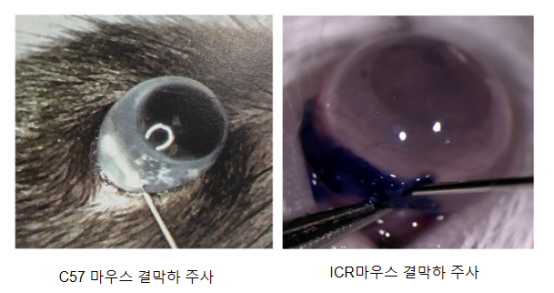
그림 6. 결막하 주사
참고 문헌:
[1]She, K., Su, J., Wang, Q., Liu, Y., Zhong, X., Jin, X., ... & Wei, Y. (2022). Delivery of nVEGFi using AAV8 for the treatment of neovascular age-related macular degeneration. Molecular Therapy-Methods & Clinical Development, 24, 210-221.
[2]Buck, T. M., & Wijnholds, J. (2020). Recombinant adeno-associated viral vectors (rAAV)-vector elements in ocular gene therapy clinical trials and transgene expression and bioactivity assays. International journal of molecular sciences, 21(12), 4197.
[3]Telias, M., Denlinger, B., Helft, Z., Thornton, C., Beckwith-Cohen, B., & Kramer, R. H. (2019). Retinoic acid induces hyperactivity, and blocking its receptor unmasks light responses and augments vision in retinal degeneration. Neuron, 102(3), 574-586.
[4]Lee, S. H., Kim, Y. S., Nah, S. K., Kim, H. J., Park, H. Y., Yang, J. Y., ... & Park, T. K. (2018). Transduction patterns of adeno-associated viral vectors in a laser-induced choroidal neovascularization mouse model. Molecular Therapy-Methods & Clinical Development, 9, 90-98.
Cyagen 안과 유전자 치료 솔루션
Cyagen은 안과 유전자 치료의 장기적 난제를 해결하기 위해 안과 유전자 치료 플랫폼을 적극 배치해 고급형 정밀 소동물 안과 기기 설비와 베테랑 전문가를 지원한다. 동물 안과 유전자 편집 모델, 눈 주사 약, 취재, 검사 분석 등 일련의 임상 전 표준화 연구 서비스를 제공하여 안과 유전자 치료 연구의 여러 가지 문제점을 해결해 드립니다.
모든 노력으로 더 많은 유전자 치료법이 임상실험에 들어가 선천적인 실명자들이 조속히 서광을 다시 볼 수 있도록 도와주기를 바랍니다. 문의사항이 있으시면 언제든지 저희에게 86 20-31601779 로 전화하시거나 service-apac@cyagen.com 으로 문의해 주시기 바랍니다.




영업일 기준 1-2일 내에 답변해 드리겠습니다.