

문장 요약 - Cyagen은 알츠하이머병 치료 연구를 위해 인간화 Tau 단백질 마우스 모델을 개발했습니다
알츠하이머병(Alzheimer’s Disease, AD) 신약 개발은 2024년에도 계속 도전에 직면하고 있으며, 최근 업계의 신약 개발 실패 사례들은 Tau 단백질을 타겟으로 하는 새로운 접근법의 필요성을 강조하고 있습니다. Cyagen에서 독자적으로 개발한 인간화 Tau 마우스 모델(예: B6-htau, B6-htau*P301L/P301S)은 알츠하이머병(AD) 기전 연구 및 치료제 테스트를 위한 적합한 모델입니다. 이러한 모델은 질환 관련 돌연변이를 포함한 인간 MAPT 유전자를 발현하여 신약 개발의 획기적인 발전을 가능하게 합니다. 또한 Cyagen은 종합적인 신경 퇴행성 질환 CRO 서비스를 제공합니다. Cyagen의 첨단 플랫폼을 통해 알츠하이머병(AD) 및 기타 중추신경계(CNS) 질환에 대한 연구를 지원할 수 있습니다.
알츠하이머병 신약 개발의 도전 과제
2024년에도 알츠하이머병(AD) 신약 개발은 여전히 높은 난이도를 보입니다. 2024년 초에 Roche(로슈)는 알츠하이머병 치료에 대한 임상 결과가 좋지 않아 두 개의 알츠하이머병(AD) 항체 약물을 AC Immune에 반환했습니다. [1] Biogen도 Aβ 단일클론항체 Aduhelm에 대한 개발과 상용화를 중단하고 Tau를 타겟으로 하는 안티센스 올리고뉴클레오티드(ASO)와 저분자 치료제로 초점을 전환했습니다. [2] 최근에는 Genentech이 UCB가 개발한 Tau 항체 약물 Bepranemab의 개발을 포기하고, Tau 단백질을 코딩하는 MAPT 유전자를 타겟으로 한 유전자 치료제를 탐색하기 위해 Sangamo Therapeutics와 협력하기로 했습니다. [3]
Eli Lilly의 Aβ 항체 치료제 Donanemab이 승인되었음에도 불구하고, 높은 제작 비용과 제한된 효능으로 인해 영국 국가 보건 서비스(NHS)에서 보험 적용이 되지 않아 상용화가 어렵게 되었습니다[4]. 또한 AbbVie와 Johnson & Johnson 같은 회사도 일부 알츠하이머병(AD) 연구 프로젝트를 중단했습니다. [5-6] 이러한 도전 과제들은 알츠하이머병(AD) 신약 개발을 위한 혁신적인 치료 접근법, 특히 트랜스페린 수용체(TFRC) 항체 접합체를 통한 혈액뇌장벽(BBB) 통과, Tau 단백질 타겟팅, 소단위 핵산(small RNA) 및 유전자 편집 치료 분야의 필요성을 강조합니다.
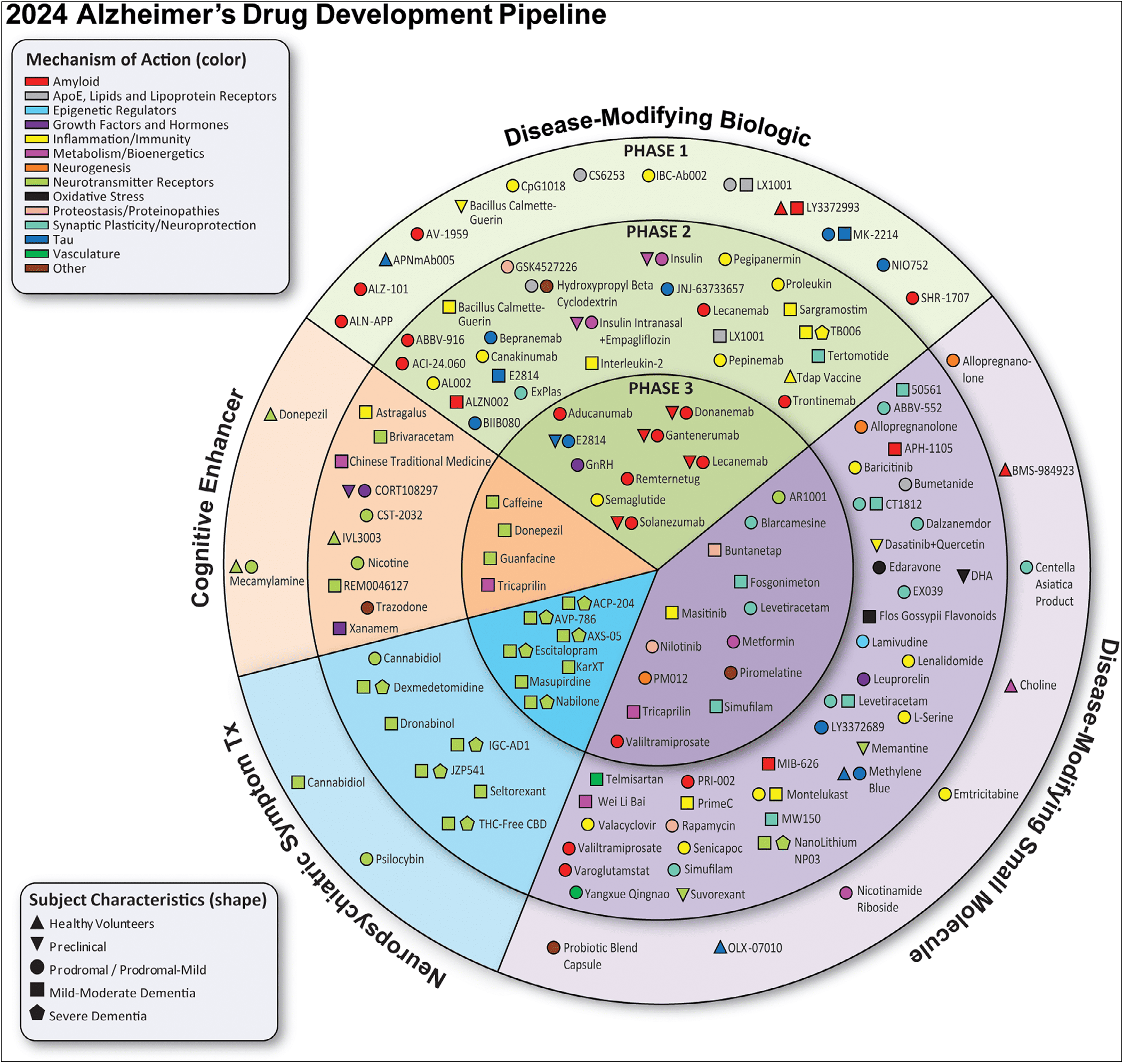
그림 1. 2024년 알츠하이머병(AD) 신약 개발의 전체 현황. [7]
1. 알츠하이머병의 병인 가설
알츠하이머병(AD)은 흔한 신경퇴행성 질환으로, 치매의 주요 원인 중 하나입니다. 전 세계적으로 5,500만 명 이상의 환자가 기록되어 있으며, 연간 경제적 부담은 1조 달러에 달합니다. [8] 알츠하이머병(AD)의 증상으로는 기억 상실, 인지 기능 저하, 행동 변화 등이 있으며, 환자와 보호자의 일상생활에 상당한 영향을 미칩니다. 인구 고령화 문제가 심각해지면서 알츠하이머병(AD)의 발생률은 계속해서 증가하고 있으며, 2050년까지 알츠하이머병(AD) 환자 수는 1억 4천만 명에 이를 것으로 예상됩니다. [9]
알츠하이머병의 치료 접근법
현재 승인된 알츠하이머병(AD) 치료제는 주로 콜린에스테라아제(Cholinesterase) 억제제와 NMDA 수용체 길항제로 구성되어 있으며, 이들 치료법은 단기적인 인지 증상 완화만 제공하며, 질환 진행을 멈출 수 없습니다. [10] 알츠하이머병(AD)의 발병 기전은 아직 명확하게 밝혀지지 않았지만, 여러 주요 가설이 존재합니다. 대표적인 병인 가설로는 아밀로이드 베타(Aβ) 캐스케이드, Tau 단백질 가설, 콜린성 가설이 있습니다. 또한, 알츠하이머병(AD)의 발병 기전으로는 금속 이온의 불균형, 신경 염증, 혈액뇌장벽(BBB) 손상, 감염성 병원체, 면역 시스템 기능 장애, 미토콘드리아 기능 장애 등과 관련이 있을 수 있습니다. [11]
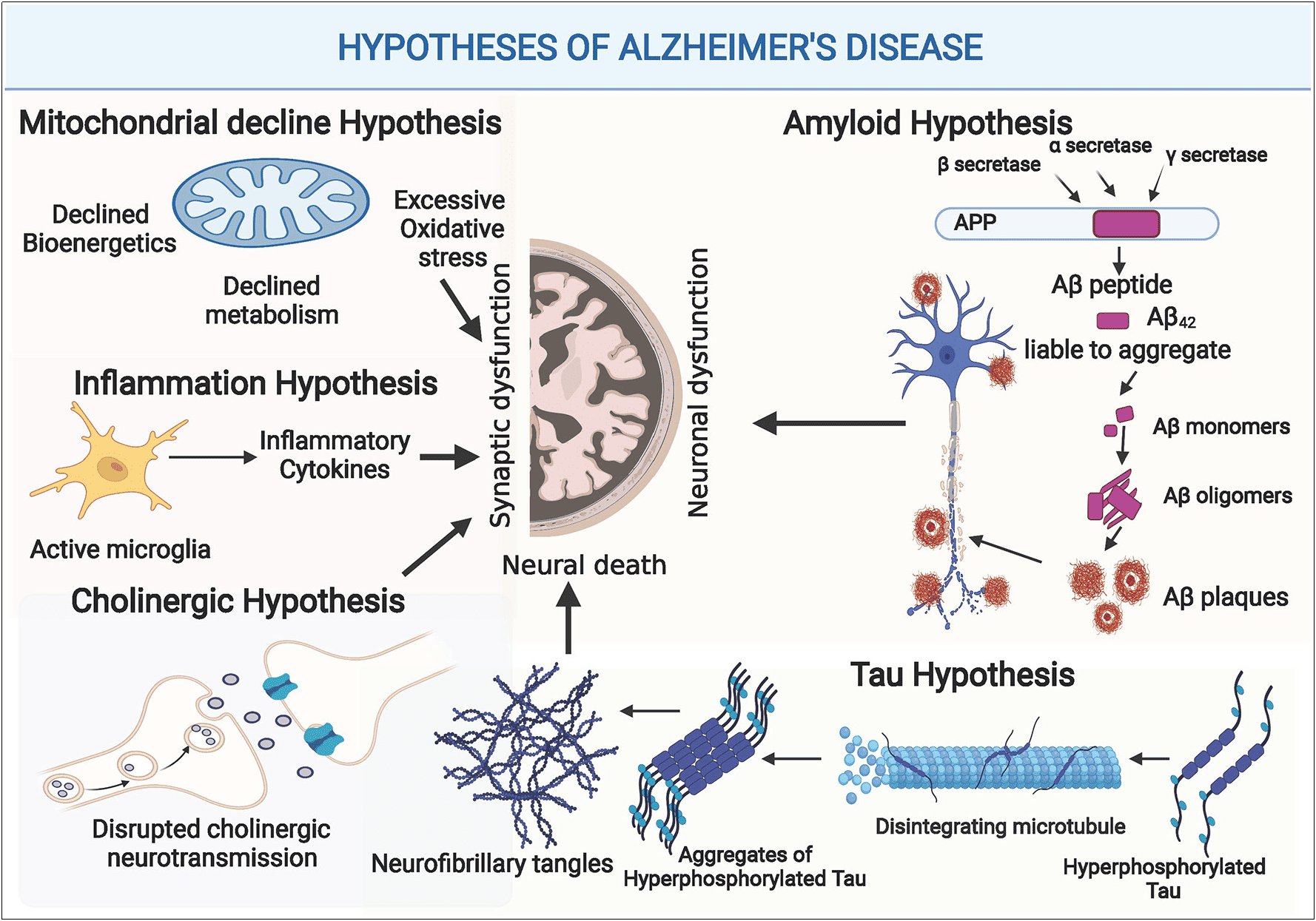
그림 2. 알츠하이머병(AD)의 병인에 대한 여러 가설 [11]
2. 알츠하이머병 발병 기전에서 Tau 단백질의 역할
Tau 단백질 가설은 Tau라는 미세소관 관련 단백질(Microtubule-associated protein)이 알츠하이머병(AD)의 진행에 중요한 역할을 한다고 주장합니다.
정상적인 상황에서는 Tau 단백질이 뉴런 내 미세소관 구조를 안정시키지만, 알츠하이머병(AD) 환자 체내에서는 Tau 단백질이 과인산화(hyperphosphorylation)되어 불용성 신경섬유 엉킴(Neurofibrillary Tangles, NFTs)을 형성하여 세포 구조를 파괴합니다. 이러한 신경섬유 엉킴(NFT)은 점차 축적되어 세포 내 수송과 신호 전달을 방해하며, 결국 뉴런 기능 장애와 세포 사멸을 초래합니다. 알츠하이머병(AD) 연구에서 보편적으로 Tau 단백질 병리를 중심으로 이뤄졌으며, 신경섬유 엉킴(NFT)은 알츠하이머병(AD)의 대표적인 특징 중 하나로 간주됩니다.[12-13] 또한, Tau는 아밀로이드 베타(Aβ) 단백질과 상호작용을 하여 신경퇴행을 악화시킵니다. Tau 단백질의 기능 이상은 전두측두엽성 치매(FTD) 및 진행성 핵상마비(Progressive Supranuclear Palsy)와 같은 "타우병증(Tauopathies)"으로 알려진 기타 신경퇴행성 질환에서도 관련이 있습니다.
신경 퇴행성 질환에 대한 Tau-타겟팅 치료 전략
현재 Tau를 타겟으로 하는 치료 전략에는 Tau 과인산화 억제, Tau 응집 방지, 타우 제거 촉진 등이 있습니다. 현재 여러 가지 Tau-타겟팅 치료법이 임상 개발 중이며, 성공할 경우 알츠하이머병(AD) 및 기타 타우병증(Tauopathies)의 질환 진행을 지연시킬 수 있을 것으로 기대됩니다.
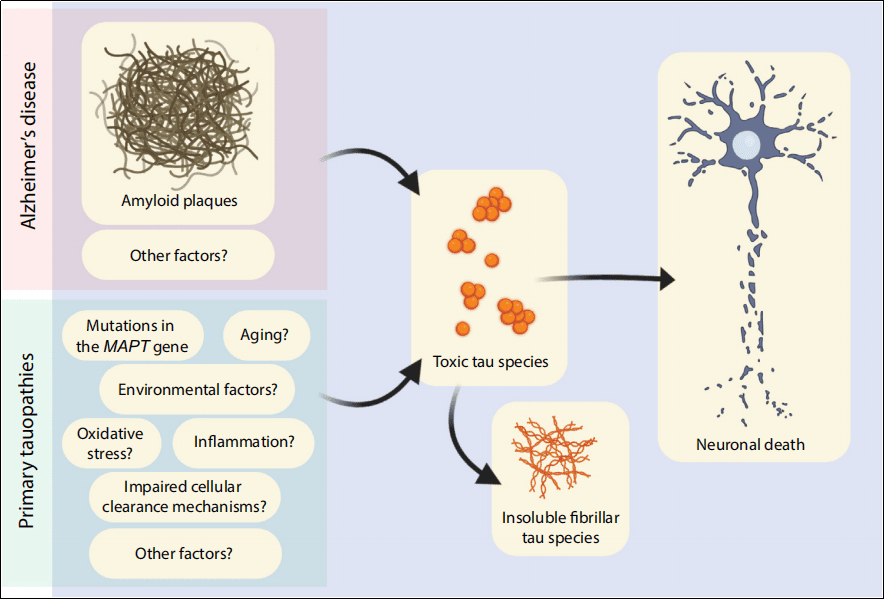
그림 3. Tau 단백질은 다양한 요인을 통해 알츠하이머병(AD)과 타우병증(Tauopathies)의 발병과 진행을 상승적으로 촉진합니다. [15]
3. Cyagen의 인간화 타우 마우스 모델
알츠하이머병(AD)과 타우병증(Tauopathies) 연구를 진전시키기 위해 Cyagen은 인간 Tau 단백질을 인코딩하는 유전자 MAPT와 그 3' UTR을 in situ 발현하는 여러 인간화 마우스 모델을 개발했습니다.
주요 Tau 마우스 모델
Wild-type(WT) 인간 MAPT 유전자와 Tau 단백질을 발현합니다.
병원성 돌연변이 유전자 P301L를 보유합니다.
병원성 돌연변이 유전자 P301S를 보유합니다.
트랜스페린 수용체 In situ 인간화(hTFRC)를 실현하여 혈액뇌장벽(BBB) 관련 연구 및 개발(R&D)을 가능하게 합니다.
인간화된 트랜스페린 수용체(hTFRC) 모델과 Tau 인간화 모델을 결합하여 혈액뇌장벽(BBB)을 통과할 수 있는 Tau-타겟팅 신약 개발 연구에 지원합니다.
Tau 마우스 모델은 다음과 같은 연구 분야에서 적용됩니다.
또한 Cyagen은 헌팅턴병(HD), 파킨슨병(PD), 척수성 근위축증(SMA) 등 다른 신경퇴행성 질환의 모델과 다양한 연구 요구에 만족하는 맞춤형 인간화 서비스를 제공합니다.
아래는 이러한 모델을 검증하는 자세한 표현형 데이터입니다.
RT-qPCR 검사를 통해 B6-htau, B6-htau*P301L 및 B6-htau*P301S 마우스 모델에서 인간 MAPT 유전자의 유의미한 발현이 검출되었습니다. 또한, 이들 모델에서는 마우스 내인성 Mapt 유전자의 발현이 검출되지 않아 인간 MAPT 유전자를 성공적으로 발현한다는 것을 확인했습니다.
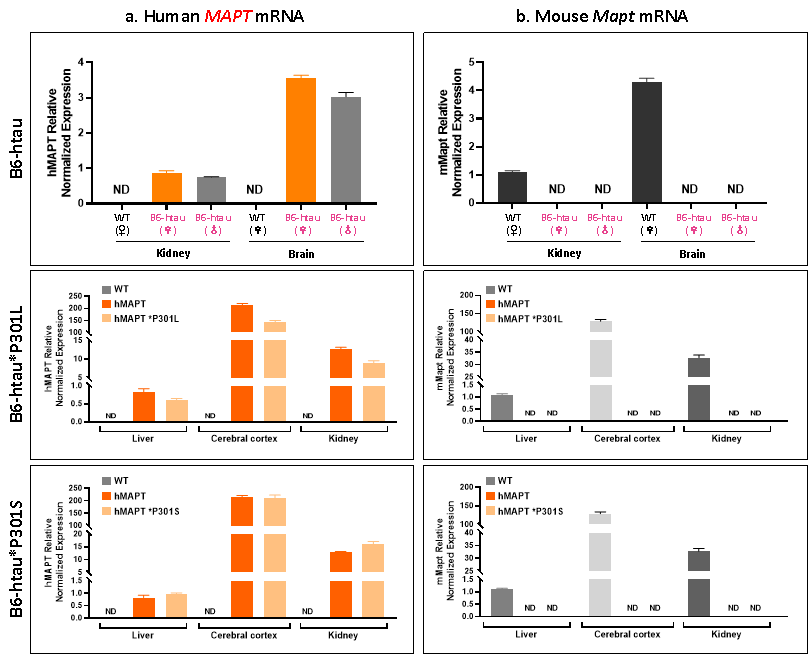
그림 4. B6-htau, B6-htau*P301L 및 B6-htau*P301S 마우스의 유전자 발현 분석 결과.
인간 특이적 Tau 단백질 항체를 사용한 웨스턴 블롯 분석으로 B6-htau 마우스 뇌에서 인간 Tau 단백질의 발현을 감지했습니다. 그 결과 B6-htau 마우스는 인간 Tau 단백질을 성공적으로 발현했으며, 여러 가지의 뚜렷한 인간 Tau 단백질 아이소폼(isoform)이 검출되었습니다.
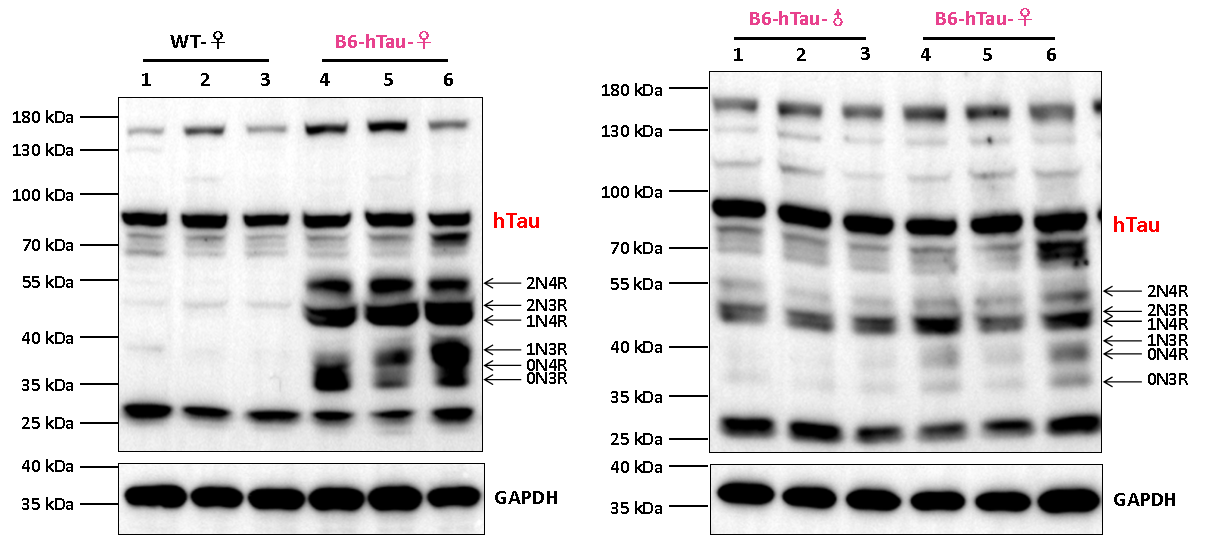
그림 5. B6-htau 마우스와 wild-type (WT) 마우스의 뇌에서 인간 Tau 단백질의 발현 분석 결과.
두 가지 인간 MAPT 타겟팅 siRNA(AD-1637701 및 Conjugate 31)로 처리한 후, B6-htau 마우스의 해마와 대뇌 피질에서 인간 MAPT mRNA의 발현 수준이 유의하게 감소했습니다.
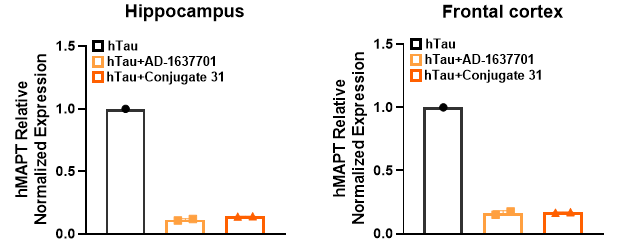
그림 6. 인간 MAPT 유전자를 타겟으로 하는 siRNA는 B6-htau 마우스에서 MAPT mRNA의 발현을 성공적으로 감소했습니다.
요약
Cyagen은 알츠하이머병(AD)과 타우병증(Tauopathies)의 신경 퇴행성 연구를 발전시키기 위해 여러 가지 in situ 인간화 마우스 모델을 개발했습니다. B6-htau 마우스(제품 번호: C001410), B6-htau*P301L 마우스(제품 번호: I001181), B6-htau*P301S 마우스(제품 번호: I001182), B6-hTFRC 마우스(제품 번호: I001189), B6-hTFRC/htau 마우스(제품 번호: I001209)는 Cyagen에서 알츠하이머병(AD) 연구를 위해 특별히 개발한 인간화 마우스 모델입니다.
B6-htau 마우스는 마우스 내인성 Mapt 유전자를 발현하지 않고 인간 MAPT 유전자를 성공적으로 발현하여 다양한 인간 Tau 단백질 아이소폼(isoform)을 생성합니다. 이 모델은 인간 MAPT 유전자를 타겟으로 하는 짧은 간섭 RNA(siRNA) 치료법을 테스트하는 데 성공적으로 사용되었습니다.
B6-htau*P301L 및 B6-htau*P301S 마우스는 인간 MAPT를 성공적으로 발현하며 각각 MAPT 유전자에 병원성 돌연변이 P301L 및 P301S를 보유합니다. 이 모델들은 인간 MAPT 유전자 전체를 발현할 뿐만 아니라 인간 MAPT Pre-mRNA의 완전한 splicing 패턴을 유지하여 다양한 Tau 단백질 아이소폼(isoform)을 생성합니다.
이러한 모델은 알츠하이머병(AD) 발병 기전에서 Tau 단백질의 중요한 역할을 연구하고 소단위 핵산, 유전자 편집, 항체 및 저분자 치료법을 포함하여 MAPT 유전자 또는 Tau 단백질을 타겟으로 하는 치료법의 효능을 평가하는 데 적용됩니다.
Cyagen은 다양한 질환 연구 및 치료제 개발의 요구를 충족하기 위해 신경 퇴행성 질환에 대한 포괄적인 맞춤형 유전자 편집 마우스 모델과 타겟 인간화 및 전체 게놈 인간화 모델을 제공합니다. 전임상 연구·개발(R&D)을 위한 행동 분석 및 약물 효능 평가 등 신경과학 전문 CRO 플랫폼을 통해 Cyagen은 맞춤형 동물 모델링을 넘어서는 서비스를 제공합니다.
아래 모델 리스트를 통해 Cyagen의 최첨단 연구 모델이 알츠하이머병(AD) 및 기타 응용 분야의 연구를 어떻게 지원할 수 있는지 알아보세요. 자세한 모델 정보는 문의해 주시기 바랍니다.
|
제품 번호 |
모델명 |
품종계통 |
응용 분야 |
|
C001427 |
C57BL/6N |
Parkinson's disease |
|
|
C001504 |
C57BL/6N |
Spinal muscular atrophy (SMA) |
|
|
C001518 |
C57BL/6J |
Duchenne muscular dystrophy (DMD) |
|
|
C001410 |
C57BL/6J |
Frontotemporal dementia, Alzheimer's disease, and other neurodegenerative diseases |
|
|
C001437 |
C57BL/6N |
Spinal muscular atrophy with respiratory distress type 1 and Charcot-Marie-Tooth disease type 2S |
|
|
C001418 |
C57BL/6J |
Amyotrophic lateral sclerosis, frontotemporal dementia, and other neurodegenerative diseases |
|
|
C001398 |
C57BL/6N |
Spinocerebellar ataxia type 3 |
|
|
I001128 |
C57BL/6N |
Rett syndrome |
|
|
I001124 |
C57BL/6N |
Progeria syndrome |
|
|
CG0015 |
- |
Parkinson's disease (PD) |
|
|
CG0016 |
C57BL/6JCya |
Depression |
참고 문헌:
[1]Roche’s Genentech returns Alzheimer’s assets to AC Immune, cutting 18-year tie. (2024, November 1). Retrieved from https://www.fiercebiotech.com/biotech/roches-genentech-returns-alzheimers-assets-ac-immune-cutting-18-year-tie-biotech
[2]Biogen to Realign Resources for Alzheimer's Disease Franchise. (2024, November 1). Retrieved from https://investors.biogen.com/news-releases/news-release-details/biogen-realign-resources-alzheimers-disease-franchise
[3]Sangamo Therapeutics Announces Global Epigenetic Regulation and Capsid Delivery License Agreement with Genentech to Develop Novel Genomic Medicines for Neurodegenerative Diseases. (2024, November 1). Retrieved from https://investor.sangamo.com/news-releases/news-release-details/sangamo-therapeutics-announces-global-epigenetic-regulation-and
[4]Approval Alert: Eli Lilly’s Kisunla™ (Donanemab-azbt) UK Approved but Not Reimbursed. (2024, November 1). Retrieved from https://www.pearceip.law/2024/10/23/approval-alert-eli-lillys-kisunla-donanemab-azbt-uk-approved-but-not-reimbursed/
[5]AbbVie axes mid-stage Alzheimer’s program amid evolving landscape. (2024, November 1). Retrieved from https://www.fiercebiotech.com/biotech/abbvie-axes-mid-stage-alzheimers-program-amid-evolving-landscape
[6]J&J jettisons several programs, ending seltorexant work for Alzheimer's. (2024, November 1). Retrieved from https://www.fiercebiotech.com/biotech/jj-jettisons-several-programs-ending-seltorexant-work-alzheimers
[7]Cummings J, Zhou Y, Lee G, Zhong K, Fonseca J, Cheng F. Alzheimer's disease drug development pipeline: 2024. Alzheimers Dement (N Y). 2024 Apr 24;10(2):e12465. Dutch.
[8]Behrman S, Chouliaras L, Ebmeier KP. Considering the senses in the diagnosis and management of dementia. Maturitas. 2014 Apr;77(4):305-10.
[9]2023 Alzheimer's disease facts and figures. Alzheimers Dement. 2023 Apr;19(4):1598-1695.
[10]Liu E, Zhang Y, Wang JZ. Updates in Alzheimer's disease: from basic research to diagnosis and therapies. Transl Neurodegener. 2024 Sep 4;13(1):45.
[11]Abuelezz NZ, Nasr FE, AbdulKader MA, Bassiouny AR, Zaky A. MicroRNAs as Potential Orchestrators of Alzheimer's Disease-Related Pathologies: Insights on Current Status and Future Possibilities. Front Aging Neurosci. 2021 Oct 12;13:743573.
[12]Chen Y, Yu Y. Tau and neuroinflammation in Alzheimer's disease: interplay mechanisms and clinical translation. J Neuroinflammation. 2023 Jul 14;20(1):165.
[13]Yang J, Zhi W, Wang L. Role of Tau Protein in Neurodegenerative Diseases and Development of Its Targeted Drugs: A Literature Review. Molecules. 2024 Jun 13;29(12):2812.
[14]Congdon EE, Ji C, Tetlow AM, Jiang Y, Sigurdsson EM. Tau-targeting therapies for Alzheimer disease: current status and future directions. Nat Rev Neurol. 2023 Dec;19(12):715-736.
[15]Frost B. Alzheimer's disease and related tauopathies: disorders of disrupted neuronal identity. Trends Neurosci. 2023 Oct;46(10):797-813.




영업일 기준 1-2일 내에 답변해 드리겠습니다.