

글루타르산혈증 1형(GA1)에 대한 이해
글루타르산혈증 1형(Glutaric Acidemia Type 1, GA1)은 글루타르산뇨증 1형이라고도 불리는 희귀한 상염색체 열성 대사 장애입니다. 유전자의 변이에 의해 발생하며, 체내 아미노산 대사 과정에 영향을 미칩니다. Gcdh 유전자는 미토콘드리아 효소인 glutaryl-CoA dehydrogenase(GCDH)를 인코딩하며, 라이신(lysine), 하이드록시라이신(hydroxylysine), 트립토판(tryptophan) 대사에 중요한 역할을 합니다.
GCDH 활성을 저해하면 glutaric acid(GA), 3-hydroxyglutaric acid(3-OH-GA), glutarylcarnitine(C5DC) 등의 유기산 대사산물이 체내에 비정상적으로 축적됩니다. 이에 따라 주로 신경계에 영향을 미치는 대사 장애 및 신경퇴행성 질환이 발생할 수 있습니다.
전 세계에서 글루타르산혈증 1형(GA1)의 유병률은 약 10만 명당 1명으로 보고되어 있습니다. 소아의 경우, 지역 및 인종 따라 3만 명에서 10만 명당 1명으로 유병률이 다릅니다. 글루타르산혈증 1형의 영유아 환자는 초기에는 정상 발달을 보일 수 있으나, 감염, 예방접종 또는 수술 등 유인에 의해 급성 뇌병증(Acute encephalopathy)이 촉발될 위험이 높습니다. 이에 따라 선조체(striatum) 손상이 발생할 수 있으며 사망률과 장애율이 높습니다.
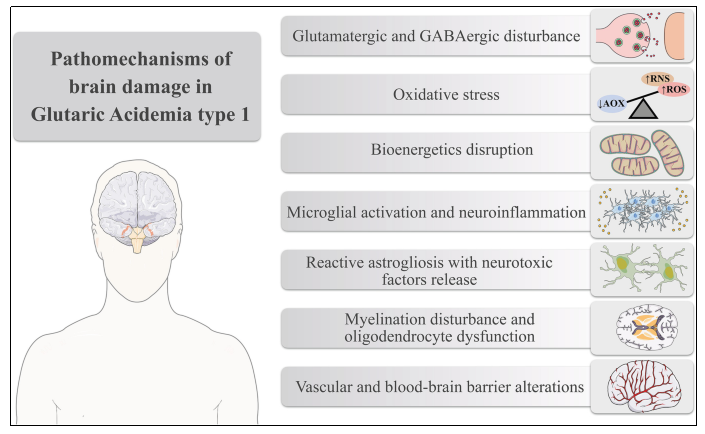
그림 1. 글루타르산혈증 1형(GA1)에서의 뇌 손상 기전. [2]
글루타르산혈증 1형(GA1)의 발병 기전
Glutaryl-CoA dehydrogenase(GCDH)는 탈수소효소(dehydrogenase)/탈카복실화(decarboxylase) 효소 계열에 속하는 미토콘드리아 효소로, L-lysine, L-hydroxylysine, L-tryptophan 대사에 필수적인 역할을 합니다. GCDH는 주로 간, 신장, 뇌와 같은 대사 활동이 활발한 조직의 미토콘드리아에 존재합니다.
GCDH(Glutaryl-CoA dehydrogenase)는 glutaryl-CoA를 glutaconyl-CoA로 산화시키는 반응을 촉매하여 독성 대사산물의 축적을 방지하며, 이후 glutaconyl-CoA는 crotonyl-CoA로 탈카복실화됩니다. 이 과정은 라이신(lysine), 하이드록시라이신(hydroxylysine), 트립토판(tryptophan) 대사 경로에서 핵심 단계이며, 이들 필수 아미노산의 대사 부산물은 체내에 독성 축적을 방지하기 위해 신속히 제거되어야 합니다. 또한, GCDH 결핍은 대사 경로를 방해하여 에너지 공급을 저해하고, 높은 에너지 의존성을 가지는 뇌 조직에 특히 심각한 영향을 미칩니다.
GCDH(Glutaryl-CoA dehydrogenase)는가 없으면 glutaryl-CoA가 정상적으로 대사될 수 없습니다. 이로 인해 GA, 3-OH-GA 및 C5DC와 같은 유해한 화합물이 축적됩니다. 이러한 대사 산물은 중추 신경계, 특히 선조체(Striatal region)에 대해 독성이 강하여 신경 세포 손상, 신경세포 손상, 공포화(vacuolization), 염증 반응을 유발할 수 있습니다[3-5]. 임상 증상으로는 대두증(Macrocephaly), 진행성 근육긴장이상증(Progressive dystonia), 운동 기능 장애 등이 있으며, 심각한 경우 사망에 이를 수 있습니다.
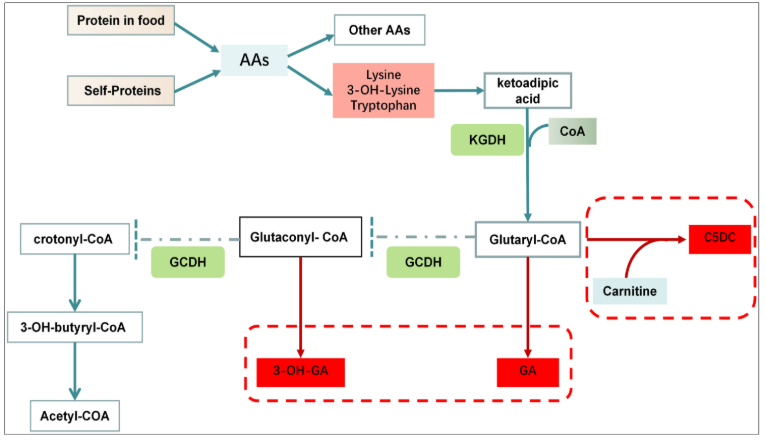
그림 2. 글루타르산혈증 1형(GA1)에서 라이신(lysine) 및 트립토판(tryptophan) 대사 이상. [5]
글루타르산혈증 1형(GA1)을 연구하고 치료 전략을 개발하기 위해, 연구자들은 인간 질환의 발병 기전과 병리 특징을 시뮬레이션할 수 있는 유전자 변형 마우스 모델을 주로 사용합니다. 연구에 따르면, Gcdh Knockout(KO) 마우스는 인간 글루타르산혈증 1형(GA1) 환자와 매우 유사한 생화학적 표현형을 나타냅니다.
Gcdh Knockout(KO) 마우스는 다음과 같은 특징을 보입니다:
성체까지 생존한 Gcdh Knockout(KO) 마우스는 심각한 신경병리학적 변화를 보이며, 여기에는 신경세포의 손실과 공포화(vacuolization), 뇌실내출혈(IVH)이 포함됩니다[8-9]. Gcdh Knockout(KO) 마우스는 인간 글루타르산혈증 1형(GA1) 병리학과의 높은 유사성으로 인해 아래 연구 분야에 매우 유용합니다:
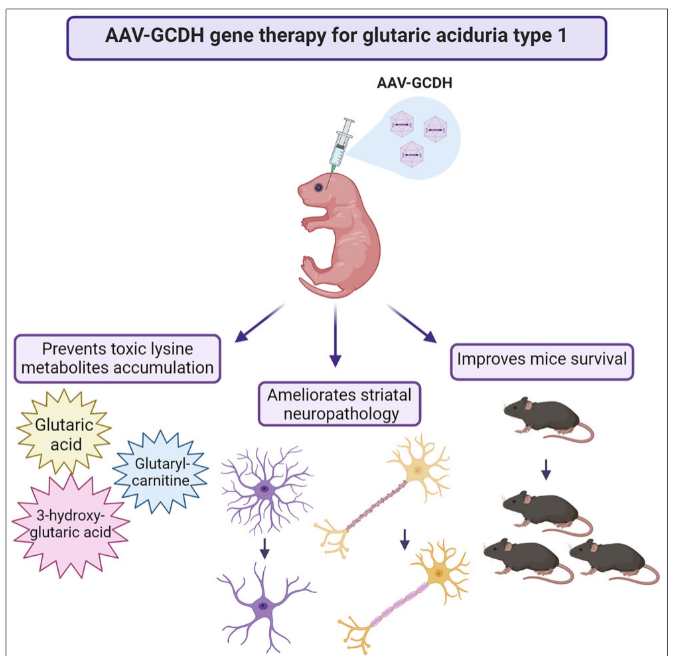
그림 3. AAV-mediated 보충 요법의 전임상 효능 평가에 사용된 Gcdh Knockout(KO) 마우스 [10]
질환 연구를 위한 Cyagen의 Gcdh Knockout(KO) 마우스 모델
Cyagen의 Gcdh Knockout(KO) 마우스 모델은 인간의 글루타르산혈증 1형(GA1)에서 나타나는 대사 장애를 정확하게 재현하도록 개발되었습니다. 이 모델은 질환의 병리 기전을 연구하고 치료 옵션을 평가하는 데 유용합니다. Cyagen은 Knockout 기술을 통해 Gcdh 유전자를 제거하여 글루타르산혈증 1형(GA1) 및 기타 Gcdh 관련 대사질환을 연구할 수 있도록 Gcdh Knockout(KO) 마우스 모델(제품 번호: C001594)을 개발하였습니다.
Gcdh Knockout(KO) 마우스 모델은 혈장, 뇌, 간 조직에 상당량의 글루타르산(GA)을 축적하며, wild-type(WT) 마우스에 비해 글루타르산혈증 1형(GA1)의 전형적인 생화학적 표현형을 나타냅니다. 이 모델은 다음과 같은 다양한 연구에 적용됩니다:
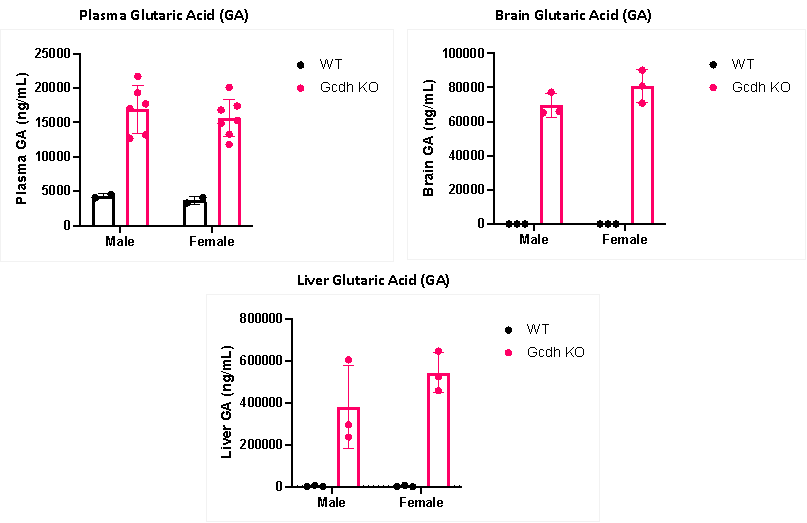
그림 4. Wild-type(WT) 마우스와 Gcdh Knockout(KO) 마우스의 GA 수치 비교
Gcdh Knockout(KO) 마우스: 대사 질환 연구에서의 응용
Gcdh Knockout(KO) 마우스 모델을 활용하면 연구자들은 대사 장애를 분석하고, 바이오마커를 발굴하며, 글루타르산혈증 1형(GA1)의 장기적인 신경학적 영향을 평가할 수 있습니다.
치료제 개발 및 약물 검사
Gcdh Knockout(KO) 마우스 모델은 식이 요법, 유전자 치료, Gcdh 유전자 경로를 타겟으로 하는 저분자 약물에 대한 전임상 연구를 가능하게 합니다.
>> Cyagen의 Gcdh Knockout(KO) 마우스 모델 자세히 알아보기
Cyagen의 마우스 모델을 선택하는 이유
결론
Gcdh Knockout(KO) 마우스 모델은 글루타르산혈증 1형(GA1)과 같은 희귀 대사질환을 연구하는 데 있어 필수적인 연구 모델입니다. Cyagen은 Gcdh 유전자의 기능, 질환 진행 과정 및 치료법 혁신을 연구할 수 있도록 고품질의 유전자 변형 마우스 모델을 제공합니다. Cyagen은 맞춤형 유전자 편집 및 포괄적인 전임상 연구 서비스를 통해 대사 질환 치료 및 정밀 의학 분야의 발전을 지원하고 있습니다.
Cyagen의 다양한 대사 질환 모델을 더 알아보세요
Cyagen은 유명한 글로벌 제약회사, 바이오테크 기업 및 학술 연구 기관과 긴밀히 협력하여 포괄적인 대사 질환 모델을 개발하고 있습니다. Cyagen의 유전자 모델링 전문가는 간 질환, 비만, 당뇨병, 고요산혈증(Hyperuricemia), 죽상동맥경화증(Atherosclerosis) 등 다양한 대사 관련 질환과 연관된 질환 모델을 개발하여 해당 분야의 연구 및 신약 개발을 가속하고 있습니다.
대사 및 심혈관 질환 연구에 적용되는 마우스 모델
|
제품 번호 |
모델명 |
품종 계통 |
응용 분야 |
|
C001507 |
C57BL/6JCya |
Atherosclerosis, Hypercholesterolemia, Metabolic Dysfunction-Associated Steatohepatitis (MASH) |
|
|
C001067 |
APOE |
C57BL/6NCya |
Atherosclerosis |
|
C001291 |
B6-db/db |
C57BL/6JCya |
High Blood Sugar and Obesity |
|
C001392 |
C57BL/6JCya |
Familial Hypercholesterolemia |
|
|
C001368 |
C57BL/6JCya |
Type 2 Diabetes and Obesity |
|
|
C001232 |
C57BL/6JCya |
Hyperuricemia |
|
|
C001267 |
C57BL/6NCya |
Copper Metabolism Disorder, Wilson's Disease |
|
|
C001265 |
C57BL/6NCya |
Primary Ciliary Dyskinesia |
|
|
C001266 |
C57BL/6NCya |
Klinefelter Syndrome |
|
|
C001273 |
C57BL/6NCya |
Phenylketonuria Type 1 |
|
|
C001383 |
Alb-Cre/LSL-hLPA |
C57BL/6NCya |
Cardiovascular Targets |
|
C001421 |
C57BL/6NCya |
Metabolic Targets |
|
|
C001400 |
C57BL/6JCya |
Metabolic Targets |
|
|
C001493 |
FVB |
Diseases Related to Blood-Brain Barrier Permeability |
|
|
C001532 |
C57BL/6JCya |
Hereditary Angioedema(HAE) |
|
|
C001549 |
C57BL/6NCya |
Research on diet-induced obesity, diabetes, inflammation, fatty liver, and other metabolic diseases; drug development, screening, and preclinical efficacy evaluation for obesity. |
|
|
C001553 |
C57BL/6NCya |
Familial hypercholesterolemia (FH); atherosclerotic cardiovascular disease (ASCVD); other cardiovascular diseases (CVD). |
|
|
C001560 |
C57BL/6JCya |
Phenylketonuria (PKU) |
|
|
I001220 |
C57BL/6Cya |
Research on PCSK9-targeted drug development; studies on metabolic diseases such as hyperlipidemia, stroke, coronary heart disease, and familial hypercholesterolemia (FH). |
|
|
I001223 |
C57BL/6NCya |
Fabry Disease (FD) |
|
|
C001583 |
FVB/NJCya |
Propionic Acidemia (PA) |
|
|
C001590 |
FVB/NJCya |
Progressive Familial Intrahepatic Cholestasis Type 3 (PFIC3) |
|
|
C001594 |
C57BL/6JCya |
Glutaric aciduria type I (GA1) |
|
|
C001600 |
C57BL/6NCya; C57BL/6JCya |
Type 2 Diabetes, Obesity, and Metabolic Disorders Associated with Improper Fat Distribution and Storage |
|
|
C001601 |
C57BL/6NCya; C57BL/6JCya |
Type 2 Diabetes and Obesity |
|
|
C001591 |
C57BL/6NCya; C57BL/6JCya |
Familial hypercholesterolemia (FH); atherosclerotic cardiovascular disease (ASCVD); other cardiovascular diseases (CVD) |
|
Diet-Induced Metabolic Dysfunction-Associated Steatotic Liver Disease (MASLD) Model |
|||
참고 문헌:
[1]Li Q, Yang C, Feng L, Zhao Y, Su Y, Liu H, Men H, Huang Y, Körner H, Wang X. Glutaric Acidemia, Pathogenesis and Nutritional Therapy. Front Nutr. 2021 Dec 15;8:704984.
[2]Wajner, M. (2022). Glutaric Acidemia Type 1: An Inherited Neurometabolic Disorder of Intoxication. In: Kostrzewa, R.M. (eds) Handbook of Neurotoxicity. Springer, Cham.
[3]Schuurmans IME, Dimitrov B, Schröter J, Ribes A, de la Fuente RP, Zamora B, van Karnebeek CDM, Kölker S, Garanto A. Exploring genotype-phenotype correlations in glutaric aciduria type 1. J Inherit Metab Dis. 2023 May;46(3):371-390.
[4]Boy N, Mühlhausen C, Maier EM, Ballhausen D, Baumgartner MR, Beblo S, Burgard P, Chapman KA, Dobbelaere D, Heringer-Seifert J, Fleissner S, Grohmann-Held K, Hahn G, Harting I, Hoffmann GF, Jochum F, Karall D, Konstantopoulous V, Krawinkel MB, Lindner M, Märtner EMC, Nuoffer JM, Okun JG, Plecko B, Posset R, Sahm K, Scholl-Bürgi S, Thimm E, Walter M, Williams M, Vom Dahl S, Ziagaki A, Zschocke J, Kölker S. Recommendations for diagnosing and managing individuals with glutaric aciduria type 1: Third revision. J Inherit Metab Dis. 2023 May;46(3):482-519.
[5]Li Q, Yang C, Feng L, Zhao Y, Su Y, Liu H, Men H, Huang Y, Körner H, Wang X. Glutaric Acidemia, Pathogenesis and Nutritional Therapy. Front Nutr. 2021 Dec 15;8:704984.
[6]Koeller DM, Woontner M, Crnic LS, Kleinschmidt-DeMasters B, Stephens J, Hunt EL, Goodman SI. Biochemical, pathologic and behavioral analysis of a mouse model of glutaric acidemia type I. Hum Mol Genet. 2002 Feb 15;11(4):347-57.
[7]Keyser B, Glatzel M, Stellmer F, Kortmann B, Lukacs Z, Kölker S, Sauer SW, Muschol N, Herdering W, Thiem J, Goodman SI, Koeller DM, Ullrich K, Braulke T, Mühlhausen C. Transport and distribution of 3-hydroxyglutaric acid before and during induced encephalopathic crises in a mouse model of glutaric aciduria type 1. Biochim Biophys Acta. 2008 Jun;1782(6):385-90.
[8]Zinnanti WJ, Lazovic J, Wolpert EB, Antonetti DA, Smith MB, Connor JR, Woontner M, Goodman SI, Cheng KC. A diet-induced mouse model for glutaric aciduria type I. Brain. 2006 Apr;129(Pt 4):899-910.
[9]Seminotti B, Amaral AU, da Rosa MS, Fernandes CG, Leipnitz G, Olivera-Bravo S, Barbeito L, Ribeiro CA, de Souza DO, Woontner M, Goodman SI, Koeller DM, Wajner M. Disruption of brain redox homeostasis in glutaryl-CoA dehydrogenase deficient mice treated with high dietary lysine supplementation. Mol Genet Metab. 2013 Jan;108(1):30-9.
[10]Mateu-Bosch A, Segur-Bailach E, Muñoz-Moreno E, Barallobre MJ, Arbonés ML, Gea-Sorlí S, Tort F, Ribes A, García-Villoria J, Fillat C. Systemic delivery of AAV-GCDH ameliorates HLD-induced phenotype in a glutaric aciduria type I mouse model. Mol Ther Methods Clin Dev. 2024 Jun 4;32(3):101276.
[11]Barzi M, Johnson CG, Chen T, Rodriguiz RM, Hemmingsen M, Gonzalez TJ, Rosales A, Beasley J, Peck CK, Ma Y, Stiles AR, Wood TC, Maeso-Diaz R, Diehl AM, Young SP, Everitt JI, Wetsel WC, Lagor WR, Bissig-Choisat B, Asokan A, El-Gharbawy A, Bissig KD. Rescue of glutaric aciduria type I in mice by liver-directed therapies. Sci Transl Med. 2023 Apr 19;15(692):eadf4086.
[12]Wagner GR, Bhatt DP, O'Connell TM, Thompson JW, Dubois LG, Backos DS, Yang H, Mitchell GA, Ilkayeva OR, Stevens RD, Grimsrud PA, Hirschey MD. A Class of Reactive Acyl-CoA Species Reveals the Non-enzymatic Origins of Protein Acylation. Cell Metab. 2017 Apr 4;25(4):823-837.e8.
[13]Sauer SW, Opp S, Komatsuzaki S, Blank AE, Mittelbronn M, Burgard P, Koeller DM, Okun JG, Kölker S. Multifactorial modulation of susceptibility to l-lysine in an animal model of glutaric aciduria type I. Biochim Biophys Acta. 2015 May;1852(5):768-77.




영업일 기준 1-2일 내에 답변해 드리겠습니다.