

고요산혈증(Hyperuricemia, HU)은 혈중 요산 농도가 비정상적으로 높아지는 대사 질환으로, 전 세계적으로 점차 심각한 건강 문제로 대두되고 있습니다. 고요산혈증(HU)은 관절에 요산염 결정이 침착되어 발생하는 염증성 관절염인 통풍은 물론 신장 결석과 심혈관 합병증의 위험을 크게 높입니다. 고요산혈증(HU)과 통풍의 유병률이 증가함에 따라 신약 개발과 치료법 발전을 촉진하기 위한 혁신적인 연구 모델이 절실히 요구되고 있습니다.
이러한 필요성을 해결하기 위해 Cyagen은 네이티브 마우스 Xdh 유전자를 제거하면서 전체 길이의 인간 XDH 유전자를 통합한 B6-hXDH 인간화 마우스 모델을 개발했습니다.
B6-hXDH 마우스 모델 모델은 인간의 요산 대사를 매우 유사하게 시뮬레이션하여 고요산혈증(HU) 및 통풍에 대한 잔틴 산화효소 억제제(Xanthine Oxidase Inhibitors, XOI)와 차세대 치료제를 대상으로 하는 전임상 연구에 매우 유용한 연구 모델입니다.
고요산혈증과 통풍: 전 세계적으로 증가하는 건강 문제
고요산혈증(HU)은 혈중 요산 수치가 비정상적으로 높아지는 대사 장애입니다.
요산은 체내 퓨린 대사의 최종 산물이며, 요산 수치가 높으면 관절에 요산염이 결정화되어 통풍성 관절염을 유발할 수 있으며 신장에 결석이 생길 수 있습니다.
통풍 발작이 발생하면 환자는 종종 극심한 관절 통증, 발적, 부기, 발열을 경험합니다[1]. 고요산혈증은 장기적으로 지속되면 신장 질환, 고혈압, 심혈관 질환의 위험도가 높아집니다.
통풍과 고요산혈증(HU)은 전 세계적으로 유병률이 증가하고 있으며, '쓰리고'(고혈압, 고지혈증, 고혈당증) 다음으로 가장 흔한 만성 질환 중 하나가 되었습니다.
현재 전 세계적으로 고요산혈증 유병률은 2.6%에서 36%에 이르며, 젊은 인구에서 발병률이 증가하는 추세를 보이고 있으며 연령이 높아질수록 유병률이 높아지는 것으로 나타났습니다. [2]
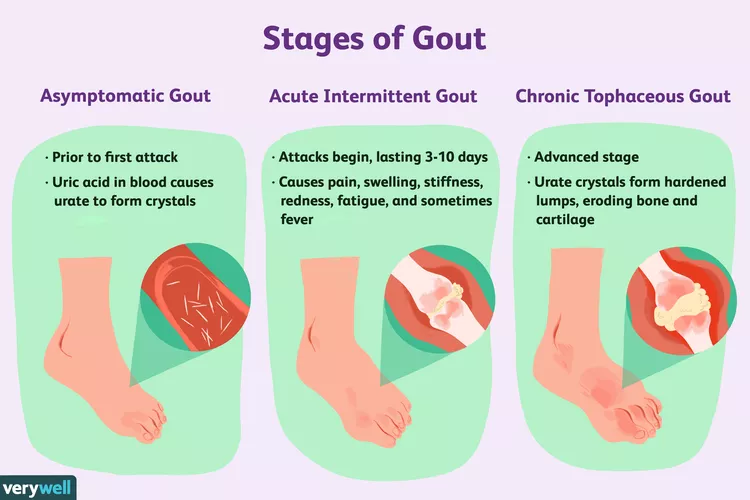
그림 1. 고요산혈증(HU)으로 인한 통풍의 질환 진행 단계.[3]
고요산혈증과 통풍의 질환 진행 및 치료
통풍은 관절 및 비관절 구조에 요산 일나트륨(Monosodium Urate, MSU) 결정이 침착되어 발생하는 흔한 만성 염증성 질환입니다. 혈청 요산 수치 상승(고요산혈증)은 MSU 결정 침착 및 통풍 발병의 주요 위험 요인입니다. 임상적으로 고요산혈증은 재발성 급성 통풍성 관절염 발작, 통풍 결절(tophus) 형성, 만성 통풍 결절(tophus) 관절염, 관절 기형과 관련이 있으며, 신장 관련 합병증으로는 만성 간질성 신염 및 요산염 신결석증(신장 결석 질환) 등이 있습니다. [4-5]
2020년 기준으로 전 세계에서 11억 명 이상의 사람들이 고요산혈증(HU) 및 통풍에 영향을 받았으며, 2024년까지 중국 내 환자 수가 각각 2억 명과 4,325만 명에 이를 것으로 예상됩니다. 환자 수의 증가로 인해 효과적인 치료에 대한 수요가 지속적으로 증가하고 있으며, 전 세계 고요산혈증(HU) 및 통풍 약물 시장은 장기적인 성장을 보일 것으로 예상됩니다.
고요산혈증(HU)은 체내 요산 수치와 밀접한 관련이 있으며, 기존 치료제는 주로 요산 생성을 줄이거나 요산 배설을 촉진하여 질환 발병 상태를 조절합니다. 요산 합성을 조절하는 핵심 효소인 잔틴 산화환원효소(Xanthine oxidoreductase, XOR)가 중요한 치료 타겟으로 작용합니다. [6]
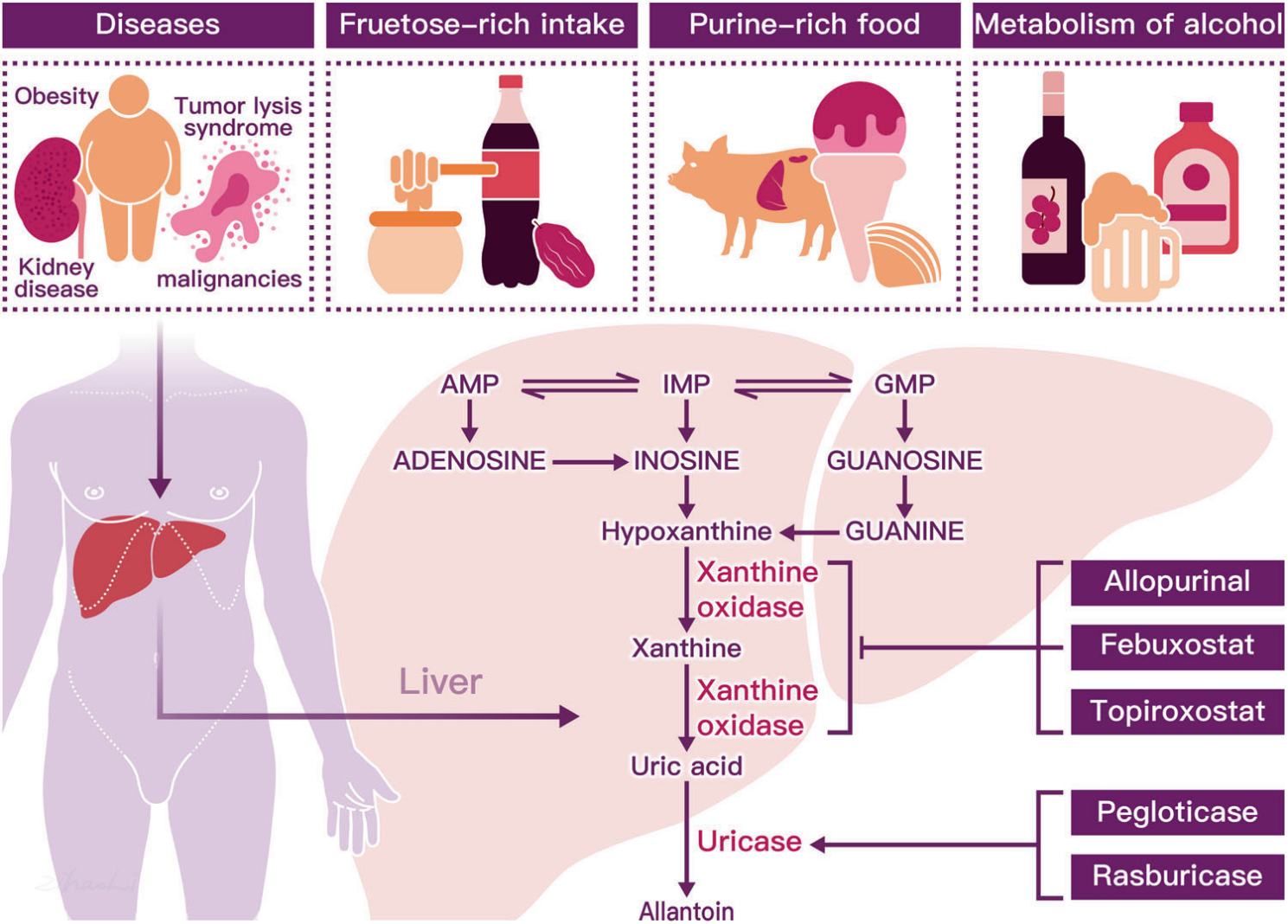
그림 2. 특정 질환, 퓨린이 풍부한 음식, 알코올 대사는 요산(UA) 생성을 촉진합니다. [6]
잔틴 산화환원효소(XOR)와 요산 합성
잔틴 산화환원효소(XOR)는 환원 상태의 잔틴 탈수소효소(Xanthine Dehydrogenase, XDH)와 산화 상태의 잔틴 산화효소(Xanthine Oxidase, XO)라는 상호 전환 가능한 두 형태로 존재하는 몰리브덴(Molybdenum) 잔틴 산화효소입니다.
잔틴 탈수소효소(XDH)는 가역적인 티올 산화 반응 또는 비가역적인 단백질 분해 변형을 통해 잔틴 산화효소(XO)로 전환될 수 있습니다[7]. 잔틴 탈수소효소(XDH)는 환원된 상태에서 하이포잔틴(Hypoxanthine)을 잔틴으로 전환한 후 요산으로 전환하는 촉매 역할을 하며, 이 과정에서 NADH를 생성합니다. 잔틴 산화효소(Xanthine Oxidase, XO)는 산화 상태에서 잔틴이 요산과 과산화수소로 전환되는 것을 촉매합니다.
잔틴 산화환원효소(XOR)는 퓨린 대사의 주요 조절인자로 하이포잔틴(Hypoxanthine)을 잔틴으로 산화하고 나아가 요산으로 산화되는 것을 촉매하여 요산 생성을 조절하는 역할을 합니다.[8-9] 따라서 잔틴 산화환원효소(XOR) 활성을 억제하면 혈청 요산 수치가 감소하고 관절과 조직에 요산염 결정이 침착되는 것을 방지할 수 있으며, 통풍 증상을 완화하고 신장 결석과 같은 관련 합병증의 위험을 줄일 수 있습니다. 이는 고요산혈증(HU)과 통풍 치료의 핵심 전략이 됩니다.
잔틴 산화환원효소(XOR) 활동을 억제하면 혈청 요산 수치를 낮추고 관절과 조직에 요산염 결정이 침착되는 것을 방지할 수 있습니다. 알로푸리놀(Allopurinol)과 페북소스타트(Febuxostat) 같은 잔틴 산화효소 억제제(Xanthine oxidase inhibitors, XOI)는 잔틴 산화효소(XO)를 억제하여 요산 생성을 감소시키며 고요산혈증(HU)과 통풍의 필수 치료제로 자리 잡았습니다. [10]
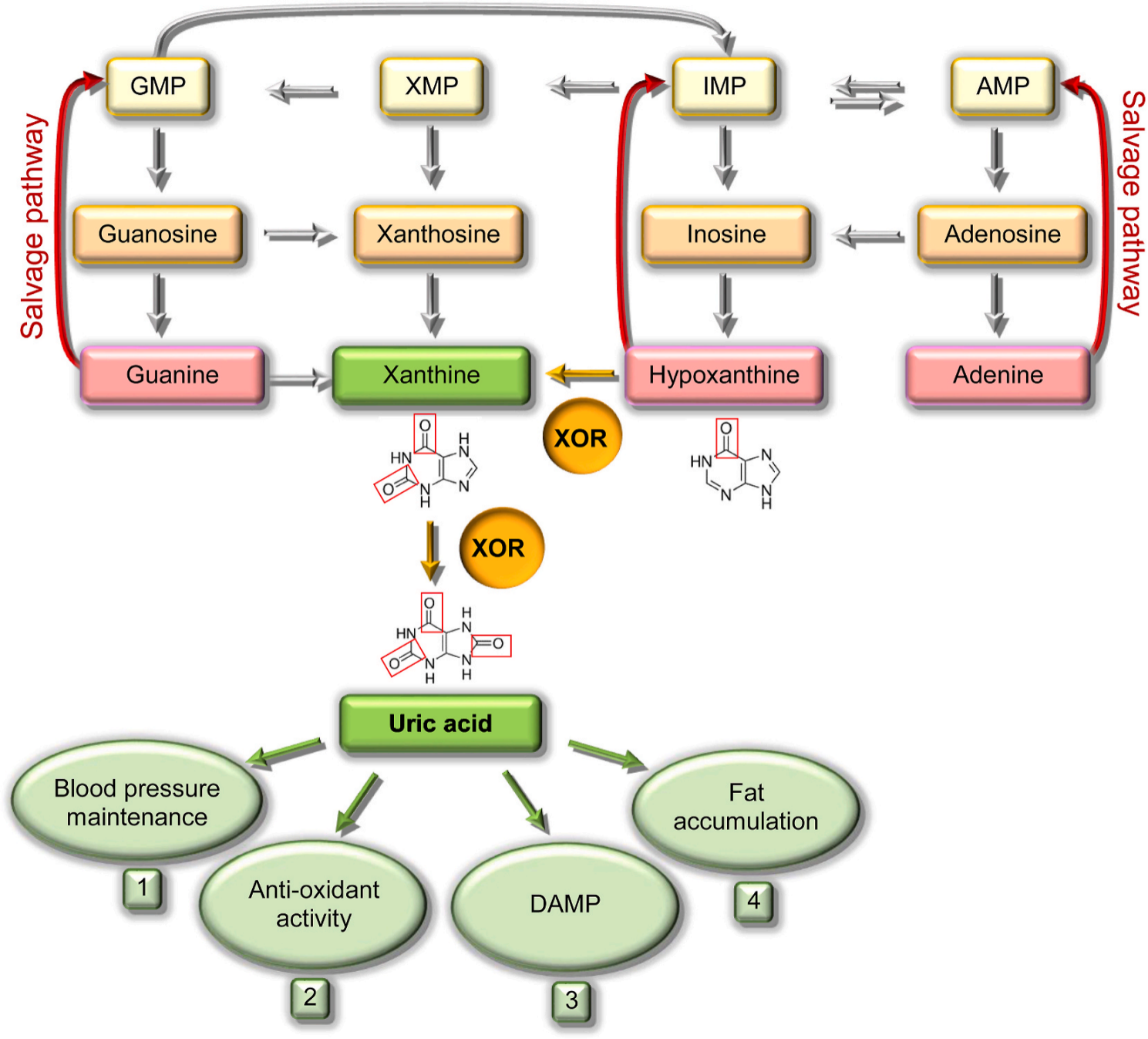
그림 3. 잔틴 산화환원효소(XOR) 시스템에 의해 촉매되는 요산 합성 경로 [9]
약물 연구를 위한 XDH 인간화 마우스 모델
알로푸리놀(Allopurinol)과 페북소스타트(Febuxostat)와 같은 잔틴 산화효소 억제제(XOI) 약물은 임상 사용 승인에도 불구하고 안전성 문제가 제기되고 있습니다. 알로푸리놀(Allopurinol)은 심각한 알레르기 반응을 유발할 가능성이 있으며, 페북소스타트(Febuxostat)는 심혈관계 위험으로 인해 FDA 블랙박스 경고가 포함되어 광범위한 사용이 제한되고 있습니다. 이에 따라 보다 안전한 대안을 개발해야 하는 시급한 필요성이 대두되고 있으며, 소규모 간섭 RNA(siRNA) 기반 치료법이 유망한 접근법으로 떠오르고 있습니다.
잔틴 탈수소효소(XDH)와 잔틴 산화효소(XO)는 XDH 유전자에 위해 인코딩됩니다. 그러나 인간과 마우스의 유전적, 단백질적 차이로 인해 인간 XDH 유전자 또는 해당 mRNA를 타겟으로 하는 siRNA 기반 치료법을 테스트하는 데 어려움이 있습니다. 이를 해결하기 위해 Cyagen은 마우스 Xdh 유전자를 인간 XDH 유전자로 in situ 대체한(5'UTR + Human Exon & Intron + 3'UTR) B6-hXDH 인간화 마우스 모델(제품 번호: C001586)을 개발했습니다. 이 모델은 잔틴 산화효소 억제제(XOI) 및 RNA 기반 치료제를 임상시험으로의 전환을 촉진할 수 있습니다.
유전자 발현 분석 결과에 따르면, B6-hXDH 마우스 모델은 인간 XDH 유전자를 성공적으로 발현하고, 마우스 Xdh 유전자를 더 이상 발현되지 않는 것으로 나타났습니다. 다른 조직에서 걸친 인간 XDH 유전자의 상대적 발현 수준은 마우스 내인성 유전자의 발현 수준과 유사합니다.
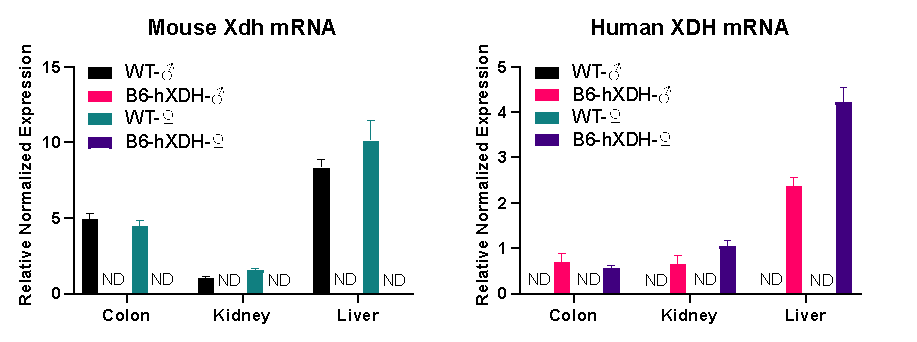
그림 4. Wild-type(WT) 및 B6-hXDH 마우스의 조직에서 인간 XDH 유전자와 마우스 Xdh 유전자 발현의 비교
웨스턴 블롯(Western blot) 실험 결과 B6-hXDH 마우스는 간과 신장에서 인간 잔틴 산화효소(XO) 단백질을 성공적으로 발현하는 것으로 확인되었습니다.
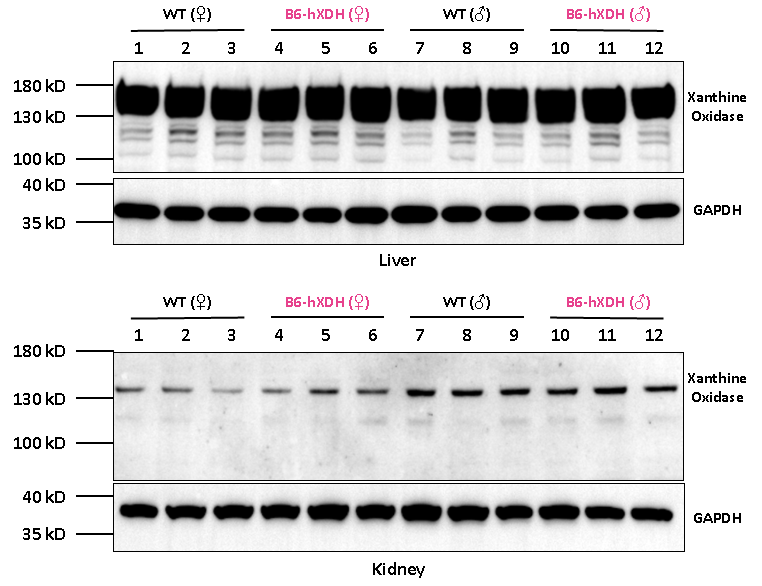
그림 5. Wild-type(WT) 및 B6-hXDH 마우스의 간과 신장에서의 인간 잔틴 산화효소(XO) 단백질 발현 분석 결과
참고: 검출에 사용된 항체는 인간 및 마우스 잔틴 산화효소(XO) 모두와 교차 반응하여 Wild-type(WT) 마우스 모델은 웨스턴 블롯(Western blot) 분석에 인간 잔틴 산화효소((XO) 밴드가 나타납니다.
혈액 생화학 분석 결과에 따르면 B6-hXDH 마우스의 혈청 요산(UA) 수치는 Wild-type(WT) 마우스보다 약간 낮으며, 수컷 마우스에서 더 뚜렷한 차이가 관찰되었습니다. B6-hXDH 마우스와 Wild-type(WT) 마우스 혈청의 혈중 요소 질소(BUN) 수치는 유의미한 차이가 관찰되지 않았습니다.
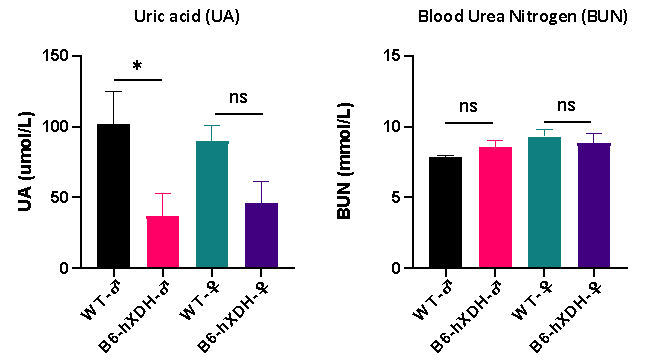
그림 6. Wild-type(WT) 마우스와 B6-hXDH 마우스 간의 혈청 요산(UA) 및 혈중 요소 질소(BUN) 수치 비교
결론
B6-hXDH 인간화 마우스 모델(제품 번호 C001586)의 특징은 비코딩 조절 영역을 포함한 완전한 인간 XDH 서열로 마우스 Xdh 유전자 in situ 대체를 진행하는 것입니다. B6-hXDH 인간화 마우스 모델은 마우스 내인성 유전자와 유사한 패턴으로 인간 XDH 유전자와 잔틴 산화효소(XO) 단백질을 발현합니다.
이 모델은 인간과 유사한 XDH 유전자 및 단백질 발현 패턴을 정확하게 복제하여 고요산혈증(HU) 및 통풍의 병태생리를 연구하는 데 매우 적합하며, 새로운 잔틴 산화효소 억제제(XOI) 및 혁신적인 소단위 핵산 RNA 기반 치료제를 개발하기 위한 이상적인 전임상 연구 모델입니다.
Cyagen의 대사성 질환 모델
Cyagen은 전 세계 유명 제약사, 생명공학 기업 및 학술 연구 기관과 광범위하게 협력하여 포괄적인 대사성 질환 모델을 개발해 왔습니다. Cyagen의 유전자 모델링 전문가들은 간 질환, 비만, 당뇨병, 고요산혈증(HU), 죽상동맥경화증과 같은 대사 질환과 관련된 질환 모델을 개발하여 해당 분야의 연구 및 신약 개발을 추진하고 있습니다.
대사 및 심혈관 질환 추천 연구 모델
|
제품 번호 |
모델명 |
품종 계통 |
응용 분야 |
|
C001507 |
C57BL/6JCya |
Atherosclerosis, Hypercholesterolemia, Metabolic Dysfunction-Associated Steatohepatitis (MASH) |
|
|
C001067 |
APOE |
C57BL/6NCya |
Atherosclerosis |
|
C001291 |
B6-db/db |
C57BL/6JCya |
High Blood Sugar and Obesity |
|
C001392 |
C57BL/6JCya |
Familial Hypercholesterolemia |
|
|
C001368 |
C57BL/6JCya |
Type 2 Diabetes and Obesity |
|
|
C001232 |
C57BL/6JCya |
Hyperuricemia |
|
|
C001267 |
C57BL/6NCya |
Copper Metabolism Disorder, Wilson's Disease |
|
|
C001265 |
C57BL/6NCya |
Primary Ciliary Dyskinesia |
|
|
C001266 |
C57BL/6NCya |
Klinefelter Syndrome |
|
|
C001273 |
C57BL/6NCya |
Phenylketonuria Type 1 |
|
|
C001383 |
Alb-Cre/LSL-hLPA |
C57BL/6NCya |
Cardiovascular Targets |
|
C001421 |
C57BL/6NCya |
Metabolic Targets |
|
|
C001400 |
C57BL/6JCya |
Metabolic Targets |
|
|
C001493 |
FVB |
Diseases Related to Blood-Brain Barrier Permeability |
|
|
C001532 |
C57BL/6JCya |
Hereditary Angioedema(HAE) |
|
|
C001549 |
C57BL/6NCya |
Research on diet-induced obesity, diabetes, inflammation, fatty liver, and other metabolic diseases; drug development, screening, and preclinical efficacy evaluation for obesity. |
|
|
C001553 |
C57BL/6NCya |
Familial hypercholesterolemia (FH); atherosclerotic cardiovascular disease (ASCVD); other cardiovascular diseases (CVD). |
|
|
C001560 |
C57BL/6JCya |
Phenylketonuria (PKU) |
|
|
I001220 |
C57BL/6Cya |
Research on PCSK9-targeted drug development; studies on metabolic diseases such as hyperlipidemia, stroke, coronary heart disease, and familial hypercholesterolemia (FH). |
|
|
I001223 |
C57BL/6NCya |
Fabry Disease (FD) |
|
|
C001583 |
FVB/NJCya |
Propionic Acidemia (PA) |
|
|
C001590 |
FVB/NJCya |
Progressive Familial Intrahepatic Cholestasis Type 3 (PFIC3) |
|
|
C001594 |
C57BL/6JCya |
Glutaric aciduria type I (GA1) |
|
|
C001600 |
C57BL/6NCya; C57BL/6JCya |
Type 2 Diabetes, Obesity, and Metabolic Disorders Associated with Improper Fat Distribution and Storage |
|
|
C001601 |
C57BL/6NCya; C57BL/6JCya |
Type 2 Diabetes and Obesity |
|
|
C001591 |
C57BL/6NCya; C57BL/6JCya |
Familial hypercholesterolemia (FH); atherosclerotic cardiovascular disease (ASCVD); other cardiovascular diseases (CVD) |
|
Diet-Induced Metabolic Dysfunction-Associated Steatotic Liver Disease (MASLD) Model |
|||
참고 문헌:
[1]Healthline Media. (n.d.). Hyperuricemia: Symptoms, treatment, and more. Healthline. Retrieved January 2, 2025, from https://www.healthline.com/health/hyperuricemia
[2]Huang Yuchai, Lü Yongman. Scientific Understanding and Standardized Management of Hyperuricemia [J]. Chinese Journal of Health Management, 2023, 17(4): 316-319.
[3]Verywell Health. (n.d.). Hyperuricemia (high uric acid). Retrieved January 2, 2025, from https://www.verywellhealth.com/hyperuricemia-high-uric-acid-189838
[4]Dalbeth N, Choi HK, Joosten LAB, Khanna PP, Matsuo H, Perez-Ruiz F, Stamp LK. Gout. Nat Rev Dis Primers. 2019 Sep 26;5(1):69.
[5]Dalbeth N, Gosling AL, Gaffo A, Abhishek A. Gout. Lancet. 2021 May 15;397(10287):1843-1855. doi: 10.1016/S0140-6736(21)00569-9. Epub 2021 Mar 30. Erratum in: Lancet. 2021 May 15;397(10287):1808.
[6]Du L, Zong Y, Li H, Wang Q, Xie L, Yang B, Pang Y, Zhang C, Zhong Z, Gao J. Hyperuricemia and its related diseases: mechanisms and advances in therapy. Signal Transduct Target Ther. 2024 Aug 28;9(1):212.
[7]Cicero AFG, Fogacci F, Kuwabara M, Borghi C. Therapeutic Strategies for the Treatment of Chronic Hyperuricemia: An Evidence-Based Update. Medicina (Kaunas). 2021 Jan 10;57(1):58.
[8]Furuhashi M. New insights into purine metabolism in metabolic diseases: role of xanthine oxidoreductase activity. Am J Physiol Endocrinol Metab. 2020 Nov 1;319(5):E827-E834.
[9]Bortolotti M, Polito L, Battelli MG, Bolognesi A. Xanthine oxidoreductase: One enzyme for multiple physiological tasks. Redox Biol. 2021 May;41:101882.
[10]Lee Y, Hwang J, Desai SH, Li X, Jenkins C, Kopp JB, Winkler CA, Cho SK. Efficacy of Xanthine Oxidase Inhibitors in Lowering Serum Uric Acid in Chronic Kidney Disease: A Systematic Review and Meta-Analysis. J Clin Med. 2022 Apr 27;11(9):2468.




영업일 기준 1-2일 내에 답변해 드리겠습니다.