

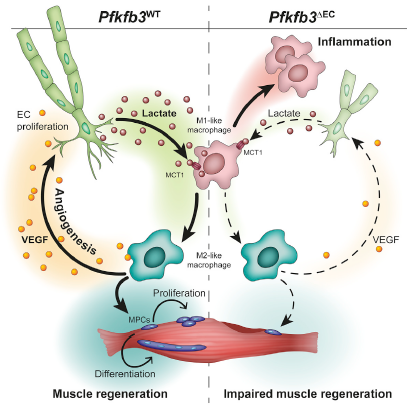
내피세포(endothelial cell, EC)는 혈관에 널리 분포되어 있으며 산소와 영양물질의 수송, 면역세포의 운송 및 원조직 노폐물을 제거하는 중요한 관이다. 현재 내피세포(ECs) 대사가 혈관 생성을 촉진하는 중요한 요인으로 알려져 있으며, Ecs의 서로 다른 대사 경로, 예를 들어 해당, 지방산 산화, 글루타민 대사 등은 혈관의 형성 과정에서 중요한 역할을 하였다. 연구 결과, 해당 과정에서 중요한 속도제한 효소인 phosphofructokinase-2/fructose-2, 6-bisphosphatase3, PFKFB3는 비교적 강력한 키나아제 활성을 가지고 있으며, 이를 억제 시 해당을 현저히 감소시켜 병리적 혈관의 생성을 억제할 수 있다는 것을 발견했다. ECs는 또한 혈관 분비 신호 전달을 통해 조직의 안정과 재생을 촉진시키지만, EC가 대사성 혈관 내분비 크로스토크에 관여하여 국소부위 허혈로 유도된 근육 재생을 제어할 수 있는지는 분명하지 않다.
최근에 취리히연방공과대학의 Katrien De Bock 팀(제1저자 장징(張靜))은 Cell Metabolism 저널에 "Endothelial Lactate Controls Muscle Regeneration from Ischemia by Inducing M2-like Macrophage Polarization"이라는 글을 통해 내피세포가 젖산 분비를 통해 대식세포의 분극을 유도함으로써 혈관의 재생과 근육 재생을 촉진한다는 것을 밝혀냈고 근육 내에 제2종 유산 셔틀 메커니즘, 즉 내피에서 대식세포로 가는 제2의 젖산 셔틀 메커니즘이 존재한다는 것을 증명했다.

대식세포는 골격근 재생에서 중요한 역할을 한다. 연구진은 해당 조절인자 pfkfb3가 내피세포(EC)의 특이성 결핍에서 허혈성 뒷다리가 손상된 혈관생성과 근육재생 능력을 완화할 수 있다는 사실을 밝혀냈다. 이는 대식세포가 혈관의 생성과 재생을 촉진하는 M2형 표현형 능력 저하에 의한 것이다. 내피세포 PFKFB3 특이성 녹아웃 마우스에서 M2형 분극손상과 허혈 후 근육의 손상 회복 기능의 상관성을 분석하기 위해 연구진은 뒷다리 허혈 3일 후 분극되지 않은 골수유래 대식세포 또는 M2형 대식세포를 마우스 뒷다리에 주사한 결과 M2형 대식세포가 내피세포 PFKFB3 특이성 녹아웃 마우스의 근육 복구를 현저하게 촉진한다는 사실을 발견하였으나 단, 대조군 수준에 완전히 도달하지는 못하였다. 이는 내피세포 PFKFB3가 녹아웃된 후 허혈 뒤의 근육조직 회복에 미치는 영향이 일부 M2형 대식세포 분극 조절을 통해 작용하였다는 것을 설명한다.
EC가 혈관 분비 메커니즘을 이용하여 대식세포 분극에 영향을 주는지 연구하기 위해 연구진은 야생형 마우스의 내피세포와 PFKFB3 녹아웃 마우스의 내피세포를 분리하여 BMDMs와 공배양한 결과 야생형 마우스의 내피세포가 BMDMs를 M2형 대식세포로의 분화를 현저히 촉진한다는 사실을 밝혀냈다. 흥미로운 것은 mECs-CM(조건부 배양기)으로 진행되는 BMDM 자극이 전통 IL-4 매개의 M2 분극을 완전히 요약할 수 없다는 점이다. mEC의 CM에서 대사 노폐물을 제거하면 M2형의 분극을 유도하는 능력이 약해진다. 정상적인 내피세포와 PFKFB3 녹아웃 내피세포 유래 배양기의 세포인자(cytokine)와 대사산물을 분석한 결과 내피세포에서 PFKFB3를 녹아웃 후 세포인자에 현저한 변화가 없는 반면 젖산 분비는 현저히 저하된 것으로 발견했다. 또한 생리농도 젖산을 보충한 후 PFKFB3 녹아웃 내피세포 유래 배양기는 M2형 대식세포의 분극능력을 증진시켰다. 주목할 점은 젖산이 대식세포의 분극을 제어하는 능력은 조건부 배양기를 필요로 하며, 이는 기능성 분극에 기타 세포인자나 대사물의 존재를 필요로 한다는 것을 표명한다.
연구진은 더 나아가 분화된 대식세포 배양기를 수집하였으며 PFKFB3 녹아웃 내피가 유도한 대식세포 배양기에서 더 많은 VEGF를 분비한다는 것을 발견했다. M2형 대식세포 분극 촉진(M2형 대식세포 이식을 통하여 젖산수준을 전이 또는 증가)을 통해 내피세포 PFKFB3 특이성 녹아웃 마우스의 근육 중 VEGF 수준을 회복시킬 경우 후자에 젖산 사용 후 야생형 마우스의 수준에 미치지 못하나 혈관밀도를 높일 수 있다. 이는 관찰된 혈관생성 결함(최소 허혈성 근육에서)이 PFKFB3의 내피이전/증식에 대한 직접적인 억제 작용과 근육의 미세환경이 혈관생성 자극을 감소시키는 조합이라는 것을 표명한다.
모노 카복실레이트 수송체1(MCT1)은 젖산의 중요한 운반체이며 내피세포 유래 젖산이 대식세포의 분극을 촉진하는 분자 메커니즘을 연구하기 위해 연구진은 대식세포 MCT1 특이성 녹아웃 마우스(Cyagen 제작)를 이용하여 가일층 연구하였다. 그 결과 하지 허혈 조건에서 대식세포 MCT1 녹아웃이 M2형 대식세포의 분화를 억제하는 동시에 근육조직 VEGF의 분비를 떨어뜨리는 것을 발견했다. 병리학적 분석에서 MCT1 녹아웃은 혈관의 신생과 근육조직 재생을 억제한다는 것을 발견했다. 방사성표기실험에서 대식세포가 MCT1을 젖산 운반체로 하여 내피 유래 젖산을 세포 안으로 전달하고, 기질로 대식세포 산화대사에 관여하는 것을 발견하였다. 저산소와 영양 부족 조건 하에서 대식세포의 기능을 위해 에너지를 공급한다.
결국, 이 연구는 내피세포가 독특한 대사 특징을 이용하여 허혈 기간 동안 젖산셔틀에서 대식세포의 혈관 분비 방식에 의존하여 근육 재생을 조절한다는 것을 증명하였다. 젖산이 유도하는 대식세포의 분극은 혈관생성과 근육재생을 촉진한다. 따라서 EC 특이성 pfkfb3의 상실은 근육의 젖산 수준을 저하시키고 허혈 후 근육 복구를 손상시킬 수 있다. 대사성 혈관 내분비 신호는 새로운 메커니즘을 제공하였으며, 이를 통해 EC는 조직의 안정적 상태와 재생을 촉진할 수 있다.
원문 검색:
Endothelial Lactate Controls Muscle Regeneration from Ischemia by Inducing M2-like Macrophage Polarization.
DOI: 10.1016/j.cmet.2020.05.004.
Cyagen은 15년 동안 전 세계 연구자들에게 서비스를 제공해 왔으며 제품 및 기술은 CNS(Cell, Nature, Science) 3대 저널을 포함하여 4,800건 이상의 논문에 인용되었다. 유전자 녹아웃, 유전자 녹인, 조건부 유전자 녹아웃 맞춤형 서비스를 제공하는 외에도 Cyagen은 전문적인 수술질환 모델팀이 있어 다양하고 세밀한 소동물 수술 질환모델을 제공할 수 있다; 약물 선별과 평가용 마우스 플랫폼은 구미 선도 기업으로부터 도입한 면역결핍 마우스, 심혈관 및 알츠하이머병 등의 연구에 사용되는 인간화 마우스를 제공할 수 있다; 국제 표준화 무균 마우스 기술 플랫폼은 무균마우스, 무균동물 맞춤형 서비스, 미생물균군 이식 서비스 등 무균동물 모델에 기반한 각종 제품과 서비스를 제공할 수 있으며 Cyagen의 성숙하고 안정적인 유전자 편집 마우스 플랫폼과 결합하여 균군과 유전자의 상호작용 메커니즘을 연구하는데 도움을 줄 수 있다.




영업일 기준 1-2일 내에 답변해 드리겠습니다.