


1817년 영국 내과 의사 제임스 파킨슨이 제일 먼저 파킨슨병을 발견해 그 증세에 대해 자세히 묘사했으며 그 발병률은 신경퇴행성 질환 중 두 번째로 높았다. 그 증상에 가장 잘 알려진 것은 불수의적 떨림(Involuntary Tremors), 즉 제어되지 않는 떨림을 뜻하는데 손에서 가장 뚜렷하게 나타난다. 또 하나의 중요한 특징은 균형 능력의 약화인데 노인에게는 한번의 넘어짐도 치명적일 수 있지만 주의해야 할 부분은 이러한 균형의 약화는 소뇌 손상과 무관하다. 균형 능력이 약화되면 동작의 균형을 유지하기 위해 환자의 동작 폭과 속도가 줄어들 수 밖에 없기 때문에 걷거나 다른 움직임을 할 때 행동이 느려진다. 또한 10%의 환자는 뻣뻣함을 느끼는데 이는 환자의 필기능력에 영향을 미치게 되며 글씨를 쓸 때 글자의 크기가 점차 작아지는 것도 PD의 임상 참고 근거가 될 수 있다. 질병 진행 과정에서 언어 능력과 삼킴 능력도 영향을 받을 수 있다.

그림 1. 파킨슨병의 주요 신경 기능 손상(https://www.froedtert.com/)
흑질(Substantia nigra,SN)에 있는 도파민 뉴런의 손상은 PD의 주요 병리학적 특징이며 또한 수많은 잔류 세포에서도 PD의 가장 중요한 병리학적 표지인 루이소체를 발견할 수 있다. 루이소체는 α-synuclein(알파 시누클레인)이 모여 만들어졌지만 일부 PD 환자의 SN에서는 α-synuclein이 검출되지 않았다.
흑질 영역은 이 영역에 도파민 뉴런이 응집되어 있기 때문에 명명되었으며 이 부위의 도파민 뉴런에는 뉴런 멜라닌이 풍부하기에 색이 비교적 짙다. 이 영역은 기저핵(basal ganglia,BG)의 일부에 속하며 기저핵은 중뇌의 하위 영역이다. 인간이나 설치류 동물의 대뇌 측면에서 볼 때 이 영역은 크기가 매우 작지만(주의, 그림 3의 녹색 부분은 중뇌 전체를 의미하며 흑질은 그 중 화살표가 가리키는 점선 부근에 불과하다.) 동물의 움직임에는 필수적이다. 도파민의 기능은 말할 것도 없고 SN은 작지만 두 개의 영역으로 나눌 수 있는데 흑질 치밀부(Substantia nigra pars compacta,SNc)와 흑질 망상부(Substantia nigra pars reticulata,SNr)이며 치밀부에는 많은 수의 도파민 뉴런이 포함되어 있다. SNr 영역은 BG 및 기타 뇌 영역의 입력 신호를 수신하고 처리하는데 SNc의 도파민 뉴런은 SNr에서 제공하는 정보를 기반으로 선조체(striatum)에 도파민을 제공하여 움직임을 조절한다. PD는 앞서 언급한 이 영역에서 도파민 뉴런이 사망하면서 생긴 도파민 분비가 부족해 시상이 제어에 관여하는 운동 과정에 장애가 발생한다.
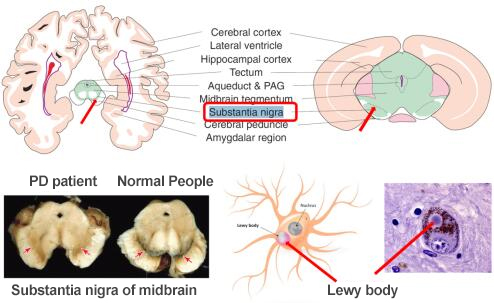
그림 2. PD 주요 병변의 위치 및 병리학적 특징
Source: Fundamental Neuroscience 2013;https://www.alztennessee.org
파킨슨 의사가 PD를 발견했을 때 오직 증상만 발견했었다. 이후의 연구에서는 해부를 통해 뇌 흑질에서의 병변이 PD 발병의 주범임을 밝혀냈고 20 세기에 들어서면서 질병을 유발하는 단백질의 응집으로 형성된 루이소체가 발견되었다. 제 2 차 세계 대전 이후 과학과 기술의 발전은 도파민 발견의 토대를 마련했다. 그리하여 도파민 유사체가 PD 치료에 사용되기 시작했고 도파민 기능을 향상시키는 것을 핵심 목적으로 하는 일부 약물은 성공한 것도 있고 실패한 것도 있었는데 비록 질병을 거스를 수는 없지만 이것들에 대한 연구를 통해 도파민이라는 중요한 신경전달물질에 대한 우리의 이해가 크게 늘었다.
물론 이러한 약물의 공통점은 일정 기간 사용하면 효과가 크게 떨어지고 부작용이 뚜렷하다는 것이다. 이에 따라 루이소체와 루이소체를 구성하는 알파시누클레인(α-synuclein) n에 대한 다양한 치료 방안을 개발했는데 주로 세 가지로 나뉜다: 1. 시냅스와 단백질 확산을 차단하는 면역 요법 2. 시누클레인 응집 억제 3. 시누클레인 분해 및 제거를 증가시킨다. 그러나 현재 효과적인 약물을 생산할 수 있는 방법은 없다. 또, 뇌에는 여러 가지 신호 통로 사이에 복잡하게 연관되어 있고 이를 기반으로 미토콘드리아, 소포체, 자가 포식 및 칼슘 이온 신호 전달을 위한 다양한 약물 개발 프로그램이 수행되었다.
유전자 치료는 주로 비활성화 된 바이러스 벡터를 사용하여 신경 영양 인자 또는 기타 중요한 단백질 유전자를 포장하며 해당 단백질을 발현하여 도파민 합성의 회복을 촉진하고 glial cell line-derived neurotrophic factors(GDNF)와 neurturin(NRTN)과 같은 도파민의 대사를 조절하지만 동물 실험의 좋은 결과는 임상 실험에서 잘 재현되지 않았다. 그러나 계속해서 시도되고 있는 유전자 치료의 다른 계획이 여전히 진행중이다.
요컨대, 현재 FDA에서 승인한 대부분의 PD 약물은 여전히도파민 기능 조절에 초점을 맞추고 있고 파킨슨병은 실제로 대부분의 경우 파킨슨 증후군이기 때문에 운동 기반 증상 외에도 파킨슨병으로 인한 다른 신경 문제는 무시할 수 없다.
PD의 치료에는 특수한 뇌심부자극술(Deep Brain Stimulation, DBS) 요법이 있는데 뇌에 전극을 삽입해 해당 뇌 부위의 활동을 자극해 증상을 완화하는 효과가 있지만 이 방법은 특정 PD에게만 효과가 있으므로 일반인은 약물 치료를 우선적으로 선택해야 한다. 하지만 기술이 발전할수록 이런 치료 방안의 효과가 점차 좋아지고 있기 때문에 환자에게 점차 환영받고 있다. 그러나 그 비용은 여전히 상대적으로 비싸고, 효과도 증상 개선에만 국한되었으며 치료 효과도 병의 진행에 따라 점차 상실되기 때문에 병의 원인에 대한 약물과 치료법을 개발하는 것이 여전히 PD 치료의 최우선 과제이다.
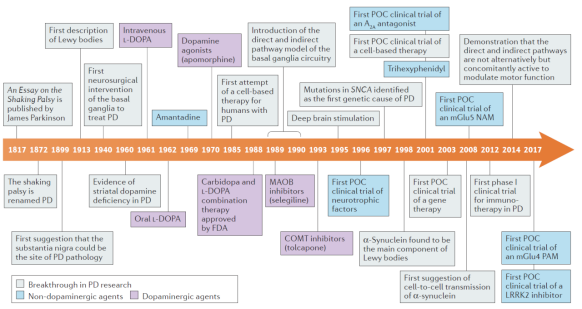
그림 3. PD 치료 방법의 발전 과정
Source: 10.1038/nrd.2018.136
PD의 메커니즘을 연구하기 위해서는 PD의 동물 모델이 필수적인데 먼저 유전자 편집 방법으로 만든 PD 모델을 소개한다. 알파-시누 클레인은 가장 직접적인 PD 질병 단백질이므로 그것의 유전자 변형 마우스도 가장 먼저 개발된 것이고 해당 유전자는 SNCA라고도 하며 Park1이라고도 한다. 가족성 PD에서 Park1의 세 가지 돌연변이(A30P, A53T 및 E46K)와 이 유전자의 카피 수의 비정상적인 증가는 PD를 유발하고 위에서 언급한 PD의 원인을 위해 만들어진 유전자 변형 마우스는 실험에 널리 사용되었으며 인간 돌연변이 α-synuclein을 발현하는 일부 마우스는 선조체에서 도파민이 상당 부분 감소되었는 바 루이소체의 전구체인 봉입체와 유사한 품종도 있고 PD 증세도 보였다. 다만 α-synuclein에 대한 거의 모든 유전자 편집 마우스에서 뚜렷한 흑질 뉴런 사망이 발생하지 않았다는 점이 아쉽다.
LRRK2는 자가포식과 관련된 유전자로 후기발병 PD와 관련이 있지만 현재 이 유전자만을 조작하는 유전자 편집 동물은 PD 표현형을 얻기가 어렵다. 과발현, 녹아웃, 녹인에 관계없이 효과는 크지 않으며 마우스와 랫드에게도 마찬가지다. LRRK2 녹아웃 마우스는 루이소체를 생성하지 않지만 α-synuclein의 응집을 어느 정도 유발하며 일부 품종은 운동 장애를 나타낼 수도 있다.
PINK1은 또 다른 후기발병 PD 관련 유전자이지만 PINK1 녹아웃 마우스의 SNc에서 시누클레인이 과발현되면 해당 영역에서 많은 수의 도파민 뉴런이 사망하게 된다. 반면에 PINK1 유전자가 직접 녹아웃되면 선조체의 도파민은 감소하지만 도파민 뉴런은 사망하지 않는다. E3 연결효소PARKIN이 마우스에서 녹아웃 된 후 일부 마우스에서 도파민 발현이 약간 감소한 것 외에는 변화가 없었다.
DJ-1은 초기 발병 PD와 관련하고 대부분의 변형된 마우스는 인간에서 PD 표현형을 재현할 수 없지만 C57을 배경으로 하는 DJ-1 녹아웃 마우스에서 연구원들은 상당한 조기 발병 SNc 도파민 뉴런 손실을 발견했는데 이러한 변화는 나이가 들어감에 따라 증가할 것이며 경미한 운동 장애가 있을 것이다. 마우스의 표현형이 반복될 수만 있다면, 이 품종은 PD 연구에서 추천할 가치가 있는 모델이 될 수도 있다. ATP13A2는 리소좀 관련 ATPase로 이 유전자에 대한 연구는 적지만 PD 연구의 유망주이기도 한다.
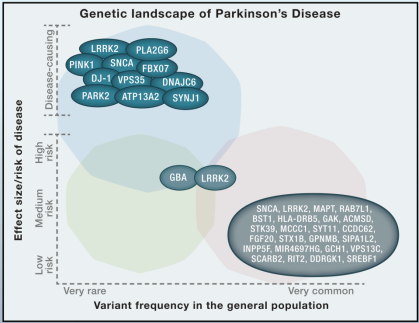
그림 4. PD 모델 관련 유전자
Source: 10.1016/j.cell.2015.01.019
가족성 파킨슨병과 관련된 유전자는 아주 많은데 Cyagen은 이러한 중요한 유전자에 대한 일련의 관련 질환 모델을 개발했고 이 중 절반 이상의 PD 동물 모델은 Cyagen AI Knock-Out Mouse Model eBank에 Live Mouse로 보존되어 있으며 Cyagen의 연구 개발팀은 새로운 유전자 편집 동물의 연구 및 개발에도 주력하고 있다.
1990년부터 2018년까지의 PD 연구 통계에 따르면 현재 발표된 논문의 85%는 마우스와 랫드가 차지한다. 마우스는 상대적으로 간단한 초기 유전자 편집으로 인해 빠른 발전이 이루어졌다. 그러나 최근 몇 년 동안 유전자 편집 기술 Crispr의 광범위한 적용과 성숙됨에 따라 PD의 유전자 편집 랫드 모델도 비약적으로 발전되고 있다.
PD의 유전자 편집 모델은 일반적으로 뚜렷한 표현형을 가지고 있지 않지만 이 모델들을 우리의 연구 분야 관련 유전자 돌연변이나 기능 이상 모델과 교잡시킬 수 있다. 이러한 새로운 유전자의 도입은 PD의 다양한 표현형에도 영향을 미치게 되는데 이는 PD 기능 및 치료에 대한 연구에 도움을 제공한다. Cyagen도 연구원들이 새로운 모델을 개발하는 데에 도움을 주고 있다.
|
PD Related Gene Editing Model |
||||
|
Animal Model |
Motor-Deficit |
Loss of Nigral Neurons |
Loss of Striatal Dopamine |
Lewy Body |
|
a-Synuclein |
Behavioral abnormalities (increased or decreased locomotion) |
▲ (Confiction reported) |
▲ |
YES (In aged animals) |
|
LRKK2 |
Minor behavioral abnormalities |
NO |
NO |
NO |
|
PINK1 |
No significant abnormalities |
NO |
NO |
NO |
|
PARKIN |
No significant loss of activity |
NO |
▲ |
NO |
|
DJ-1 |
Decreased activity |
NO |
NO |
NO |
|
ATP13A2 |
Late onset sensorimotor disorder |
NO |
NO |
NO |
|
▲mild decrease ▲▲moderate decrease ▲▲▲severe decrease |
|
|
||
그림 5. PD 모델 관련 표현형
가족성 PD와 관련된 많은 유전자가 있다. Cyagen은 병리와 관련된 이러한 중요한 유전자에 대한 일련의 PD 모델을 개발했으며 다음 표에서 원하는 모델을 찾을 수 있다.
전략 설계부터 연구용 맞춤형 모델 제공에 이르기까지 Cyagen은 모든 동물 모델 요구 사항에 대한 완전한 아웃소싱을 제공합니다.
짧은 시간에 심각한 PD 표현형을 유도할 수 있기 때문에 앞서 언급했듯이 화학적 유도는 PD 모델링에서 중요한 위치를 차지하고 있다. 하지만 화학적으로 유도하는 PD 모델이 부족한 것도 분명한 사실이고 이는 도파민 뉴런의 사망 속도가 너무 빠르다는 것을 의미한다. 정상인류에서 도파민 뉴런의 사망 과정부터 PD의 발병까지 보통 10년 이상 걸리는데 화학적으로 유도된 뉴런의 사망은 며칠 내에 인류가 수십 년 동안 사망하는 뉴런의 수에 이르게 된다. 또한 뉴런과 도파민 결핍이 가장 심한 이들 모델에서는 루이소체가 나타나지 않았다.
MPTP는 PD 모델을 제작하는 데에 사용되는 최초의 화학 독성 물질로써 흥미로운 것은 MPTP는 비인간 영장류(NHP)와 마우스에게는 독성이 매우 강하지만 랫드에게는 독성이 별로 없다. 비인간 영장류 또는 마우스 실험에서 MPTP는 심각한 흑질 뉴런 손실과 선조체 도파민 감소를 유발할 수 있는데 위에서 언급한 손상은 PD의 병리학적 표현형에 대한 매우 좋은 시뮬레이션이지만 이 물질은 루이소체의 생성을 유도할 수 없다.
MPTP와 비교했을 때 6-OHDA로 랫드 PD 모델을 제작할 수 있다. 그러나 6-OHDA는 혈액뇌장벽을 통과할 수 없으므로 대부분의 경우 뇌에 직접 주입된다. 이 약물은 주사 후 2~3 일 내에 많은 수의 뉴런을 죽게 하여 NAc 영역의 도파민을 90% 이상 감소시킨다. MPTP와 마찬가지로 이 약물은 도파민 뉴런에 특별한 효과를 가지고 다른 유형의 뉴런은 덜 손상되지만 6-OHDA는 루이소체의 생성을 유도하지 않는다.
rotenone(로테논)을 오래 사용하면 랫드의 흑질 줄무늬체 도파민을 감소시킬 수 있고 또 인간 PD와 유사한 여러 가지 증상을 유발시킬 수 있는데 더 중요한 것은 로테논은 뉴런을 유도하여 루이소체가 될 가능성이 있는 초기 알파-시누 클레인 중합체를 생성할 수 있다.
Paraquat(파라콰트)는 PD의 일부 운동 증상을 유발할 수 있을 뿐만 아니라 흑질 도파민 뉴런과 선조체 도파민에 대한 억제 효과도 있으며 루이소체의 형성도 유도할 수 있다.
이 밖에 METH(methampetamine)와 MDMA(methylenedioxymethampetamine)도 PD의 화학 모델링에 많이 쓰이는 물질이다.
|
Chemical Induced PD Model |
||||
|
Animal Model |
Motor-Deficit |
Loss of Nigral Neurons |
Loss of Striatal Dopamine |
Lewy Body |
|
MPTP Mice |
Decreased activity and slow movement |
▲▲▲ |
▲▲▲ |
NO |
|
MPTP Monkeys |
Decreased activity, altered behavior, trembling, stiffness |
▲▲▲ |
▲▲▲ |
NO |
|
6-OHDA rat |
Decreased activity and altered behavior |
▲▲▲ |
▲▲▲ |
NO |
|
Rotenone |
Decreased motility |
▲▲ |
▲▲▲ |
YES |
|
Paraquat/ma neb |
Decreased activity |
▲▲ |
▲▲▲ |
YES |
|
MET/MDMA |
Decreased activity |
▲▲ |
▲▲▲ |
NO |
|
▲mild decrease ▲▲moderate decrease ▲▲▲severe decrease |
||||
그림 6. 화학 유도PD 마우스 모델 (Tara Spires-Jones and Shira Knafo, 2012)
운동 능력에 사용되는 테스트는 일반적으로 PD 검출에 사용될 수 있으며 그림 8은 운동 테스트에서 자주 사용되는 테스트 방법을 보여준다.
첫째는 Cylindrical barrel 테스트인데, 이 테스트에서 마우스는 투명한 원통 속에 넣여져 있고 마우스는 앞발을 통해 통벽에 닿아 탐색한다. 벽에 닿을 때의 자세, 앞다리 선호성 및 서 있을 때의 시간 등을 통해 운동과 균형 능력을 테스트한다.
다음은 사육 케이지나 특수 실험 시설에 넣을 수 있는 자율 운동 롤러인데 동물의 능동운동의 초기 운동 상태와 전체 과정을 감지할 수 있으며, 롤러의 속도를 통해 동물의 운동 기능을 연구할 수 있다.
회전식 유량계는 일반적으로 정신적 또는 스포츠 자극제를 사용한 후 동물의 rotation bias를 측정하여 외측병변의 정도와 후속 개입 치료의 유효성을 평가한다.
롤링 시설의 회전봉은 고정되거나 가속하는 속도로 회전할 수 있는 대들보의 일종이다. 마우스는 중간 회전봉에 놓여 있으며 떨어지는 잠복기를 통해 이들의 운동 협응을 측정할 수 있다.
평균대 테스트에서 마우스가 대들보 위에 얹힌 것은 대들보 위에서 이동하는 능력을 보여주는 것으로 여겨진다. 마우스 발톱의 sideslips 횟수와 시간은 발의 힘과 운동 협응을 나타내는 데 사용된다.
걸음걸이 측정기를 사용하거나 마우스의 발톱에 잉크나 페인트를 묻히면 복도를 따라 목표 박스를 향해 달려가면서 발자국을 남기게 된다. 보폭, 바닥 너비, 앞발과 뒷발의 겹침을 측정하면 걸음걸이를 알 수 있다.
이러한 실험에서 롤링 시설은 의심할 여지없이 PD 연구에서 가장 광범위하고 간편하게 적용되고 있다는 것을 증명하며 AD 연구에서 수중 미로를 응용한 셈이다.
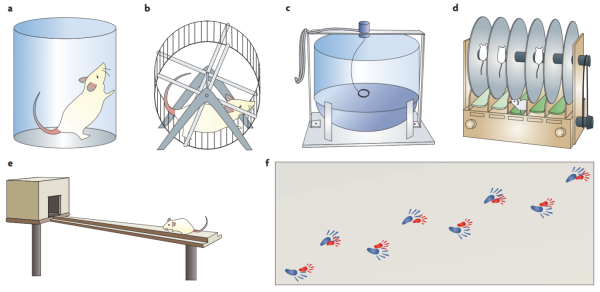
그림 7. PD 관련 행동학적 연구 방법 (Tara Spires-Jones and Shira Knafo, 2012)
파킨슨병의 주요 병소는 중뇌의 흑질 치밀부에서 도파민 뉴런의 사망인데 이는 해당 영역에서 부족한 도파민 분비가 발생하게 하여 하류 선조체의 정상적인 기능에 영향을 미치게 된다. 따라서 PD의 영상학적 연구는 주로 중뇌의 흑질과 선조체에 집중되어 있다. 도파민 발현 및 분비 수준과 이 두 뇌 영역 사이의 투영 관계가 매끄러운지 여부는 PD 병리의 주요 지표가 되었다. 마우스와 랫드는 인간과의 유전적 유사성이 90% 이상에 달한다. 비용과 실험 주기를 고려할 때 마우스와 랫드는 여전히 PD 연구 모델의 핵심 부분이고 이 두 동물의 뇌 영역 투영 관계는 인간과 매우 유사하다.
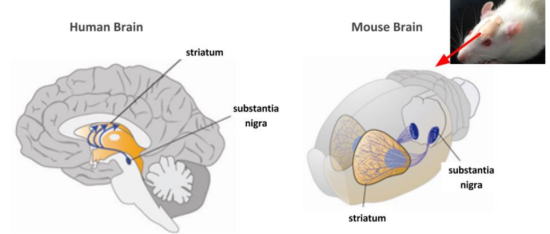
그림 8. PD (거시적)의 주요 병리학적 특징
Source: Somayaji. M & Sulzer. D 2017
PD 환자의 뇌 해부에서 중뇌 흑질 치밀부의 검은 뉴런이 감소되었음을 분명히 보아낼수 있고 이런 도파민 뉴런이 사라지면서 기존 뉴런 대신 교질세포가 대량 증식했다. 같은 나이의 대조군보다 PD 환자에서 이 영역에 30%-60% 더 적은 도파민 뉴런이 발견되었다. 우리가 세포속으로 관심을 돌린다면 루이소체는 PD의 가장 중요한 특징이며 그림 9A-C의 흑질 치밀부에서는 세포 안에 가득 찬 검은색 루이소체를 볼 수 있는데 그림 9D의 전두엽 부분에서도 루이소체가 나타나지만 흑질 치밀부가 더 심각하고 세포 속의 루이소체도 더 작으며 구멍이 수반된다. 그러나 마우스 모델에서 루이소체를 시뮬레이션하는 것은 매우 어렵다. 따라서 현재 동물 실험에서 우리는 일반적으로 알파-시누클레인의 응집만 검출되면 PD의 질병 모델로 간주될 수 있다.
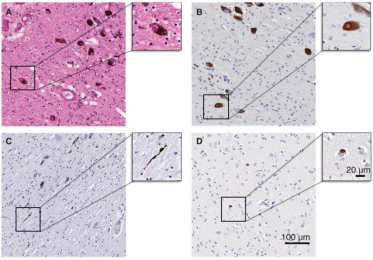
그림 9. PD의 주요 병리학적 특징 (Parkinson 's Disease Pathogenesis and Clinical Aspects, 2018)
PD 신호전달경로에는 미토콘드리아 완전성 파괴와 단백질 이소성이 있는데 후자는 유비퀴틴-프로테아좀 시스템(UPS) 기능 및 자가 포식 매개 분해 경로의 변화로 인해 비정상화 된다.
유전적 원인에 따르면 산화 환원 스트레스, 에너지 결핍, 단백질 응집이 미토콘드리아 DNA에 의해 유발된 염증 등 요소와의 결합은 세포 대사 산물의 점진적인 축적을 유발하며 결국 세포 사멸로 이어지는데 손상된 도파민 시스템 경로와 일부 감각 뉴런(예: 후각)의 손실로 나타난다.
알파-핵단백질의 돌연변이 또는 SNCA의 과발현은 소포의 응집 및 융합을 방해할 수 있어 소포체(ER)에서 골지체까지 수송통로가 파괴되었다. 유사한 돌연변이는 또한 시냅스 소포의 방출을 방해 할 수도 있다. SNCA는 접힘이 없는 단백질로써 그것의 돌연변이체가 쉽게 응집된다. SNCA는 다른 단백질을 폴리머로 끌어들이고 폴리머와 유비퀴틴화 된 화물 단백질을 커버할 수 있다. 이들 모두는 파킨을 포함한 기능적 E3 유비퀴틴 연결효소를 필요로 한다.
Parkin, UCHL1과 SNCA의 돌연변이는 모두 유비퀴틴 프로테아좀 시스템(UPS)을 방해하며 스트레스 반응을 일으키고 뉴런의 사멸을 일으킬 수 있다. 일반적으로 프로테아좀의 기능 장애는 보통 다른 세포 회복 메커니즘을 일으킬 수 있다. 예를 들어 샤페론 매개 자가 포식(chaperone-mediated autophagy, CMA)이 활성화되면서 비정상적인 단백질을 LAMP2a 수용체를 통해 리소좀으로 이동한다. 그러나 돌연변이된 SNCA 또는 기능 획득성 돌연변이가 일으키는 LRRK2와 같은 단백질은 CMA 기능 장애를 유발할 수 있기에 이러한 회복 과정을 완수할 수 없다.
일부 돌연변이된 LRRK2는 또한 미토콘드리아의 병리학적 변화를 유발하여 미토콘드리아의 분해를 증가시킬 수 있다. 이 과정은 미토콘드리아의 생존을 유지하는 중요한 단백질을 유비퀴틴화한다. 이 과정에서 Pink1은 Parkin과 결합하며 Parkin은 손상된 미토콘드리아 단편의 주외막단백질의 유비퀴틴화 과정에 더욱 관여하게 된다. 이러한 중요한 막단백질의 유비퀴틴화는 결국 미토콘드리아의 분해를 촉진한다. 동시에 LRRK2는 미토콘드리아의 분열/융합의 조절인자이기도 하다.
과도한 분열과 미토콘드리아 기능 장애는 모두 ROS의 증가와 관련이 있다 .DJ-1은 미토콘드리아에서 산화 환원 센서 및 항산화제 역할을 하는데 미토콘드리아 에너지 균형와 산화 환원 항상성을 유지하는 데 도움이 된다. 산발적 파킨슨병과 관련된 다른 돌연변이에는 많은 리소좀 관련 효소, 글루코 세라미다제(GBA1)-갈락토시다제 A(GLA), 스핑고미엘포스포디에스테라제1 (SMPD1 및 Niemann Pick disease type 1 (NPC1))이 포함된다. 그것들은 모두 리소좀 관련 질병과 관련이 있다. 아래 그림에 표시된 PD 관련 유전자 중 흰색 배경은 열성, 빨간색 배경은 우성, 회색 배경은 PD 위험 유전자를 나타낸다.
위 경로의 변화는 PD 연구에서 중요한 표현형 검사 항목이며 종종 실험의 인과 관계를 검증하는 데 사용된다.
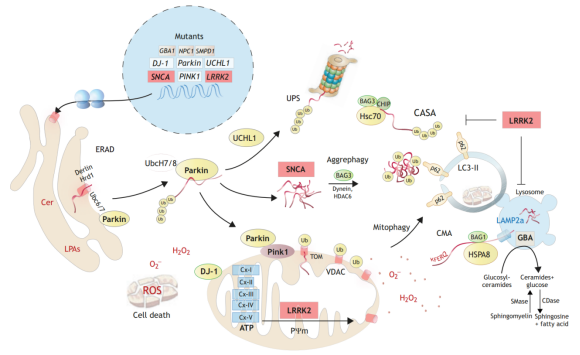
그림 10. PD 신호전달경로
Source: 10.1242/dmm.039396
>> 신경 퇴행성 질환 연구를 위한 One-Stop 솔루션
전략 설계부터 연구용 맞춤형 모델 제공에 이르기까지 Cyagen은 모든 동물 모델 요구 사항에 대한 완전한 아웃소싱을 제공한다. 유전자형 검증이 보장된 맞춤형 마우스 또는 랫드 모델을 만들 수 있으며, 신경 퇴행성 질환 연구에 필요한 표현형 특성화 및 기타 다운스트림 서비스를 제공할 수도 있다.
| 유전자 조작 Mouse/Rat 모델 | Knock-Out, Knock-In, Conditional Knock-Out, Point mutation, and more |
| 즉시 사용가능한 KO/cKO 마우스 모델 | ● Over 16,000 custom KO and cKO/floxed strains ● 3,000 live mice are available to researchers in as few as 2 weeks |
| 약물 평가 질환모델 | Metabolic models, CDX models, Immunodeficient mice, Humanized immune checkpoint mice, and more |
| 맞춤형 Cell Line 서비스 | Knock-Out, Knock-In, Overexpression, Point mutations |
| 줄기세포 | Neural stem cells, and other |
모델 제작 전략을 요청하려면 프로젝트 세부 정보를 제출하여 연락 부탁드립니다.
Cyagen은 고객의 요구를 충족하기 위해 고도로 맞춤화된 표현형 분석 및 추가 서비스를 제공할 수 있습니다.
| 연구 모델 지원 서비스 | ● 벡터 구축 ● 바이러스 패키징 ● 사육 또는 냉동보존 ● 수술 & 질환 모델 동물 서비스 |
| Rat/Mouse 표현형 분석 ● 초음파 분석 ● 생리 생화학 분석 ● 병리학적 분석 ● 대사 분석 ● 유전자 및 단백질 발현 분석 ● 세포 기능 검사 |
표현형 분석 서비스를 요청하려면 프로젝트 세부 정보를 제출하여 연락 부탁드립니다.




영업일 기준 1-2일 내에 답변해 드리겠습니다.