

일상생활에서 포옹은 사람들이 사랑과 호의를 표현하는 방법입니다. 하지만 수포성 표피박리증(Epidermolysis Bullosa, EB) 환자에게는 이런 간단하고 친밀한 행동은 엄청난 고통을 유발할 수 있습니다. EB는 가장 고통스러운 인간 질환 중 하나로 알려져 피부가 연약하고 물집이 생기는 유전성 희귀 피부 질환입니다. DEB 환자의 피부는 나비의 날개처럼 연약하여 살짝만 건드려도 나비 날개의 비늘 가루처럼 벗겨져 심각한 전신 합병증을 유발할 수 있습니다. 그래서 EB 환자들을 '나비 아이들'이라고 부르기도 합니다. 2023년 5월부터 Vyjuvek에 대한 FDA 승인으로, EB와 그 중증 아형(subtype)인 이영양성 수포성 표피박리증(Dystrophic Epidermolysis Bullosa, DEB)과 같은 질환에 대한 효과적인 유전자 치료법이 나타나기 시작되었음을 의미합니다.
효과적인 유전자 치료제를 개발하기 위한 전임상 연구를 지원하기 위해, Cyagen에서 독자적으로 개발한 이영양성 수포성 표피박리증(Dystrophic Epidermolysis Bullosa, DEB) 연구 모델을 소개합니다.
이영양성 수포성 표피박리증(DEB)의 발병 기전
이영양성 수포성 표피박리증(DEB)은 수포성 표피 박리증(EB)의 심각한 주요 아형(subtype)으로, 전체 EB 사례의 약 25%를 차지합니다. 피부는 인간의 신체 표면을 덮고 있으며, 가장 바깥쪽부터 안쪽으로 표피, 진피, 피하층으로 구성되어 있습니다. DEB는 VII 콜라겐(collagen)을 코딩하는 유전자 COL7A1의 돌연변이로 인해 발생합니다. VII 콜라겐(collagen)이라는 단백질은 진피와 표피를 서로 결합하는 고정원섬유(anchoring fibril, AF)의 형성과 밀접한 관련이 있습니다[1-2].
DEB는 우성 이영양성 수포성 표피박리증(Dominant Dystrophic Epidermolysis Bullosa, DDEB)과 열성 이영양성 수포성 표피박리증(Recessive Dystrophic Epidermolysis Bullosa, RDEB)의 두 가지 유전적 패턴이 있습니다. 일반적으로 RDEB가 DDEB보다 더 심각합니다. RDEB의 증상으로는 약한 피부, 광범위한 상처, 그리고 입, 눈, 위장관 및 비뇨생식계에 영향을 미치는 피부외(extracutaneous) 증상이 있습니다. RDEB 환자는 90% 이상의 확률로 평생 동안 공격적인 편평상피세포암(Squamous cell carcinoma)에 걸릴 위험이 있습니다[1-2]. 따라서 RDEB는 신생아기에 시작되는 경우가 많으며, 환자는 종종 감염으로 인해 사망합니다.
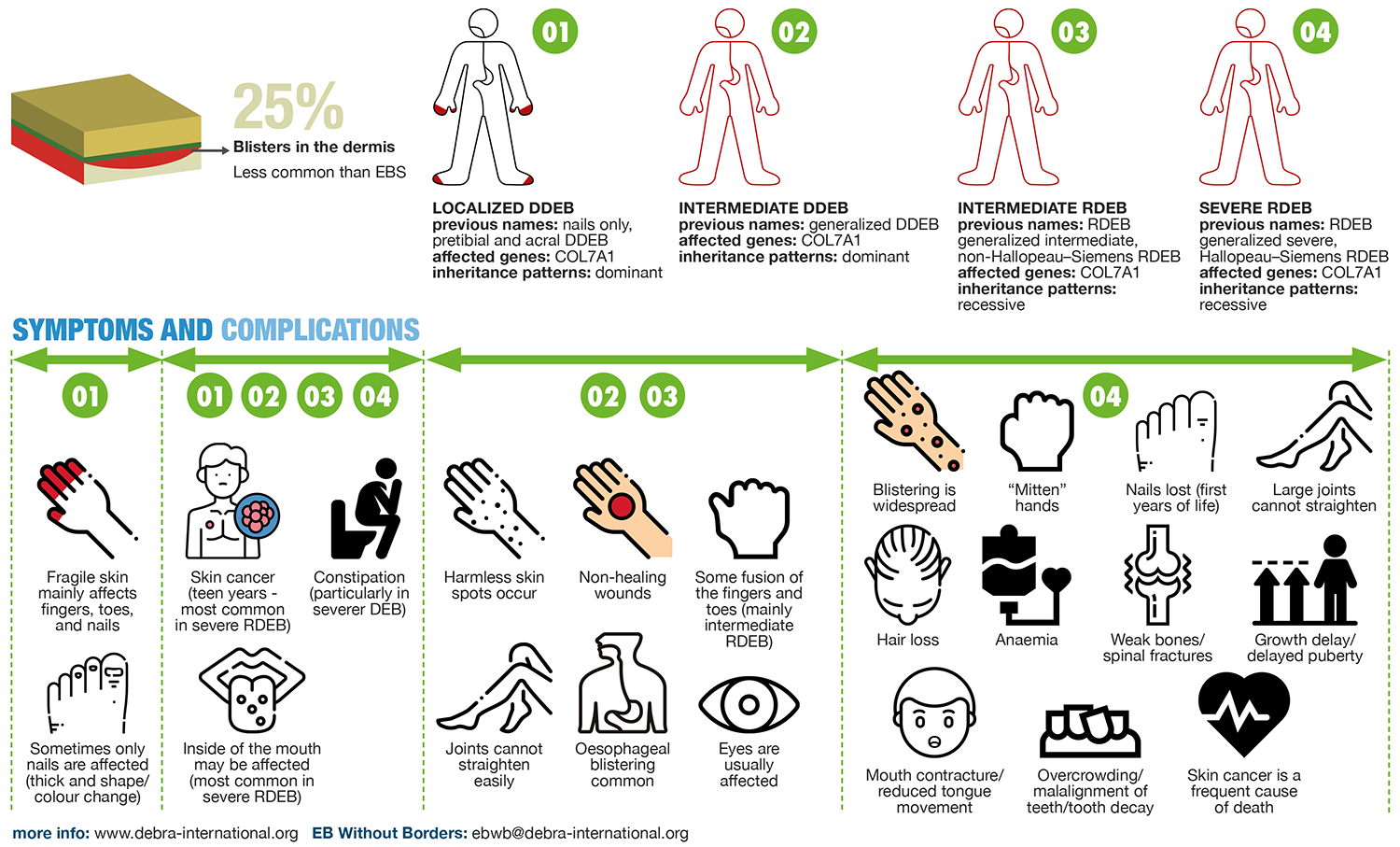
그림 1: 이영양성 수포성 표피박리증(DEB)의 병리기전, 분류, 영향 부위 및 증상 [2]
DEB 치료법 및 관련 마우스 모델의 개발
DEB 치료에 대한 연구는 주로 COL7A1 유전자 돌연변이를 교정하거나 유전자 사본(copy)을 보완하는 데 중점을 두고 있습니다[3]. 여기에는 CRISPR과 같은 유전자 편집 기술을 사용하여 COL7A1 돌연변이를 복구하고,[4-6] 안티센스 올리고뉴클레오티드(Antisense oligonucleotide, ASO)로 COL7A1 splicing 패턴을 조절하고,[7] AAV 또는 HSV-1과 같은 벡터를 통해 COL7A1 유전자 사본(copy)을 전달하는 치료법이 포함됩니다.[8-9] 이러한 치료법에 대한 연구는 동물 모델에서 초기 검증 실험을 거쳐야 합니다.
RDEB는 인체에서 COL7A1의 homozygous 돌연변이에 의해 발생하며, 마우스 모델에서도 유사한 병리기전이 관찰됩니다. 예를 들어, Col7a1 homozygous knockout 마우스 모델은 출생 후 높은 사망률을 보이며, 24~48시간 이내에 발바닥에 출혈성 수포와 물집이 생기고 심각한 RDEB 증상이 나타납니다.[10] 이 knockout 마우스 모델은 RDEB 보충 요법의 전임상 시험에 흔히 사용됩니다.
그러나 유전자 편집 및 안티센스 올리고뉴클레오티드(ASO) 연구 분야에서는 인간화 유전자 서열을 정확하게 타겟팅할 수 있는 적합한 마우스 모델이 없습니다. 이는 현재 유전자 치료 연구 분야가 직면하고 있는 주요 과제 중 하나입니다.
유전자 치료 관련 in vivo 연구에서는 인간화된 유전자 서열을 정확하게 타겟팅할 수 있는 능력을 요구하며, 이는 전장 게놈 DNA 인간화 마우스 모델의 필요성을 제시합니다. 이러한 연구 모델은 마우스에서 인간의 유전자 발현 패턴, 조절 및 기능적 특성을 정확히 재현할 수 있습니다.
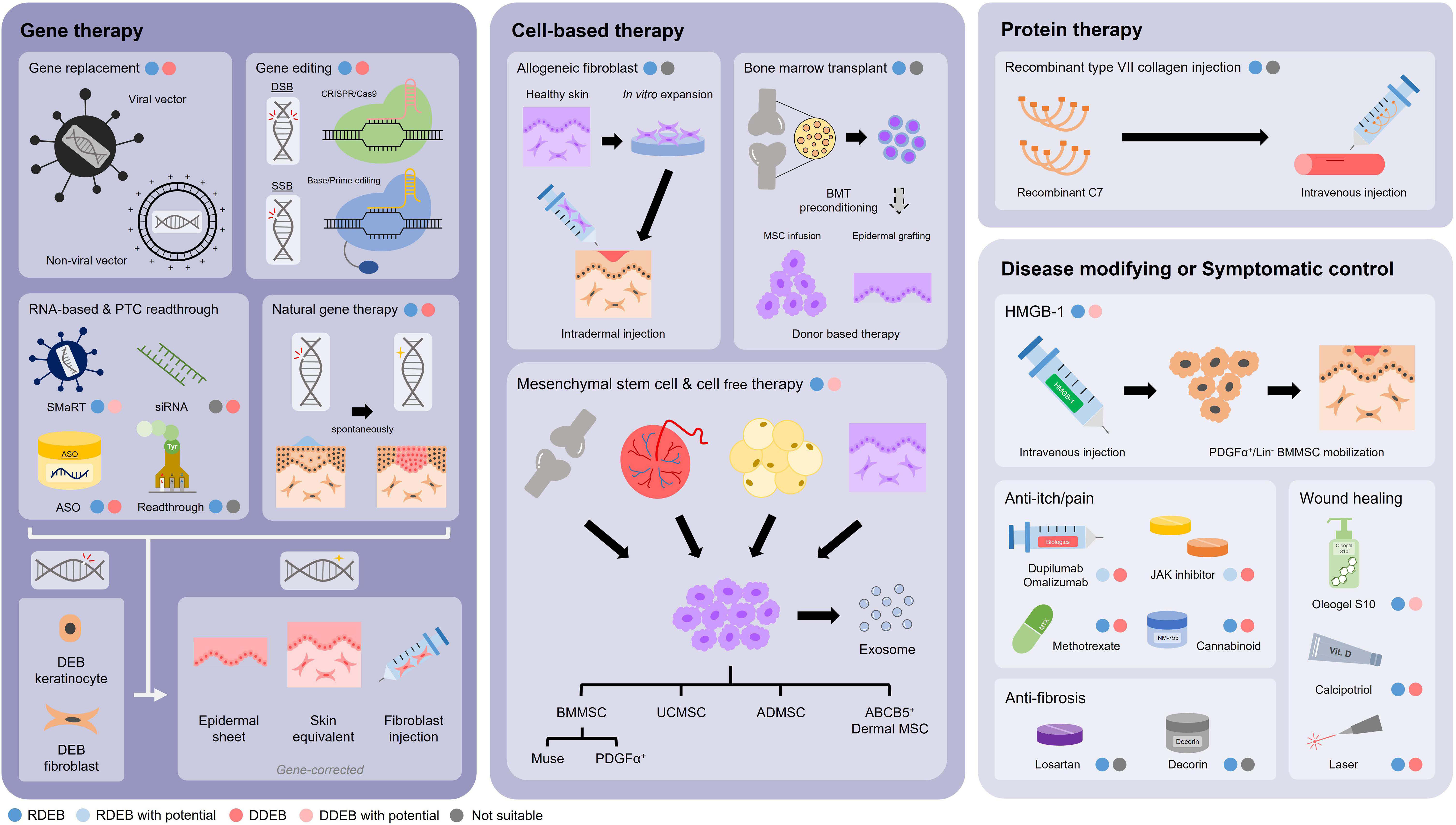
그림 2: 이영양성 수포성 표피박리증 (DEB) 치료 전략 연구[3]
Cyagen의 HUGO-GT™ 차세대 인간화 마우스 모델 프로그램은 유전자 치료 및 희귀질환 연구를 위해 특별히 설계되었으며, 전장 게놈 서열 인간화 마우스 모델과 환자 맞춤형 병원성 point mutation 질환 모델을 특징으로 합니다.
Cyagen은 B6-hCOL7A1 인간화 마우스 모델(제품 번호: C001428)을 독자적으로 개발했으며, 일반적으로 재발하는 병원성 돌연변이 c.6527dupC를 도입하여 B6-hCOL7A1*c.6527dupC 질환 모델(제품 번호: C001538)[11]을 구축하였습니다. 이 모델은 유전자 편집 및 소단위 핵산(small nucleic acid) 치료의 연구 수요를 충족시키는 것을 목표로 하고 있습니다. 그리고 보충 요법 분야에 대한 Col7a1 유전자 knockout(KO) 마우스 모델(제품 번호: C001539)도 개발하였습니다.
B6-hCOL7A1*c.6527dupC 마우스 모델과 Col7a1 KO 마우스 모델은 모두 유의미한 RDEB 표현형을 보입니다. 이 모델들의 자세한 표현형 정보는 아래에 제공됩니다.
Homozygous Col7a1 KO 마우스 모델에서는 마우스 Col7a1 유전자의 발현이 완전히 제거됩니다. 마찬가지로, homozygous B6-hCOL7A1*c.6527dupC 마우스 모델은 마우스 Col7a1 유전자 발현이 부족하지만 인간 COL7A1 유전자를 동등한 수준으로 발현할 수 있습니다. c.6527dupC 돌연변이는 유전자 전사(transcription)에 영향을 미치지는 않지만, 비정상적인 단백질 발현을 초래합니다.

그림 3: 마우스 내인성 Col7a1 유전자 및 인간 COL7A1 유전자의 발현 분석
Wild-type 마우스와 heterozygous Col7a1 KO 마우스 모델은 마우스 COL7A1 단백질을 발현하지만, homozygous Col7a1 KO 마우스 모델은 이 단백질을 발현하지 않습니다. 이와 마찬가지로, homozygous B6-hCOL7A1 마우스 모델과 heterozygous B6-hCOL7A1*c.6527dupC 마우스 모델은 인간 COL7A1 단백질을 발현하지만, homozygou B6-hCOL7A1*c.6527dupC 마우스 모델은 이 단백질을 발현하지 않습니다. homozygous B6-hCOL7A1*c.6527dupC 마우스 모델과 homozygous Col7a1 KO 마우스 모델 모두 피부 조직에서 표피와 진피가 분리되는 증상을 보입니다.
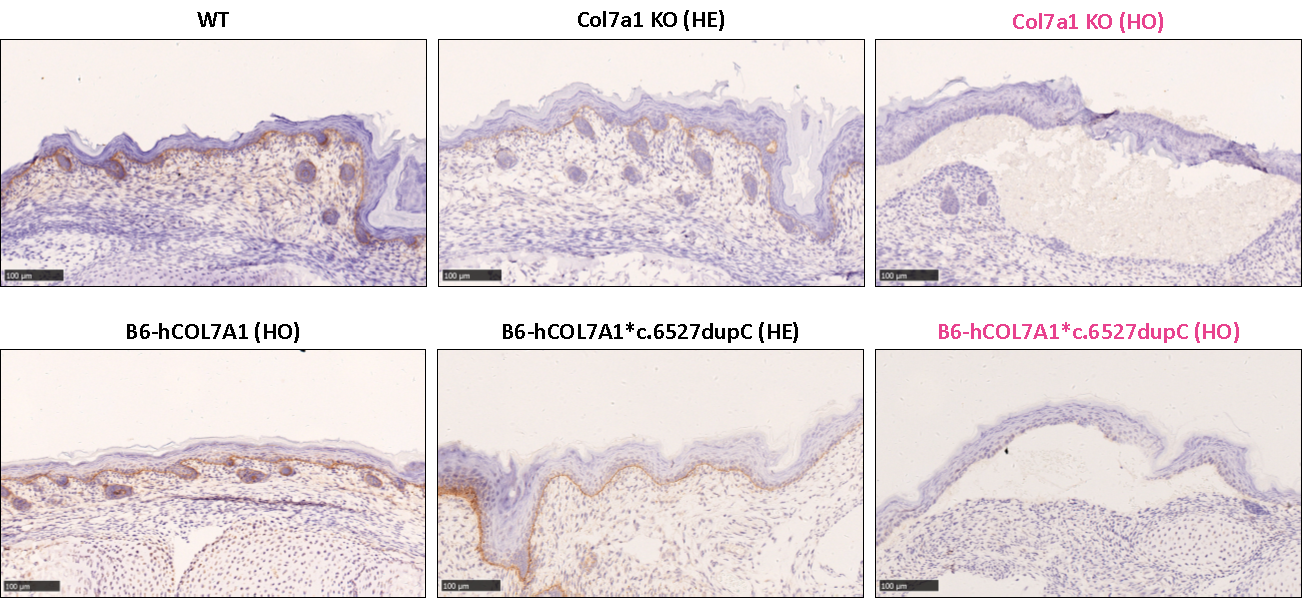
그림 4: Col7a1 KO 마우스 모델과 B6-hCOL7A1*c.6527dupC 마우스 모델의 피부에서 COL7A1 단백질 발현을 면역조직화학적으로 검출한 결과
Homozygous Col7a1 KO 마우스 모델과 homozygous B6-hCOL7A1*c.6527dupC 마우스 모델은 모두 출생 후 첫날에 피부 홍반과 수포 증상을 나타냅니다. 이 중 Col7a1 KO 마우스 모델은 표현형이 주로 앞발과 뒷발 패드에 영향을 미치고 출생 후 3일 이내에 폐사하는 등 증상이 더 심각했습니다.
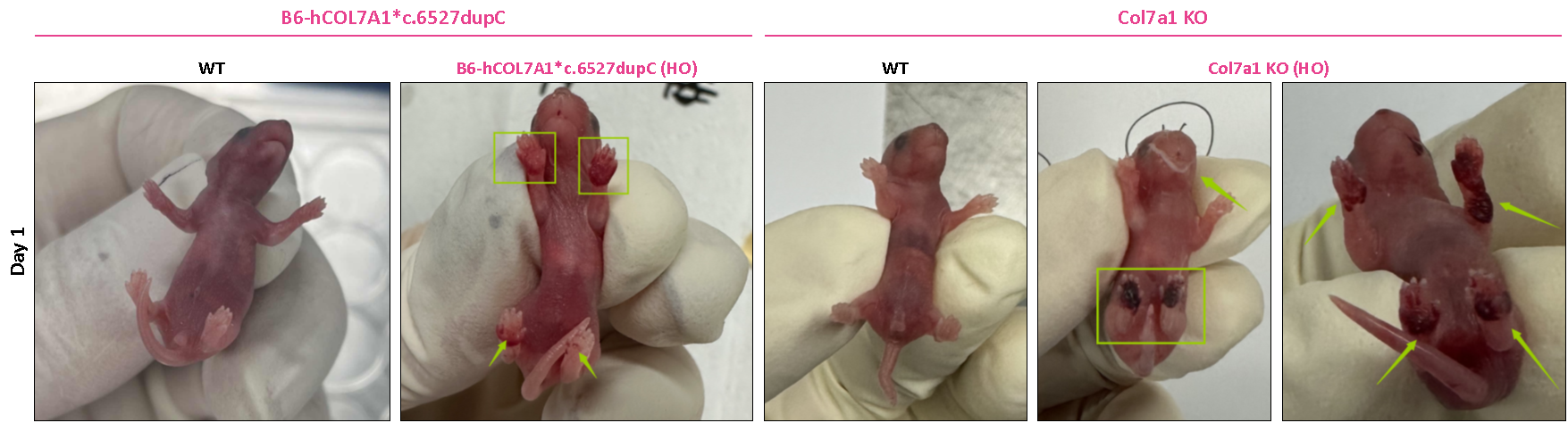
그림 5: 피부 홍반과 수포 표현형을 보이는 Col7a1 KO 마우스와 B6-hCOL7A1*c.6527dupC 마우스 모델
출생 후 첫날, homozygous B6-hCOL7A1*c.6527dupC 마우스는 앞발과 뒷발에 홍반과 수포가 나타납니다. 둘째 날에는 발뿐만 아니라 꼬리에서도 홍반과 수포가 관찰됩니다. 출생 후 7일째가 되면 홍반과 수포는 더 이상 보이지 않지만, 넓은 부위의 피부 벗겨짐이 나타납니다.
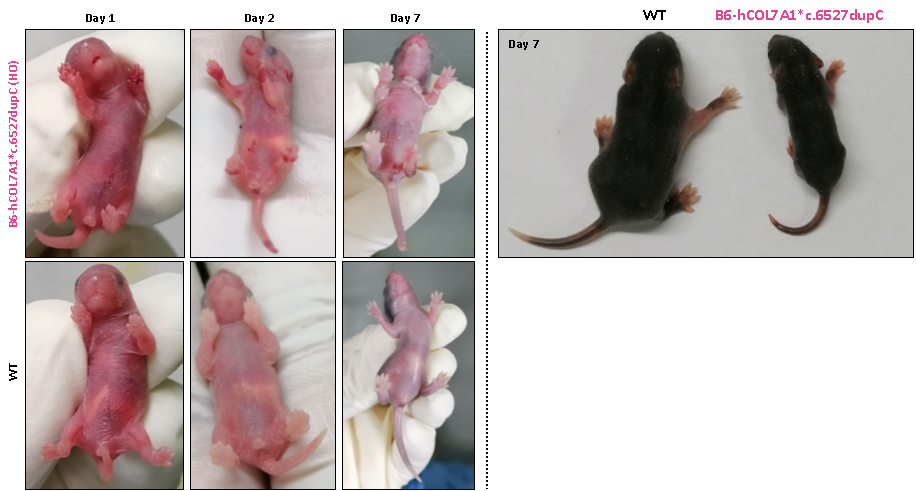
그림 6: B6-hCOL7A1*c.6527dupC 마우스에서 피부 홍반 및 박리 표현형의 진행 과정
Homozygous Col7a1 KO 마우스 모델과 homozygous B6-hCOL7A1*c.6527dupC 마우스 모델은 모두 상당한 피하 부종(그림에서 녹색 별표로 표시)이 나타내고 표피와 진피의 분리가 관찰됩니다.
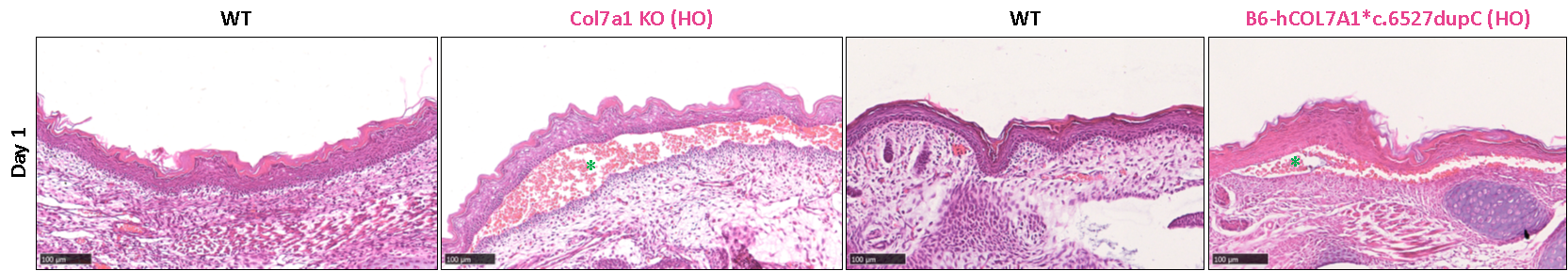
그림 7: Col7a1 KO 마우스와 B6-hCOL7A1*c.6527dupC 마우스의 피부 조직에 대한 H&E 염색 결과
결론
Homozygous Col7a1 KO 마우스 모델(제품 번호: C001539)과 homozygous B6-hCOL7A1*c.6527dupC 마우스 모델(제품 번호: C001538)은 모두 피부 홍반, 수포, 피하 부종, 표피와 진피의 분리 등 전형적인 수포성 표피박리증(EB)의 증상을 나타냅니다. 이러한 증상은 Col7a1 KO 마우스 모델에서 더 심하게 나타나며 주요 증상은 앞발과 뒷발 패드에 영향을 미치고, 이러한 마우스는 출생 후 3일 이내에 사망합니다. 반면, B6-hCOL7A1*c.6527dupC 마우스 모델은 비교적 가벼운 증상을 보이며, 주요 증상은 발바닥에 홍반과 수포로 시작하여 출생 후 7일째에는 넓은 부위의 피부 벗겨짐으로 진행됩니다.
또한 homozygous B6-hCOL7A1 마우스 모델과 heterozygous B6-hCOL7A1*c.6527dupC 마우스 모델의 피부는 COL7A1 단백질을 발현하는 반면, homozygous B6-hCOL7A1*c.6527dupC 마우스와 homozygous Col7a1 KO 마우스 모델은 이 단백질을 발현하지 않습니다. 이러한 인간화 및 knockout (KO) 마우스 모델은 전임상 이영양성 수포성 표피박리증(DEB) 연구에 필수적인 연구 도구를 제공하여 이 희귀 질환의 발병 기전에 대한 심층적인 이해를 돕고 새로운 치료법을 개발의 가능성을 열어줍니다.
Cyagen은 이 외에도 유전자 치료 및 희귀 질환 연구를 위한 다양한 인간화 및 point mutation 질환 모델을 제공하여 해당 분야 연구자들의 실험 니즈를 충족하고 있습니다.
HUGO-GT™ 차세대 인간화 마우스 모델
|
제품 번호 |
제품명 |
품종 계통 |
응용 분야 |
|
C001396 |
C57BL/6JCya |
망막색소변성(RP), 선천성 정지 야맹증(CSNB), 기타 망막 질환 |
|
|
C001410 |
C57BL/6JCya |
전두측두엽성 치매(FTD), 알츠하이머병(AD), 기타 신경퇴행성 질환 |
|
|
C001418 |
C57BL/6JCya |
루게릭병(ALS), 전두측두엽성 치매(FTD), 기타 신경퇴행성 질환 |
|
|
C001427 |
C57BL/6NCya |
파킨슨병(PD) |
|
|
C001437 |
C57BL/6NCya |
호흡 곤란을 동반한 척수성 근위축증 1형 (SMARD1), Charcot-Marie-Tooth 질환 2S형(CMT2S) |
|
|
C001495 |
C57BL/6JCya |
망막색소변성(RP), 선천성 정지 야맹증(CSNB), 기타 망막 질환 |
|
|
C001504 |
C57BL/6NCya |
척수성 근위축증(SMA) |
|
|
I001128 |
C57BL/6NCya |
레트 증후군(RTT) |
|
|
I001124 |
C57BL/6NCya |
소아조로증(HGPS) |
|
|
C001398 |
C57BL/6NCya |
척수소뇌성 운동실조증 3형(SCA3) |
|
|
C001512 |
C57BL/6NCya |
트랜스티레틴 아밀로이드증(ATTR) |
|
|
I001131 |
C57BL/6NCya |
뇌전증(간질) |
|
|
I001132 |
C57BL/6NCya |
낭포성 섬유증(CF) |
|
|
C001525 |
C57BL/6NCya |
트랜스티레틴 아밀로이드증(ATTR) |
|
|
I001130 |
C57BL/6NCya |
간렌즈핵변성(증) (HLD) |
|
|
IR1019 |
Sprague-Dawley |
알렉산더병(AxD), 외상성 뇌손상(TBI) |
|
|
C001533 |
C57BL/6NCya |
비만, 지방의 부적절한 분포 및 저장과 관련된 대사 장애 |
|
|
C001538 |
C57BL/6NCya |
이영양성 수포성 표피박리증(DEB) |
참고문헌:
[1] Eichstadt et al., "From Clinical Phenotype to Genotypic Modelling: Incidence and Prevalence of Recessive Dystrophic Epidermolysis Bullosa (RDEB)", Clin Cosmet Investig Dermatol, vol. 12, pp. 933-942, 2019.
[2] DEBRA International, "About EB: EB in Depth", Retrieved May 17, 2024, from https://www.debra.org/about-eb/eb-depth.
[3] Hou et al., "Innovations in the Treatment of Dystrophic Epidermolysis Bullosa (DEB): Current Landscape and Prospects", Ther Clin Risk Manag, vol. 19, pp. 455-473, 2023.
[4] Bonafont et al., "Correction of recessive dystrophic epidermolysis bullosa by homology-directed repair-mediated genome editing", Mol Ther, vol. 29, no. 6, pp. 2008-2018, 2021.
[5] Hainzl et al., "COL7A1 Editing via CRISPR/Cas9 in Recessive Dystrophic Epidermolysis Bullosa", Mol Ther, vol. 25, no. 11, pp. 2573-2584, 2017.
[6] García et al., "Preclinical model for phenotypic correction of dystrophic epidermolysis bullosa by in vivo CRISPR-Cas9 delivery using adenoviral vectors", Mol Ther Methods Clin Dev, vol. 27, pp. 96-108, 2022.
[7] Bornert et al., "QR-313, an Antisense Oligonucleotide, Shows Therapeutic Efficacy for Treatment of Dominant and Recessive Dystrophic Epidermolysis Bullosa: A Preclinical Study", J Invest Dermatol, vol. 141, no. 4, pp. 883-893.e6, 2021.
[8] Gurevich et al., "In vivo topical gene therapy for recessive dystrophic epidermolysis bullosa: a phase 1 and 2 trial", Nat Med, vol. 28, no. 4, pp. 780-788, 2022.
[9] Chamorro et al., "Gene Editing for the Efficient Correction of a Recurrent COL7A1 Mutation in Recessive Dystrophic Epidermolysis Bullosa Keratinocytes", Mol Ther Nucleic Acids, vol. 5, no. 4, e307, 2016.
[10] Fritsch et al., "A hypomorphic mouse model of dystrophic epidermolysis bullosa reveals mechanisms of disease and response to fibroblast therapy", J Clin Invest, vol. 118, no. 5, pp. 1669-79, 2008.
[11] Sanchez-Jimeno et al., "Recessive dystrophic epidermolysis bullosa: the origin of the c.6527insC mutation in the Spanish population", Br J Dermatol, vol. 168, no. 1, pp. 226-9, 2013.




영업일 기준 1-2일 내에 답변해 드리겠습니다.