

2024년 1월 23일, 반다 파마슈티컬스(Vanda Pharmaceuticals Inc.,VNDA)에서 IGHMBP2 유전자를 타겟으로 하는 자사의 안티센스 뉴클레오티드(Antisense nucleotide, ASO) 약물 VCA-894A가 FDA의 임상시험용 신약(Investigational New Drug, IND) 승인을 공식적으로 받았다고 발표했습니다[1].
이는 Alcyone Therapeutics가 개발한 AAV9-IGHMBP2 유전자 대체 요법에 이어 임상 승인을 받은 또 하나의 혁신적인 IGHMBP2 타겟 치료제로 기록되었습니다.[2]
VCA-894A는 IGHMBP2 유전자의 스플라이싱(splicing) 부위 돌연변이를 위해 특별히 설계된 새로운 ASO로, 운동 신경의 손실과 말초 신경계의 퇴행을 일으켜 2014년에 처음 정의된 희귀 질환인 샤르코-마리-투스병(Charcot-Marie-Tooth disease) 2S형(CMT2S) 또는 비골 근위축(Peroneal muscular atrophy) 2S형을 초래합니다.[3]
현재 IGHMBP2를 타겟으로 하는 임상시험 단계의 치료법은 유전자 치료와 소단위 핵산 약물(Small nucleic acid drugs)을 포함하며, 줄기세포 이식과 같은 다른 치료법도 활발히 개발되고 있습니다[4-7].
두 가지 임상적으로 구별되는 질환이 IGHMBP2 유전자 돌연변이와 관련이 있습니다: 호흡곤란을 동반한 척수성 근위축증 1형 (SMARD1)과 샤르코-마리-투스병 2S형(CMT2S). 마우스 유전자를 인간화하고 임상적으로 관련된 돌연변이를 도입함으로써 Cyagen의 차세대 HUGO-GTTM 마우스 모델은 질환의 유전적 기초와 잠재적 치료법을 복제하는 CMT2S 유사 표현형을 개발할 수 있습니다.
HUGO-GTTM B6-hIGHMBP2 마우스 모델은 내인성 마우스 IGHMBP2 유전자를 발현하지 않으면서도 인간 IGHMBP2 유전자를 효과적으로 발현하여 인간 유전자의 현저한 in vivo 발현을 실현할 수 있습니다. 따라서 이 모델은 샤르코-마리-투스병(CMT), SMARD1 등 IGHMBP2 유전자와 관련된 신경세포 질환 연구에 활용할 수 있습니다.
IGHMBP2 단백질의 구조와 생물학적 기능
Cardiac transcription factor 1 (CATF1)으로도 알려진 면역글로불린 μ-binding 단백질 2 (IGHMBP2)는 IGHMBP2 유전자에 의해 암호화된 ATP 의존성 DNA/RNA 헬리케이스(helicase) 효소입니다. 이 단백질은 DNA/RNA 헬리케이스(helicase) 도메인, R3H 단일 가닥(single-stranded) 핵산 결합 도메인, 그리고 아연 손가락(Zinc finger) 도메인을 포함한 여러 구조적 도메인을 가지고 있습니다.
IGHMBP2는 AAA+ ATPase superfamily에 속하며 DNA의 특정 영역에 부착하여 DNA 이중나선을 일시적으로 풀 수 있습니다.[8] 따라서 IGHMBP2는 DNA 복제, 복구 및 전사는 물론 RNA 대사, splicing, 단백질 translation 등과 같은 과정에서 조절 역할을 합니다. 또한 운동 뉴런(motor neuron)의 생존, 신경계 발달 및 유지, 정상적인 심장 기능 유지에 중요한 역할을 합니다.
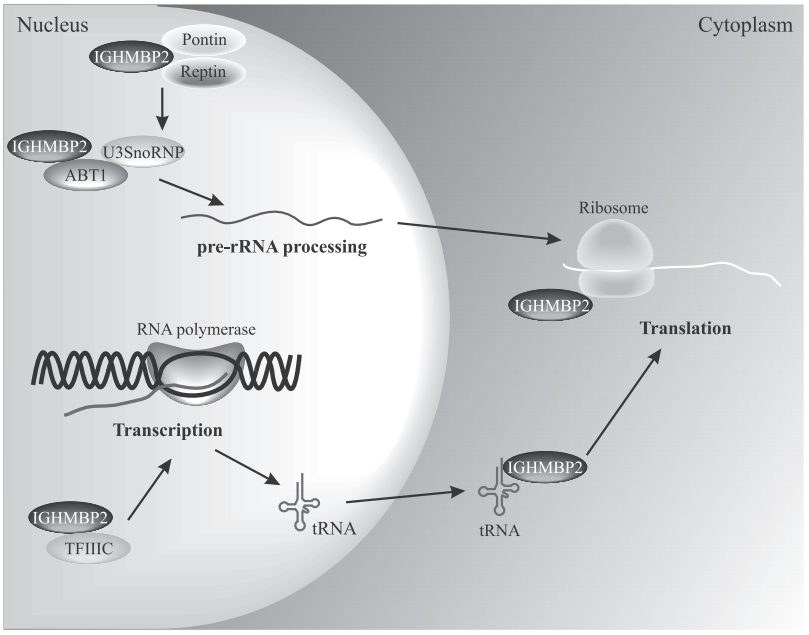
그림 1: IGHMBP2 단백질은 다양한 메커니즘을 통해 전사 및 translation 과정을 조절합니다. [8]
IGHMBP2 유전자 돌연변이는 CMT2S 및 SMARD1을 유발합니다
IGHMBP2 유전자 돌연변이는 임상적으로 다른 두 가지 질환 -- 호흡곤란을 동반한 척수성 근위축증 1형 (SMARD1)과 샤르코-마리-투스병 2S형(CMT2S)을 유발할 수 있습니다.
SMARD1은 주로 척수 전각의 α-운동 뉴런에 영향을 미치며 영유아에서 조기에 발병하는 근력 약화와 호흡곤란이 특징입니다. 횡격막 및 기타 호흡기 근육의 약화, 반사 저하, 연하 곤란, 운동 장애 등의 증상은 일반적으로 출생 후 몇 개월 이내에 나타납니다. SMARD1은 급성으로 발병하고 빠르게 진행되어 말초 호흡 부전으로 이어져 생명을 위협할 수 있습니다[9].
CMT2S는 말초 신경계에 영향을 미치는 유전성 신경 질환인 샤르코-마리-투스병(CMT)의 아형(subtype)입니다. CMT2S의 발병률은 1/1,000,000 미만이며 주로 출생 후 첫 10년 이내에 나타납니다. 사지 말단의 근육 약화 및 위축, 감각 상실, 힘줄 반사의 약화 또는 없음이 CMT2S의 특징입니다[10-11].
SMARD1에 비해 CMT2S는 말초 신경계와 관련이 있고 보다 경미한 표현형을 가지고 있으며, 일반적으로 치명적이지 않으며 보통 호흡 곤란(호흡장애)이나 척추 운동 뉴런의 손실을 일으키지 않습니다.
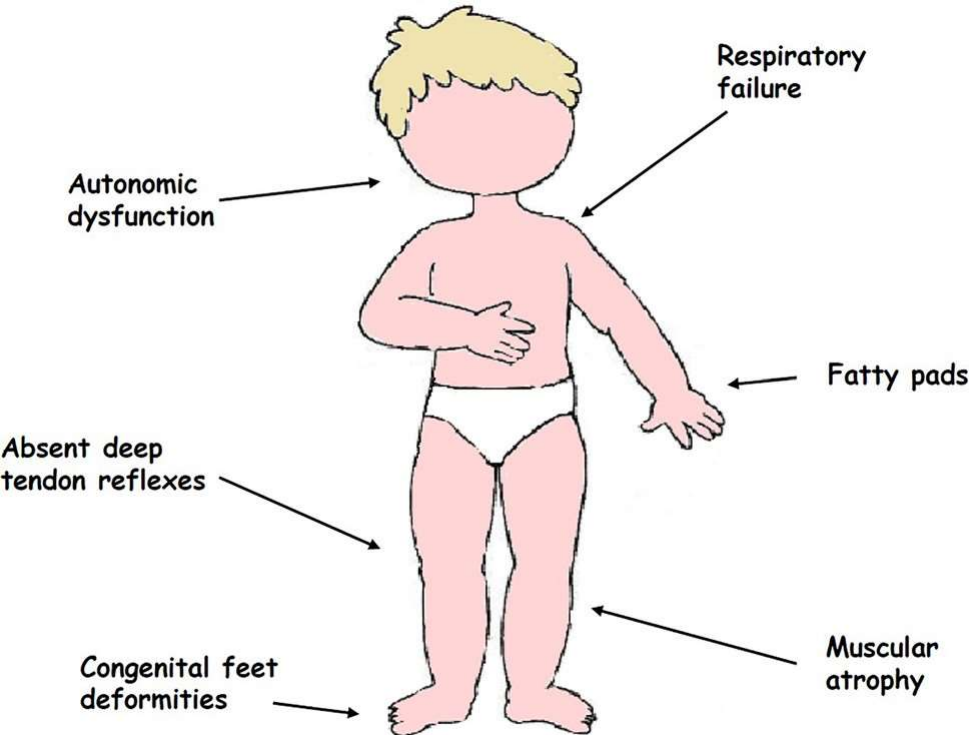
그림 2: SMARD1의 임상 특징[9]
IGHMBP2 돌연변이 유형 및 위치는 질환 유형 및 중증도와의 상관관계
IGHMBP2 유전자의 돌연변이 위치는 질환 유형과 표현형 중증도에 큰 영향을 미칩니다. IGHMBP2 유전자의 두 가지 RecA 유사 도메인(1A 및 2A)에서 발생하는 Non-truncating 돌연변이는 SMARD1을 유발하는 주요 병원성 돌연변이 유형이며, IGHMBP2 유전자의 마지막 exon에서 발생하는 truncating 돌연변이는 CMT2S의 주요 병인입니다. SMARD1의 발병 기전에서 IGHMBP2 단백질의 헬리케이스(helicase) 도메인은 중요한 역할을 합니다. SMARD1의 대부분 병원성 돌연변이는 이 헬리케이스(helicase) 도메인에서 발생하여 ATPase 또는 헬리케이스(helicase) 활성의 상실로 이어집니다[12]. 일반적으로 완전한 mRNA 분해를 초래하는 기능 상실 돌연변이는 더 심각한 SMARD1 표현형을 유발할 가능성이 높습니다.
반면, CMT2S의 발생은 주로 IGHMBP2 유전자의 5' untranslated region (UTR)에 있는 넌센스 돌연변이(Nonsense mutation)와 마지막 exon에 있는 frameshift, truncating, missense, 그리고 복합 이형 접합(Compound heterozygous) 돌연변이와 관련이 있습니다. [13]
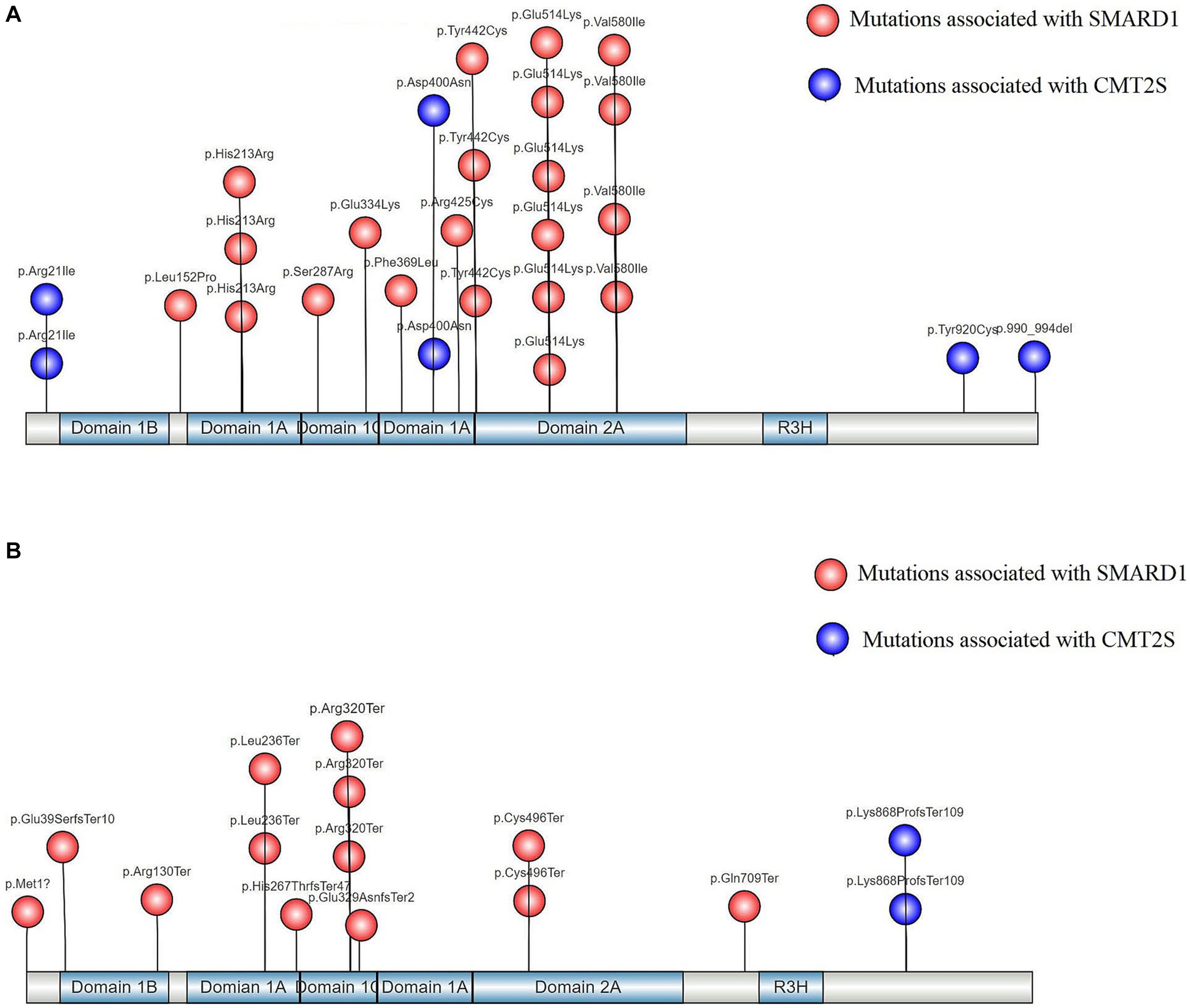
그림 3: IGHMBP2의 유전자 구조 및 단백질 functional region에서 non-truncating 돌연변이(A)와 truncating 돌연변이(B)의 분포[13].
IGHMBP2 관련 질환에 대한 전임상 연구 모델
IGHMBP2는 비교적 'mysterious' 단백질입니다. 헬리케이스(helicase)로서 그 중요성이 인정되었음에도 불구하고 세포 과정에서의 구체적인 역할은 아직 명확하지 않습니다. 이 유전자는 몸 전체에 걸쳐 전신적으로 발현되지만, 돌연변이는 주로 신경 세포에만 영향을 미쳐 SMARD1 및 CMT2S와 같은 특정 신경 질환을 유발합니다. 현재 이러한 IGHMBP2 관련 질환에 대해 승인된 효과적인 치료법이 없어 추가 연구의 필요성이 강조되고 있습니다.
신경근 퇴행성 질환(Neuromuscular degeneration, NMD) 마우스 모델은 SMARD1연구의 주요 모델로 사용되어 왔습니다. 이러한 마우스 모델에서는 Ighmbp2 유전자의 네 번째 intron에Spontaneous mutation이 발생하여 약 80%의 transcript에서 비정상적인 splicing이 발생합니다. 이에 따라 full-length의 Ighmbp2 mRNA 수준이 현저히 감소하고 SMARD1과 유사한 표현형이 나타납니다. 그러나 NMD 마우스 모델의 호흡곤란은 신경세포의 퇴화가 아니라 횡격막 결함에 의해 발생합니다. 또한 NMD 마우스 모델의 심장 세포의 사멸은 심근병증(Cardiomyopathy)과 심부전(Heart failure)으로 이어지며, 이는 사망의 조기 원인이 될 수 있지만 SMARD1 환자에서 관찰되지 않습니다. 따라서 NMD 마우스 모델은 특히 호흡곤란과 치사율 측면에서 인간 SMARD1과 상당한 차이를 보입니다[14].
또한, IGHMBP2 유전자 돌연변이도 CMT2S를 유발하지만, 현재 대부분의 마우스 모델은 이 질환의 임상적 특징을 재현하지 못합니다. 마우스 모델에서 CMT2S 유사 표현형을 유도하려면 마우스 유전자를 인간화하고 임상적으로 관련된 돌연변이를 도입하여 마우스 모델이 질환의 유전적 기초를 복제하는 CMT2S 유사 표현형을 개발할 수 있도록 해야 합니다[15]. 따라서 인간화 마우스 모델은 SMARD1 및 CMT2S와 같은 IGHMBP2 유전자 관련 질환에 대한 연구를 발전시키는 데 중요한 역할을 합니다.
IGHMBP2 유전자 인간화 모델 - B6-hIGHMBP2 마우스
SMARD1 및 CMT2S와 같은 IGHMBP2 유전자 관련 질환, 특히 소단위 핵산 약물 및 유전자 치료와 같이 인간 유전자를 정밀하게 타겟팅해야 하는 치료법의 연구 수요를 해결하기 위해 Cyagen은 IGHMBP2 유전자 인간화 모델 B6-hIGHMBP2 마우스(제품 ID: C001437) 모델을 개발하였습니다.
이 HUGO-GTTM 모델에서는 프로모터(promoter)부터 3'UTR까지 모든 염기 서열을 포함하는 마우스 IGHMBP2 유전자 자리(gene locus)에서 인간 IGHMBP2 유전자가 부위 특이적으로 in situ 치환되었습니다. 이 마우스 모델은 마우스 Ighmbp2 유전자를 발현하지 않고 인간 IGHMBP2 유전자를 성공적으로 발현합니다. 이 모델은 인간 IGHMBP2 유전자 또는 단백질을 타겟으로 하는 치료법을 연구하는 데 활용될 수 있습니다.
또한, B6-hIGHMBP2 마우스 모델은 임상 병원성 돌연변이 모델을 구축하는 기반으로, 특정 환자 돌연변이 유형에 맞는 유전자 치료제나 소단위 핵산 치료제를 평가할 수 있어 개인 맞춤형 정밀 의학을 실현할 수 있습니다.
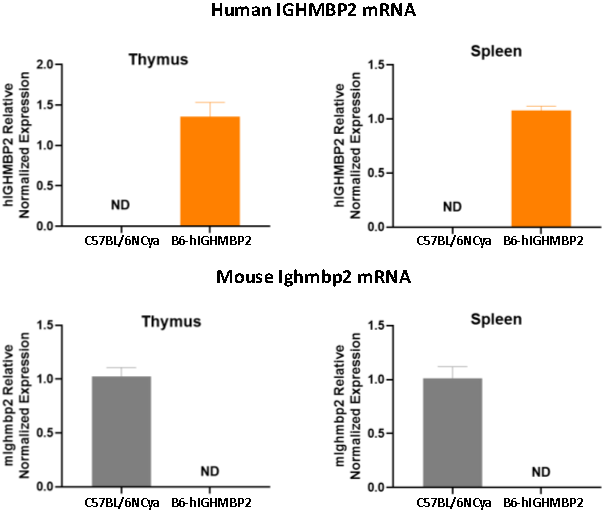
그림 4: C57BL/6NCya wild-type 마우스 모델과 B6-hIGHMBP2 마우스 모델에서의 in vivo 유전자 발현 검출
결론
B6-hIGHMBP2 마우스 모델(제품 ID: C001437)은 내인성 마우스 Ighmbp2 유전자는 발현하지 않으면서 인간 IGHMBP2 유전자를 효과적으로 발현하여 in vivo에서 인간 유전자의 발현이 현저합니다. 따라서 이 모델은 샤르코-마리-투스병(CMT), 호흡곤란을 동반한 척수성 근위축증 1형(SMARD1) 등 IGHMBP2 유전자와 관련된 신경계 질환 연구에 활용될 수 있습니다.
Cyagen은 독자적인 TurboKnockout fusion BAC 재조합 기술을 활용하여 이를 기반으로 hot-spot 돌연변이 질환 모델을 제공합니다. 또한, CMT 및 SMARD1과 같은 질환과 관련된 약물 스크리닝 및 약리 실험에 대한 연구원의 요구를 충족시키기 위해, Cyagen은 다양한 point mutation에 기반한 맞춤형 서비스도 제공합니다.
그리고 Cyagen은 신경퇴행성 질환 및 신경근육 질환 분야에서도 다양한 인간화 및 인간화 point mutation 동물 모델을 개발하여 해당 분야의 소단위 핵산 및 유전자 치료에 대한 연구 수요를 충족시키고 있습니다.
Cyagen의 연구 모델 맞춤화 프로젝트에 대한 무료 상담을 통해 전임상 연구를 향상해 보세요!
참고문헌:
[1] Vanda Pharmaceuticals. (2024, February 1). Vanda Pharmaceuticals Receives FDA Approval to Proceed with Investigational New Drug VCA-894A, a Novel Antisense Oligonucleotide Candidate for the Treatment of Charcot-Marie-Tooth Disease Type 2S. BioSpace. https://www.biospace.com/article/releases/vanda-pharmaceuticals-receives-fda-approval-to-proceed-with-investigational-new-drug-vca-894a-a-novel-antisense-oligonucleotide-candidate-for-the-treatment-of-charcot-marie-tooth-disease-type-2s/
[2] Cottenie E, Kochanski A, Jordanova A, Bansagi B, Zimon M, Horga A, Jaunmuktane Z, Saveri P, Rasic VM, Baets J, Bartsakoulia M, Ploski R, Teterycz P, Nikolic M, Quinlivan R, Laura M, Sweeney MG, Taroni F, Lunn MP, Moroni I, Gonzalez M, Hanna MG, Bettencourt C, Chabrol E, Franke A, von Au K, Schilhabel M, Kabzińska D, Hausmanowa-Petrusewicz I, Brandner S, Lim SC, Song H, Choi BO, Horvath R, Chung kW, Zuchner S, Pareyson D, Harms M, Reilly MM, Houlden H. Truncating and missense mutations in IGHMBP2 cause Charcot-Marie Tooth disease type 2. Am J Hum Genet. 2014 Nov 6;95(5):590-601.
[3] ClinicalTrials.gov. (2024, February 1). NCT05152823. ClinicalTrials.gov. https://beta.clinicaltrials.gov/study/NCT05152823?cond=CMT2S&checkSpell=false&rank=1
[4] Sierra-Delgado JA, Sinha-Ray S, Kaleem A, Ganjibakhsh M, Parvate M, Powers S, Zhang X, Likhite S, Meyer K. In Vitro Modeling as a Tool for Testing Therapeutics for Spinal Muscular Atrophy and IGHMBP2-Related Disorders. Biology (Basel). 2023 Jun 16;12(6):867.
[5] Shababi M, Feng Z, Villalon E, Sibigtroth CM, Osman EY, Miller MR, Williams-Simon PA, Lombardi A, Sass TH, Atkinson AK, Garcia ML, Ko CP, Lorson CL. Rescue of a Mouse Model of Spinal Muscular Atrophy With Respiratory Distress Type 1 by AAV9-IGHMBP2 Is Dose Dependent. Mol Ther. 2016 May;24(5):855-66.
[6] Nizzardo M, Simone C, Rizzo F, Salani S, Dametti S, Rinchetti P, Del Bo R, Foust K, Kaspar BK, Bresolin N, Comi GP, Corti S. Gene therapy rescues disease phenotype in a spinal muscular atrophy with respiratory distress type 1 (SMARD1) mouse model. Sci Adv. 2015 Mar 13;1(2):e1500078.
[7] Shababi M, Villalón E, Kaifer KA, DeMarco V, Lorson CL. A Direct Comparison of IV and ICV Delivery Methods for Gene Replacement Therapy in a Mouse Model of SMARD1. Mol Ther Methods Clin Dev. 2018 Aug 17;10:348-360.
[8] Rzepnikowska W, Kochański A. Models for IGHMBP2-associated diseases: an overview and a roadmap for the future. Neuromuscul Disord. 2021 Dec;31(12):1266-1278.
[9] Perego MGL, Galli N, Nizzardo M, Govoni A, Taiana M, Bresolin N, Comi GP, Corti S. Current understanding of and emerging treatment options for spinal muscular atrophy with respiratory distress type 1 (SMARD1). Cell Mol Life Sci. 2020 Sep;77(17):3351-3367.
[10] Peng Guo, Beisha Tang, Guohua Zhao, et al. Pathological characteristics and genetic mutations of peroneal muscular atrophy. Chinese Medical Journal, 2005, 85(34): 2382-2385.
[11] Orpha.net. (2024, February 1). OC_Exp.php?lng=EN&Expert=443073. Orpha.net. https://www.orpha.net/consor/cgi-bin/OC_Exp.php?lng=EN&Expert=443073
[12] Saladini M, Nizzardo M, Govoni A, Taiana M, Bresolin N, Comi GP, Corti S. Spinal muscular atrophy with respiratory distress type 1: Clinical phenotypes, molecular pathogenesis and therapeutic insights. J Cell Mol Med. 2020 Jan;24(2):1169-1178.
[13] Tian Y, Xing J, Shi Y, Yuan E. Exploring the relationship between IGHMBP2 gene mutations and spinal muscular atrophy with respiratory distress type 1 and Charcot-Marie-Tooth disease type 2S: a systematic review. Front Neurosci. 2023 Nov 17;17:1252075.
[14] Rzepnikowska W, Kochański A. Models for IGHMBP2-associated diseases: an overview and a roadmap for the future. Neuromuscul Disord. 2021 Dec;31(12):1266-1278.
[15] Martin PB, Holbrook SE, Hicks AN, Hines TJ, Bogdanik LP, Burgess RW, Cox GA. Clinically relevant mouse models of Charcot-Marie-Tooth type 2S. Hum Mol Genet. 2023 Apr 6;32(8):1276-1288.




영업일 기준 1-2일 내에 답변해 드리겠습니다.