

RNAi 치료제 선도 기업인 Alnylam은 최근 2023년 실적 결과를 공개했으며, 아밀로이드증 치료를 위한 트랜스티레틴(Transthyretin,TTR)을 타겟으로 하는 두 가지 siRNA 약물인 Patisiran(파티시란)과 Vutrisiran(부트리시란)이 총 9억 1,300만 달러 이상의 매출을 기록했다고 밝혔습니다[1].
전 세계적으로 트랜스티레틴 아밀로이드증(Transthyretin Amyloidosis, ATTR) 환자는 약 25만~55만 명에 이르며, 이 중 다수가 ATTR 심근병증(ATTR-CM)을 앓고 있습니다[2]. 그러나 Patisiran과 Vutrisiran은 현재 ATTR 다발성 신경병증(ATTR Polyneuropathy, ATTR-PN)의 치료제로만 승인되어 있습니다. 따라서 Alnylam은 ATTR-CM 치료에서 Patisiran과 Vutrisiran의 효능을 평가하기 위한 임상시험을 진행하고 있습니다.
이와 동시에 수많은 제약 회사가 소단위 핵산(Small nucleic acid), 저분자, 항체 또는 유전자 편집 치료제를 포함한 TTR-targeted 치료제를 개발하고 있으며, 이는 ATTR 치료를 위한 TTR-targeting 약물 개발 경쟁이 심화되고 있다는 사실을 보여줍니다.
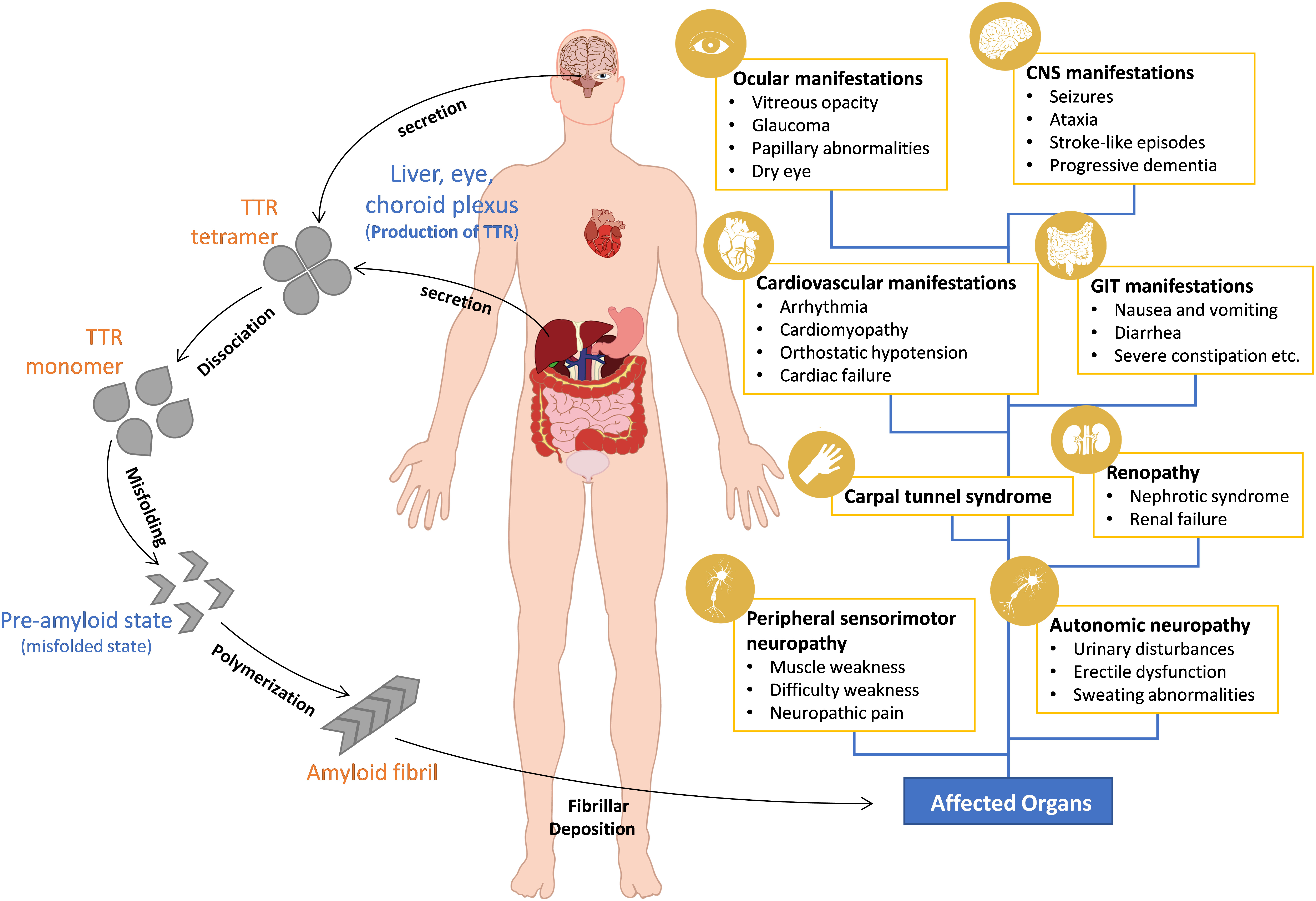
그림 1: 트랜스티레틴 아밀로이드증(ATTR)의 발병 기전 및 임상 증상[3].
TTR 단백질과 트랜스티레틴 아밀로이드증 (ATTR)
가장 흔한 유전성 아밀로이드증의 유형은 ATTR, 이는 유전자 코드의 병원성 변화(또는 돌연변이)로 인한 트랜스티레틴 단백질(TTR)의 잘못된 접힘으로 인해 발생하는 치명적인 질환입니다. 정상 상태에서 TTR 단백질은 주변 혈액에서 사합체(tetramer) 형태로 존재하며, 티록신(thyroxine)과 레티놀결합단백질(Retinol binding protein, RBP)을 운반하는 역할을 합니다.
ATTR 환자 체내의 TTR 단백질은 잘못 접히고 아밀로이드(amyloid) 유사 물질로 응집되어 조직과 장기에 침착되어 장기 기능 장애, 기능 부전, 심지어 사망에 이르게 됩니다[4]. TTR 유전자에 돌연변이가 있는지에 따라 ATTR은 유전성/mutant-type(ATTRv)과 비유전성/wild-type(ATTRwt)으로 분류할 수 있습니다.
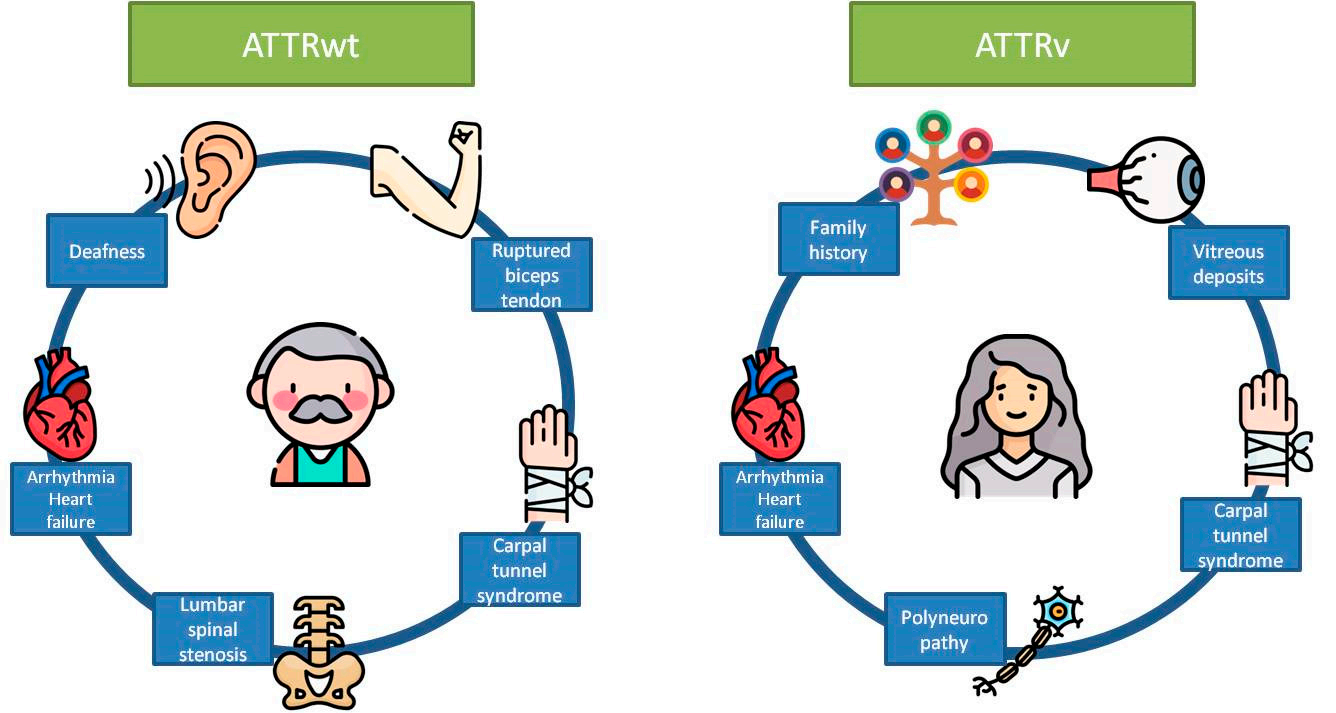
그림 2: ATTRwt와 ATTRv의 다른 발병률 및 임상 양상[6].
ATTRv는 TTR 유전자의 병원성 유전자 돌연변이에 의해 발생하며, 20세에서 80세 사이의 어느 연령에서든 발생할 수 있습니다. 이러한 돌연변이는 TTR 단백질이 사합체 상태에서 단위체로 해리된 다음 잘못 접히고 아밀로이드 유사 물질로 응집되어 결국 심장, 신경계, 신장과 같은 장기에 축적됩니다. 반면에 ATTRwt는 TTR 유전자의 돌연변이가 아니라 나이와 관련된 항상성 메커니즘의 실패로 인해 발생합니다. 노화로 인한 요인의 영향으로 wild-type TTR 단백질은 mutant-type TTR 단백질과 유사하게 잘못 접힐 수 있습니다. ATTRwt는 서서히 진행되는 질환으로 보통 65세 이후에 나타나기 때문에 노인성 전신 아밀로이드증으로도 알려져 있습니다.
ATTR 치료를 위한 TTR 유전자 및 단백질 타겟팅 치료
ATTR 치료제의 개발은 주로 TTR 단백질의 합성을 억제하거나, TTR 단백질의 사합체 구조를 안정시키거나, 잘못 접힌 TTR 단백질을 제거하는 데 초점을 맞추고 있습니다[7]. 이러한 치료 접근법 중 RNA interference 기술과 유전자 편집이 대표적인 방법입니다. 여러 안티센스 올리고뉴클레오타이드(Antisense oligonucleotide, ASO) 및 짧은 간섭 RNA(Small interfering RNA, siRNA) 약물은 돌연변이 및/또는 wild-type TTR 단백질의 합성을 효과적으로 억제하여 환자의 질환 표현형을 개선하는 것으로 입증되었습니다. 이러한 약물 중 다수가 성공적으로 승인되어 시판되고 있습니다. 또한, CRISPR과 같은 유전자 편집 기술을 활용한 치료법은 TTR 유전자 발현을 감소시키는 데 있어 유망한 초기 임상 결과를 보여주었습니다[8].
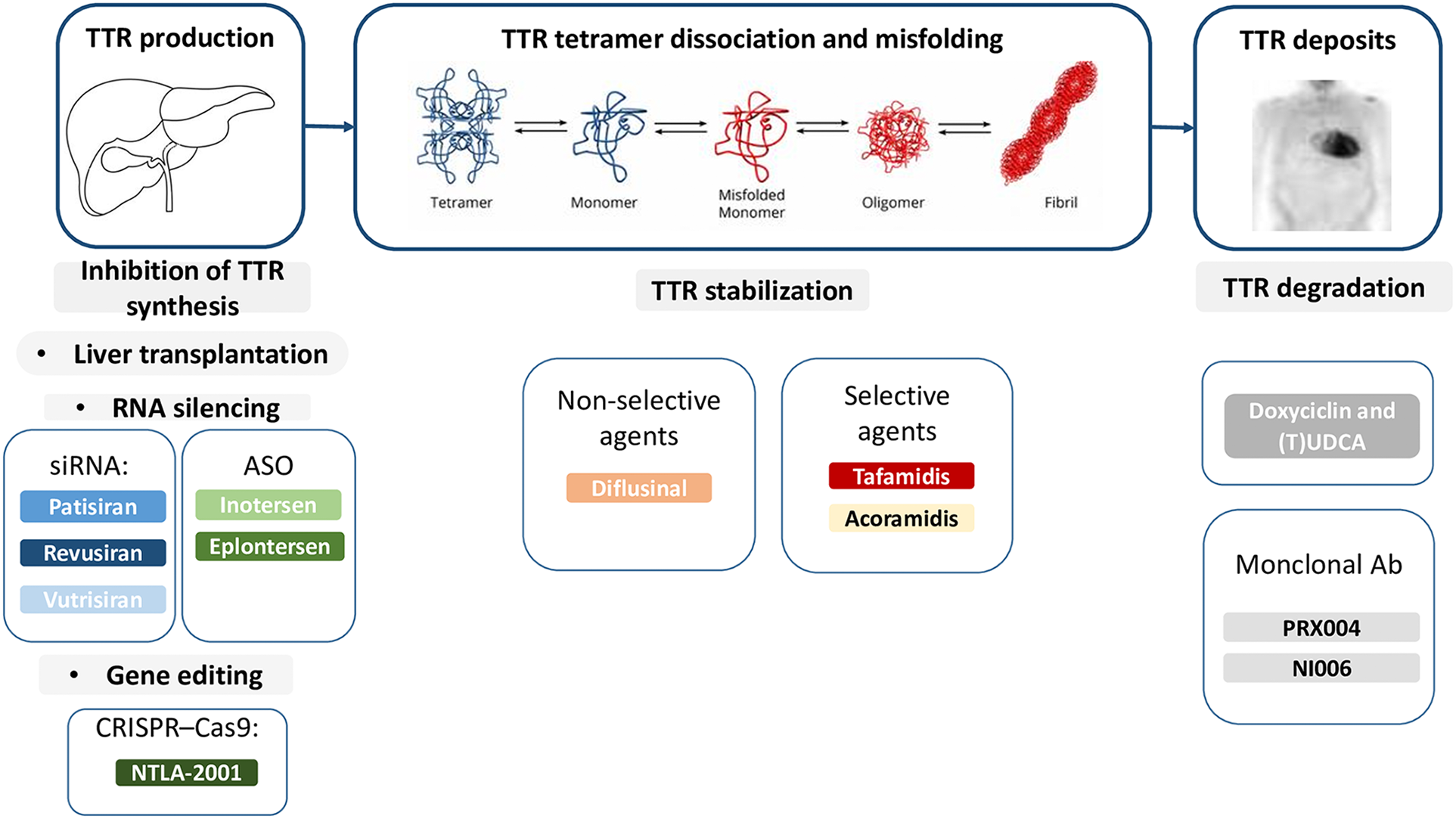
그림 3: ATTR 치료를 위한 TTR 유전자 및 단백질을 타겟으로 하는 다양한 혁신적 치료법[8]
소단위 핵산(Small nucleic acid) 및 유전자 편집 치료법은 모두 인간 유전자를 타겟으로 삼아 편집합니다. 예를 들어, Patisiran은 TTR mRNA의 3'UTR을 타겟으로 삼아 silence시킴으로써 TTR 단백질의 생성을 차단하는 것을 목표로 합니다. 따라서 전임상 연구에 가장 효과적인 플랫폼을 제공할 동물 모델을 개발하기 위해서는 마우스 유전자의 인간화가 필수적입니다. Cyagen은 마우스 Ttr 유전자의 두 가지 인간화된 마우스 모델을 개발했으며, 이는 전체 인간 유전자 서열과 동등한 병원성 인간 유전자 돌연변이(p.V50M) 모델로 교체되었습니다:
상기 두 모델 모두 ATTRwt와 ATTRv의 치료 연구에서 대부분의 유전자 편집, ASO 및 siRNA 요법에 대한 요구 사항을 충족할 수 있습니다. 다음은 이러한 차세대 인간화 마우스 모델에 대한 자세한 설명입니다.
인간 TTR 유전자 및 단백질 발현에 성공한 B6-hTTR 마우스 모델
RT-qPCR 및 ELISA 검출 결과에 따르면 B6-hTTR 마우스 모델은 인간화 TTR 유전자 및 단백질을 성공적으로 발현하며 내인성 마우스 Ttr 유전자는 발현되지 않는 것으로 나타났습니다.
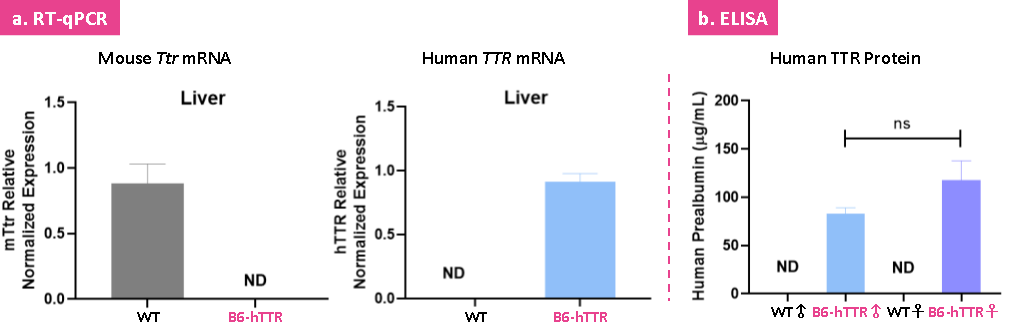
그림 4: B6-hTTR 마우스 모델에서 인간화된 TTR 유전자 및 단백질 발현 검출
B6-hTTR 마우스 모델은 소단위 핵산(Small nucleic acid) 약물의 효능 평가에 활용됩니다
Vutrisiran은 wild-type 및 돌연변이 인간 TTR mRNA에 모두 결합하여 이를 분해할 수 있는 siRNA 약물로 2022년에 성인 유전성 ATTR-PN 치료제로 승인을 받았습니다[9]. 검증 데이터에 따르면 Vutrisiran을 한 번 피하 주사한 후 B6-hTTR 마우스의 혈장 내 인간 TTR 단백질의 발현 수준이 대조군에 비해 현저히 낮아진 것으로 나타났습니다.
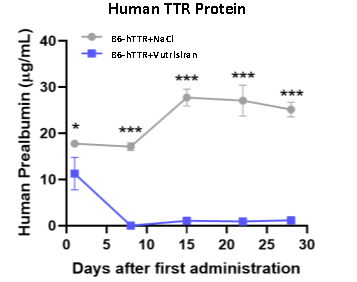
그림 5: B6-hTTR 마우스에 대한 소단위 핵산(Small nucleic acid) 약물 Vutrisiran의
in vivo 효능 테스트
H11-Alb-hTTR*V50M 마우스 모델은 인간의 돌연변이 TTR 유전자와 단백질을 발현합니다
H11-Alb-hTTR*V50M 마우스 모델은 p.V50M 병원성 돌연변이를 가진 인간 TTR 유전자를 마우스 H11 만전 한만(Safe harbor) 위치에 삽입하여 구축되었습니다. 이 모델은 인간화 TTR 유전자와 단백질을 성공적으로 발현하며 그 in vivo 발현 수준이 B6-hTTR 마우스 모델의 발현 수준을 훨씬 초과합니다.
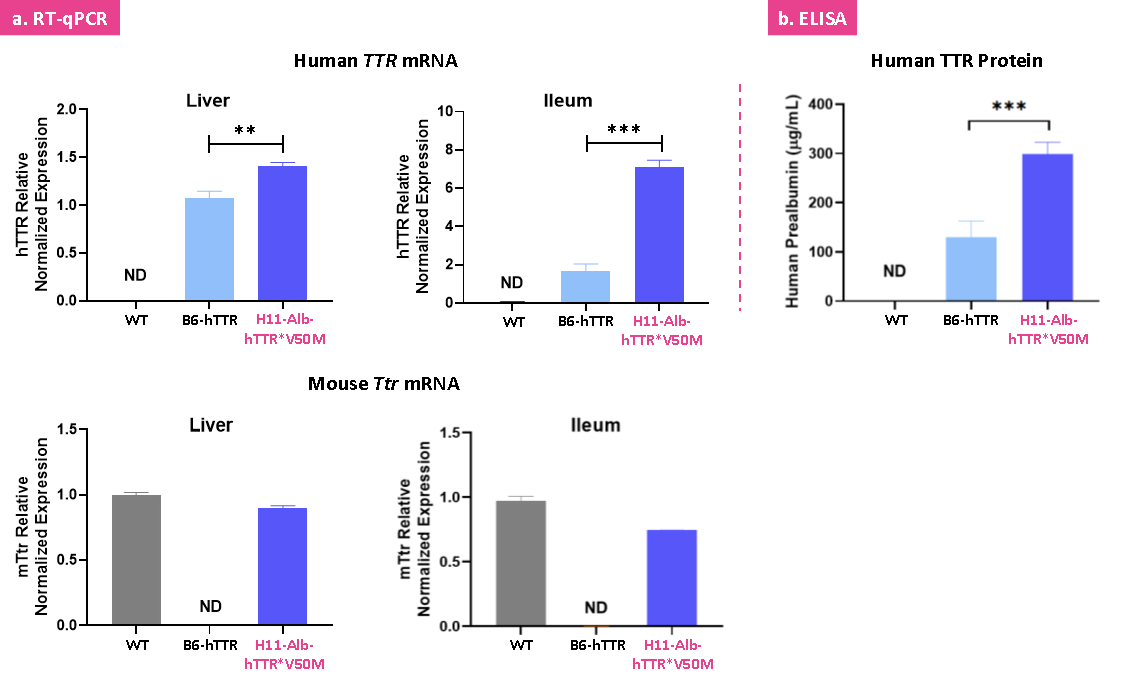
그림 6: H11-Alb-hTTR*V50M 마우스에 대한 인간화 TTR 유전자 및 단백질 발현 검출
요약
B6-hTTR 마우스 모델(제품 ID: C001512)과 H11-Alb-hTTR*V50M 마우스 모델(제품 ID: C001525)은 모두 인간화 TTR 유전자 및 단백질을 성공적으로 발현합니다. 이러한 마우스 모델의 TTR mRNA는 인간 TTR을 타겟으로 하는 소단위 핵산(small nucleic acid) 약물로 효과적으로 타겟팅하여 translation 발현을 억제하고 마우스 모델에서 인간화된 TTR 단백질의 수준을 낮출 수 있습니다. 따라서 이 두 가지 마우스 모델은 ATTR 질환의 메커니즘을 연구하고 표적 약물의 효능을 평가하는 데 효과적인 도구로 사용되고 있습니다. 특히 인간 TTR 유전자 및 mRNA를 타겟으로 하는 CRISPR 유전자 편집, 안티센스 올리고뉴클레오타이드(ASOs) 또는 짧은 간섭 RNA(siRNA) 약물과 같은 정밀 표적 치료법을 개발할 때 유용하게 활용될 수 있습니다.
또한, Cyagen은 독자적으로 개발한 TurboKnockout fusion BAC 재조합 기술을 활용하여 B6-hTTR 마우스 모델에 기반한 맞춤형 서비스를 제공합니다. 이 기술을 통해 다양한 point mutation에 맞춘 다른 인기 있는 인간화된 point mutation 질환 모델을 구축할 수 있게 하여, 정밀 치료법으로 다양한 TTR 병원성 돌연변이를 타겟으로 하는 약물 스크리닝 및 약리학 실험에 대한 연구자들의 요구를 충족할 수 있습니다.
참고문헌:
[1]Alnylam Pharmaceuticals, Inc. (2024, February 15). Alnylam Pharmaceuticals Reports Fourth Quarter and Full Year 2023 Financial Results and Highlights Recent Period Activity [Press release]. Retrieved from https://investors.alnylam.com/press-release?id=27941
[2]Gillmore JD, Gane E, Taubel J, Kao J, Fontana M, Maitland ML, Seitzer J, O'Connell D, Walsh KR, Wood K, Phillips J, Xu Y, Amaral A, Boyd AP, Cehelsky JE, McKee MD, Schiermeier A, Harari O, Murphy A, Kyratsous CA, Zambrowicz B, Soltys R, Gutstein DE, Leonard J, Sepp-Lorenzino L, Lebwohl D. CRISPR-Cas9 In Vivo Gene Editing for Transthyretin Amyloidosis. N Engl J Med. 2021 Aug 5;385(6):493-502.
[3]Ibrahim RB, Liu YT, Yeh SY, Tsai JW. Contributions of Animal Models to the Mechanisms and Therapies of Transthyretin Amyloidosis. Front Physiol. 2019 Apr 2;10:338.
[4]Nativi-Nicolau JN, Karam C, Khella S, Maurer MS. Screening for ATTR amyloidosis in the clinic: overlapping disorders, misdiagnosis, and multiorgan awareness. Heart Fail Rev. 2022 May;27(3):785-793.
[5]Koike H, Katsuno M. Transthyretin Amyloidosis: Update on the Clinical Spectrum, Pathogenesis, and Disease-Modifying Therapies. Neurol Ther. 2020 Dec;9(2):317-333.
[6]Merino-Merino AM, Labrador-Gomez J, Sanchez-Corral E, Delgado-Lopez PD, Perez-Rivera JA. Utility of Genetic Testing in Patients with Transthyretin Amyloid Cardiomyopathy: A Brief Review. Biomedicines. 2023 Dec 21;12(1):25.
[7]Aimo A, Castiglione V, Rapezzi C, Franzini M, Panichella G, Vergaro G, Gillmore J, Fontana M, Passino C, Emdin M. RNA-targeting and gene editing therapies for transthyretin amyloidosis. Nat Rev Cardiol. 2022 Oct;19(10):655-667.
[8]Tomasoni D, Bonfioli GB, Aimo A, Adamo M, Canepa M, Inciardi RM, Lombardi CM, Nardi M, Pagnesi M, Riccardi M, Vergaro G, Vizzardi E, Emdin M, Metra M. Treating amyloid transthyretin cardiomyopathy: lessons learned from clinical trials. Front Cardiovasc Med. 2023 May 23;10:1154594.
[9]Keam SJ. Vutrisiran: First Approval. Drugs. 2022 Sep;82(13):1419-1425.




영업일 기준 1-2일 내에 답변해 드리겠습니다.