

이번 소개해드릴 모델은 SNCA 유전자 인간화 모델인 B6-hSNCA 마우스(제품 번호: C001427)입니다. 이 모델은 파킨슨병(Parkinson's disease, PD) 및 루이소체 치매(Dementia with Lewy bodies, DLB)의 주요 치료 타겟에 신약 개발을 위해 차세대 인간화 마우스 모델을 제공합니다. 먼저 파킨슨병(PD)과 SNCA 유전자에 대해 알아봅시다.
파킨슨병 치매(Parkinson's Disease Dementia, PDD)
루이소체 치매(Lewy body dementia, LBD)에는 루이체 치매(DLB)와 파킨슨병 치매(PDD)의 두 가지 유형이 있으며, 뇌의 동일한 신경 퇴행성 병리 변화로 인해 발생합니다. 파킨슨병(PD)은 주로 노인 및 중장년층에 영향을 미치는 신경 퇴행성 질환으로 알츠하이머병(Alzheimer's disease, AD)에 이어 두 번째로 흔한 신경 퇴행성 질환입니다. 파킨슨병의 주요 특징은 뇌의 도파민 신경세포가 점진적으로 소실되어 떨림, 경직, 운동 장애와 같은 증상이 나타난다는 것입니다. 미국 파킨슨 재단(Parkinson Foundation)에 따르면 전 세계적으로 천만 명 이상의 사람들이 파킨슨병을 앓고 있으며, 향후 30년 안에 파킨슨병의 발병률이 두 배로 증가할 것으로 예상됩니다[1].
파킨슨병은 임상 증상, 병리학적 특징, 유전적 특성에서 이질성을 보이고 빠르게 진행되는 유형과 천천히 진행되는 유형으로 분류할 수 있습니다. 그러나 유형과 관계없이 현재 파킨슨병에 대한 치료법은 없으며, 환자는 운동 및 비운동 증상을 개선하기 위한 대증적 치료만 받을 수 있습니다[2].
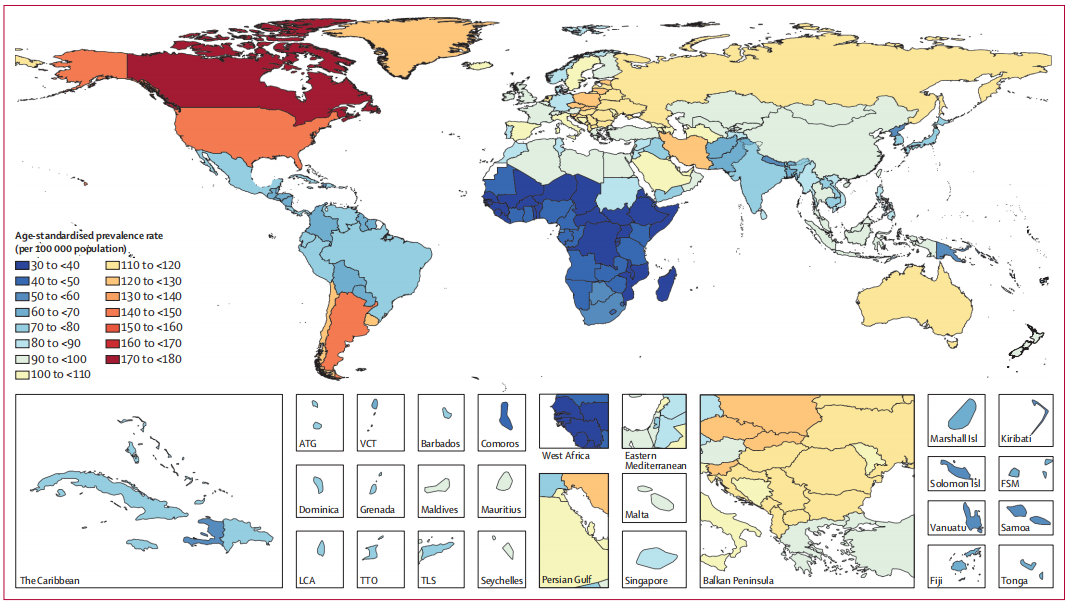
그림 1. 전 세계적으로 지역별 인구 10만 명당 파킨슨병의 연령 표준화 유병률[3]
파킨슨병(PD)의 유전적 메커니즘
파킨슨병(PD)에 대한 임상적 인식은 200년 이상이 되어 왔고 그의 병리학적인 설명은 100년 이상 거슬러 올라가지만, 이 질환에 대한 포괄적인 이해를 위해서는 여전히 더 많은 연구가 필요합니다. 파킨슨병(PD)의 발병 위험 요인으로는 나이, 성별, 노약 노출, 외상성 뇌 손상, 가족력 등이 있습니다. 파킨슨병(PD)의 주요 병리학적 메커니즘은 운동을 시작하고 원활하게 실행하는 데 중요한 역할을 하는 피질하핵(Subcortical nuclei)과 뇌간핵(Brainstem nuclei)이 서로 연결된 기저핵(Basal ganglia)의 기능 장애와 관련이 있습니다.
구체적으로는 흑질(Substantia nigra)에서 도파민 신경세포가 손실되면 미상핵(Caudate nucleus)과 담창구(Globus pallidum)로 구성된 선조체(Corpus striatum)로의 신호 전달에 영향을 미쳐 흑질 발달 부족을 초래합니다. 유전학적 관점에서 볼 때, 파킨슨병과 관련된 유전자인 SNCA가 최초 발견된 이후 지난 20년 동안 파킨슨병에 대한 민감성과 명확한 연관성이 있는 100개 이상의 다양한 유전자가 확인되었습니다[4].

그림 2. 파킨슨병에 대한 유전 및 치료 연구의 발전 [5]
SNCA 유전자 돌연변이 및 파킨슨병
파킨슨병(PD)의 전형적인 임상 양상은 루이체의 형성과 흑질 신경세포의 소실을 특징으로 하는 특정 운동 표현형입니다. 이 질병의 병리학적인 과정은 주로 중추 신경계에 루이소체(Lewy body, LB)가 형성되어 도파민 신경세포가 점진적으로 사멸되고 손실되는 것을 포함합니다. 루이소체는 주로 비정상적인 알파-시누클레인(α-syn)의 불용성 응집체로 구성됩니다. 알파-시누클레인(α-syn)을 코딩하는 SNCA 유전자는 루이소체와 관련이 있는 것으로 밝혀진 최초의 유전자로, 파킨슨병의 주요 병원성 유전자 중 하나로 간주됩니다. SNCA 유전자의 돌연변이는 알파-시누클레인(α-syn)의 과발현으로 이어져 루이소체가 형성될 수 있습니다. 이 병리는 파킨슨병 환자의 중추 및 말초 신경계에 널리 존재하며, 궁극적으로 파킨슨병의 발병으로 이어집니다[6-7]. 따라서 SNCA 유전자와 α-시누클레인(α-syn)은 파킨슨병 치료의 효과적인 타겟으로 간주됩니다.
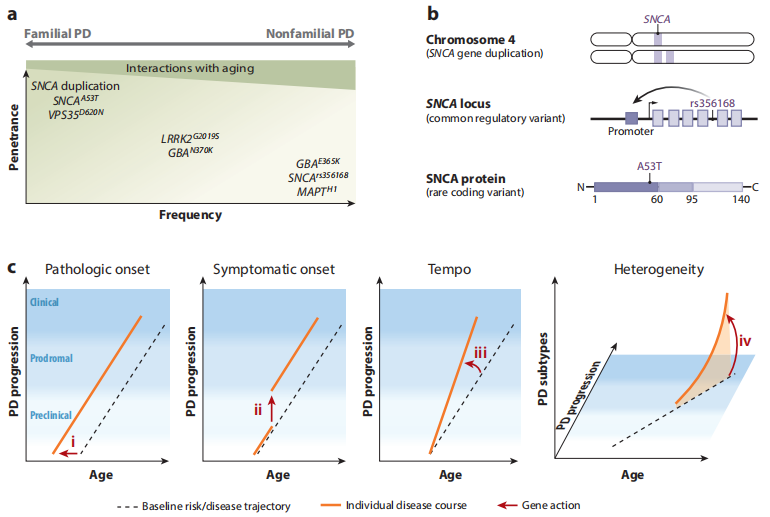
그림 3. 파킨슨병(PD)을 유발하는 SNCA 유전자 및 기타 관련 유전자의 돌연변이. [7]
파킨슨병 치료를 위한 SNCA 타겟팅
알파-시누클레인(α-syn)은 전형적인 저분자 결합부위(Binding pocket)가 없는 비정형 단백질(Intrinsically disordered protein, IDP)이기 때문에 기존의 저분자 약물 치료는 상당한 어려움에 직면해 있습니다. 새로운 치료 전략은 주로 알파-시누클레인의 과도한 형성을 억제하고 알파-시누클레인을 분해하거나 응집을 방지하여 루이소체(LB)의 형성을 막는 데에 초점을 맞추고 있습니다. 이러한 전략에는 SNCA 유전자 또는 SNCA mRNA를 타겟팅하는 유전자 치료법, RIBOTAC(Ribonuclease-targeting chimeras) 또는 RNA interference 기술 약물(예: ASO, siRNA, miRNA), 단백질을 타겟팅하는 항체 약물 등이 포함됩니다.[8-12] 어떤 방법을 사용하든 인간의 유전자나 단백질을 정확하게 타겟팅해야 합니다. 그러므로 인간 SNCA 유전자의 치료 약물을 개발하는 과정에 인간화 SNCA 유전자를 발현하는 전임상 연구 모델은 필수적입니다. 이러한 모델에 대한 개발과 적용은 파킨슨병(PD) 치료 연구에 새로운 가능성을 가져올 것입니다.
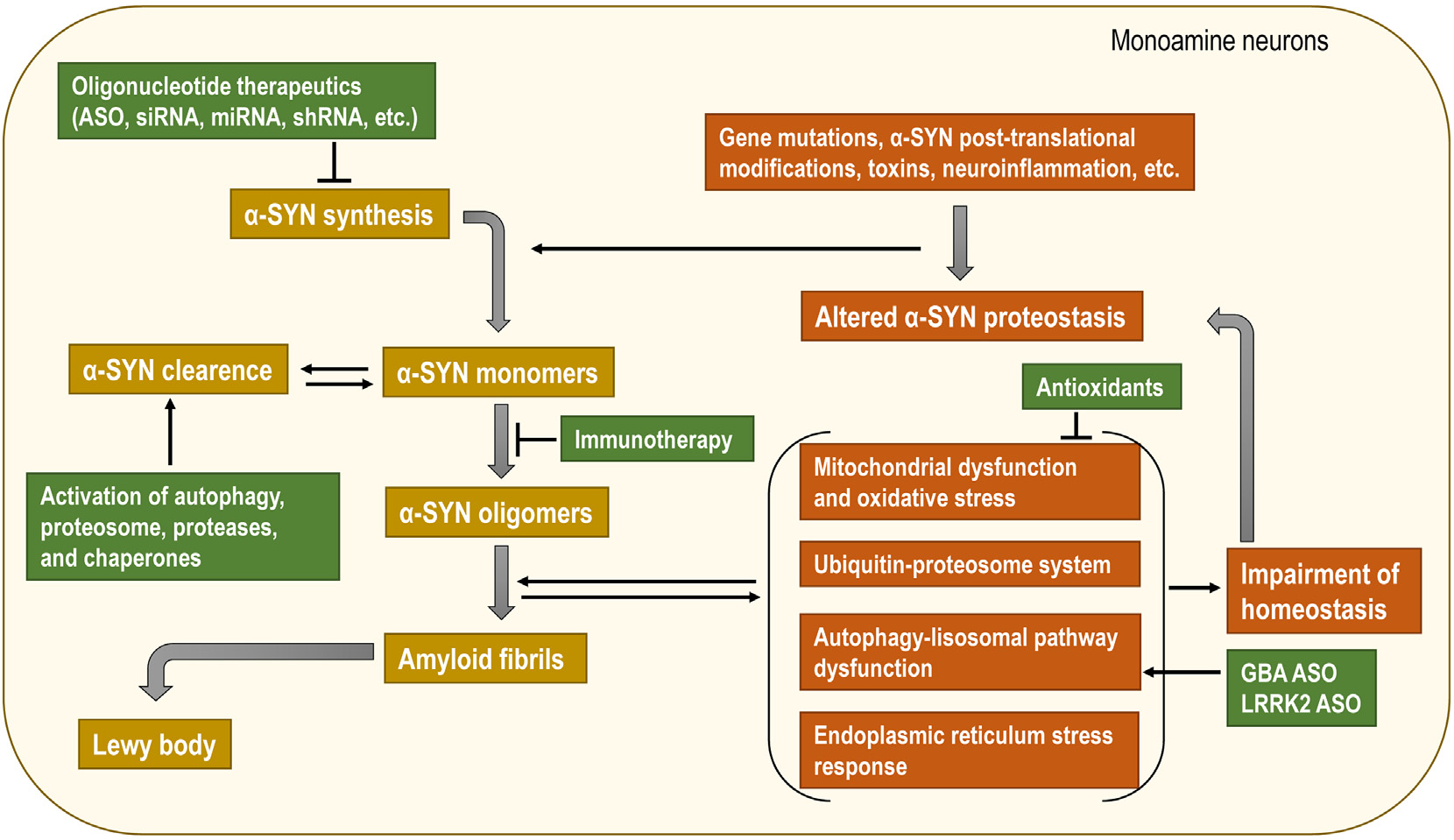
그림 4. 파킨슨병 치료에서 SNCA 유전자 또는 알파-시누클레인(α-syn)을 타겟팅하는 다양한 전략 [12]
SNCA 표적 치료 전임상 연구를 위한 마우스 모델
2022년 Ionis Pharmaceuticals Inc (IONS)는 SNCA를 타겟팅하는 안티센스 올리고뉴클레오티드(Antisense oligonucleotide, ASO) 치료제인 ION464를 개발하여 임상 1상 시험에 진입하도록 승인받았습니다[13]. 전임상 연구에서는 인간 Wild-Type(WT) SNCA 유전자를 발현하는 WT SNCA-PAC 마우스모델을 사용하여 α-시누클레인(α-syn) 형성에 대한 약물의 억제 효과를 검증했습니다. 그 결과 ION464는 α-시누클레인(α-syn)의 생성을 억제하고 독성 α-시누클레인(α-syn) 섬유에 노출된 후 신경세포 사멸을 방지하며 병리적 표현형과 운동 결핍을 약화시키는 것으로 나타났습니다[14]. 또한, 인간 wild-type 또는 돌연변이 SNCA 유전자를 발현하는 다양한 마우스 모델(예: Thy1-SNCA 마우스, TH-SNCA-140 m 마우스, α-syn A53T 마우스)을 사용하여 중추 신경계에서 α-시누클린(α-syn)의 형성에 대한 SNCA 타겟팅하는 ASO 및 기타 RNA interference 기술 약물의 억제 효과를 평가했습니다. [15-18]
SNCA 유전자 인간화 마우스 모델: B6-hSNCA 마우스
새로운 파킨슨병 치료제에 대한 절실한 요구를 충족하기 위해 Cyagen은 특히 SNCA 타겟팅 유전자 치료제 또는 RNA interference 기술 약물 분야에서 전임상 평가를 위한 광범위한 형질전환, 점 돌연변이 또는 인간화 마우스 모델을 제공할 수 있습니다. 그중에 B6-hSNCA 마우스(제품 번호: C001418)는 유전자 편집 기술로 만든 인간화 마우스 모델로, 마우스의 내인성 Snca 유전자를 제자리에서 인간 SNCA 유전자로 대체하여 인간 SNCA 유전자를 성공적으로 발현합니다. 또한, Cyagen은 이 모델을 기반으로 인기 있는 병원성 점 돌연변이의 인간화 마우스 모델을 구축하여 CRISPR, ASO, siRNA 및 miRNA와 같은 새로운 치료법에 대한 수요를 맞출 수 있습니다.

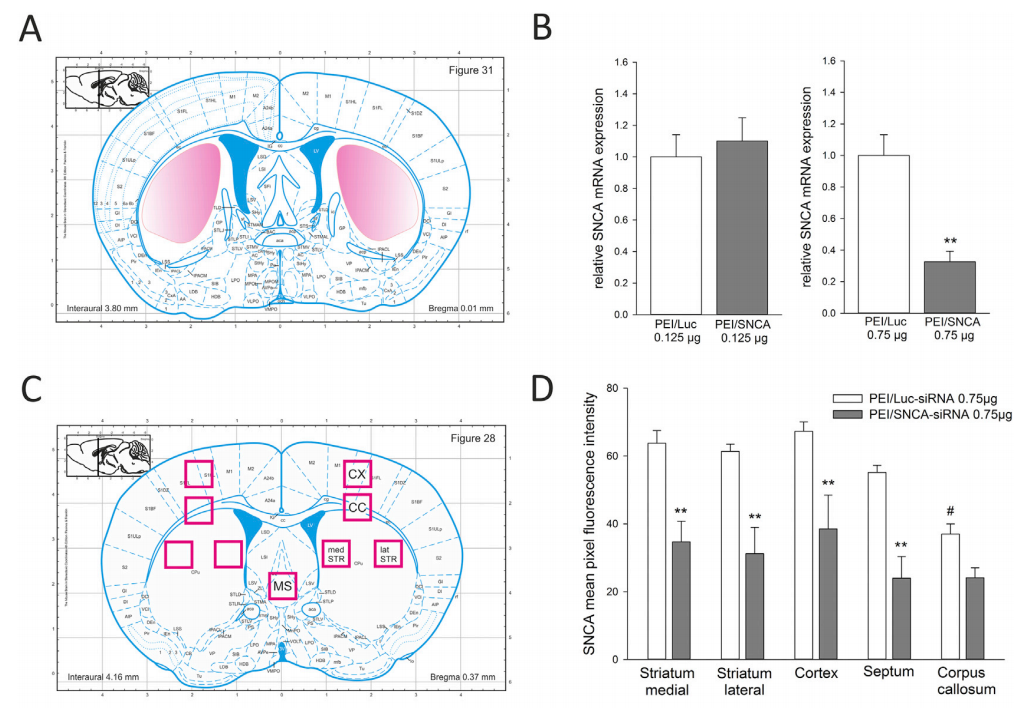
그림 6. Wild-Type(WT) 마우스 및 B6-hSNCA 마우스 모델(hSNCA)에서의 유전자 발현 검출
결론
B6-hSNCA 마우스 모델(제품 번호: C001427)은 마우스의 내인성 Snca 유전자를 발현하지 않고 인간 SNCA 유전자를 효과적으로 발현할 수 있습니다. B6-hSNCA 마우스 모델의 뇌와 비장에서 뚜렷한 인간 유전자가 상당히 많이 발현됩니다. 따라서 B6-hTARDBP 마우스 모델은 파킨슨병(PD) 및 루이소체 치매(DLB) 등 SNCA 유전자와 관련된 신경 퇴행성 질환을 연구하는 데 사용될 수 있습니다. 또한, Cyagen은 이 모델을 기반으로 인기 있는 점 돌연변이의 질환 모델을 제공하고, 다양한 점 돌연변이에 따른 맞춤형 서비스를 제공하여 관련 약물 스크리닝 및 약리학 연구에 대한 광범위한 연구 개발 수요를 충족시킬 수 있습니다.
형질전환(Tg) 마우스, Coding Sequence (CDS), Single-exon 인간화 마우스를 포함한 일반적인 인간화 모델은 연구자들에게 인기가 있지만, 마우스 게놈에 인간 유전자를 완전히 통합하는 데 아직 부족함이 있습니다. 질병 메커니즘과 신약 개발에 대한 이해를 발전시키기 위해서는 전장(Full-length) 게놈 DNA 인간화 마우스 모델이 절실히 필요합니다. 이러한 모델은 마우스 모델에서 인간의 유전자 발현 패턴, 조절 및 기능적 특성을 충실히 재현할 수 있습니다.
Cyagen은 최초의 전장 게놈 서열 인간화 마우스 모델을 성공적으로 개발해 왔으며, HUGO-GT™(Humanized Genomic Ortholog for Gene Therapy) 프로그램을 통해 이를 이용할 수 있습니다. Cyagen은 독자적인 TurboKnockout-Pro 기술을 사용하여 마우스 모델에서 인간 유전자의 발현 패턴, 조절, 기능적 특성 그리고 보다 광범위한 개입 타겟을 더 잘 복제하기 위해 마우스 모델의 목표 내인성 유전자의 in-situ 교체를 수행합니다. Cyagen은 전두측두엽 치매(Frontotemporal dementia, FTD), 척수성 근위축증(Spinal Muscular Atrophy, SMA), 근위축성 측삭경화증(Amyotrophic lateral sclerosis, ALS) 등 다른 신경 퇴행성 질화 및 희귀 질환을 연구하기 위해 HUGO-GT 마우스 모델을 구축하기 시작했습니다.
>> HUGO-GT™ 차세대 인간화 마우스 모델 알아보기
참고 문헌:
[1]Parkinson’s Foundation. (n.d.). Understanding Parkinson’s: Statistics. Retrieved January 20, 2024, from https://www.parkinson.org/understanding-parkinsons/statistics
[2]Bloem BR, Okun MS, Klein C. Parkinson's disease. Lancet. 2021 Jun 12;397(10291):2284-2303.
[3]GBD 2016 Parkinson's Disease Collaborators. Global, regional, and national burden of Parkinson's disease, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Neurol. 2018 Nov;17(11):939-953.
[4]Dumbhare O, Gaurkar SS. A Review of Genetic and Gene Therapy for Parkinson's Disease. Cureus. 2023 Feb 5;15(2):e34657.
[5]Dong-Chen X, Yong C, Yang X, Chen-Yu S, Li-Hua P. Signaling pathways in Parkinson's disease: molecular mechanisms and therapeutic interventions. Signal Transduct Target Ther. 2023 Feb 21;8(1):73.
[6]Armstrong MJ, Okun MS. Diagnosis and Treatment of Parkinson Disease: A Review. JAMA. 2020 Feb 11;323(6):548-560.
[7]Ye H, Robak LA, Yu M, Cykowski M, Shulman JM. Genetics and Pathogenesis of Parkinson's Syndrome. Annu Rev Pathol. 2023 Jan 24;18:95-121.
[8]Vijiaratnam N, Simuni T, Bandmann O, Morris HR, Foltynie T. Progress towards therapies for disease modification in Parkinson's disease. Lancet Neurol. 2021 Jul;20(7):559-572.
[9]Polissidis A, Petropoulou-Vathi L, Nakos-Bimpos M, Rideout HJ. The Future of Targeted Gene-Based Treatment Strategies and Biomarkers in Parkinson's Disease. Biomolecules. 2020 Jun 16;10(6):912.
[10]Dehay B, Bourdenx M, Gorry P, Przedborski S, Vila M, Hunot S, Singleton A, Olanow CW, Merchant KM, Bezard E, Petsko GA, Meissner WG. Targeting α-synuclein for treatment of Parkinson's disease: mechanistic and therapeutic considerations. Lancet Neurol. 2015 Aug;14(8):855-866.
[11]Tong Y, Zhang P, Yang X, Liu X, Zhang J, Grudniewska M, Jung I, Abegg D, Liu J, Childs-Disney JL, Gibaut QMR, Haniff HS, Adibekian A, Mouradian MM, Disney MD. Decreasing the intrinsically disordered protein α-synuclein levels by targeting its structured mRNA with a ribonuclease-targeting chimera. Proc Natl Acad Sci U S A. 2024 Jan 9;121(2):e2306682120.
[12]Bortolozzi A, Manashirov S, Chen A, Artigas F. Oligonucleotides as therapeutic tools for brain disorders: Focus on major depressive disorder and Parkinson's disease. Pharmacol Ther. 2021 Nov;227:107873.
[13]Alzforum. (n.d.). Therapeutics: ION464. Retrieved January 20, 2024, from https://www.alzforum.org/therapeutics/ion464
[14]Cole TA, Zhao H, Collier TJ, Sandoval I, Sortwell CE, Steece-Collier K, Daley BF, Booms A, Lipton J, Welch M, Berman M, Jandreski L, Graham D, Weihofen A, Celano S, Schulz E, Cole-Strauss A, Luna E, Quach D, Mohan A, Bennett CF, Swayze EE, Kordasiewicz HB, Luk KC, Paumier KL. α-Synuclein antisense oligonucleotides as a disease-modifying therapy for Parkinson's disease. JCI Insight. 2021 Mar 8;6(5):e135633.
[15]Alarcón-Arís D, Recasens A, Galofré M, Carballo-Carbajal I, Zacchi N, Ruiz-Bronchal E, Pavia-Collado R, Chica R, Ferrés-Coy A, Santos M, Revilla R, Montefeltro A, Fariñas I, Artigas F, Vila M, Bortolozzi A. Selective α-Synuclein Knockdown in Monoamine Neurons by Intranasal Oligonucleotide Delivery: Potential Therapy for Parkinson's Disease. Mol Ther. 2018 Feb 7;26(2):550-567.
[16]Yang J, Luo S, Zhang J, Yu T, Fu Z, Zheng Y, Xu X, Liu C, Fan M, Zhang Z. Exosome-mediated delivery of antisense oligonucleotides targeting α-synuclein ameliorates the pathology in a mouse model of Parkinson's disease. Neurobiol Dis. 2021 Jan;148:105218.
[17]Uehara T, Choong CJ, Nakamori M, Hayakawa H, Nishiyama K, Kasahara Y, Baba K, Nagata T, Yokota T, Tsuda H, Obika S, Mochizuki H. Amido-bridged nucleic acid (AmNA)-modified antisense oligonucleotides targeting α-synuclein as a novel therapy for Parkinson's disease. Sci Rep. 2019 May 21;9(1):7567.
[18]Helmschrodt C, Höbel S, Schöniger S, Bauer A, Bonicelli J, Gringmuth M, Fietz SA, Aigner A, Richter A, Richter F. Polyethylenimine Nanoparticle-Mediated siRNA Delivery to Reduce α-Synuclein Expression in a Model of Parkinson's Disease. Mol Ther Nucleic Acids. 2017 Dec 15;9:57-68.




영업일 기준 1-2일 내에 답변해 드리겠습니다.