

ALS의 경우 TDP-43 단백질의 병리학적 이상은 TARDBP 유전자의 돌연변이 여부에 관계없이 거의 보편적입니다. 이는 TDP-43이 ALS의 진행에 핵심적인 역할을 하며 광범위한 병리학적 표지이자 잠재적인 치료 표적임을 보여줍니다.
루게릭병
일반적으로 '루게릭병'으로 알려진 근위축성측색경화증(ALS)은 치명적인 신경퇴행성 질환으로 근육의 움직임과 호흡을 조절하는 상위/하위 운동 신경원(MNs)이 중추신경계에서 점차 퇴화 및 사망하여 근육이 점차 쇠약해지고 위축되는 것이 주요 특징입니다. 대부분의 ALS 환자는 증상이 처음 나타난 후 3~5년 이내에 스스로 숨을 쉴 수 없어 사망합니다[1-2]. 가족성 ALS 사례의 약 2/3와 산발성 ALS 사례의 1/10은 SOD1, TARDBP, ALS2, C9ORF72 및 FUS와 같은 유전자를 포함한 유전자 돌연변이와 관련이 있습니다.
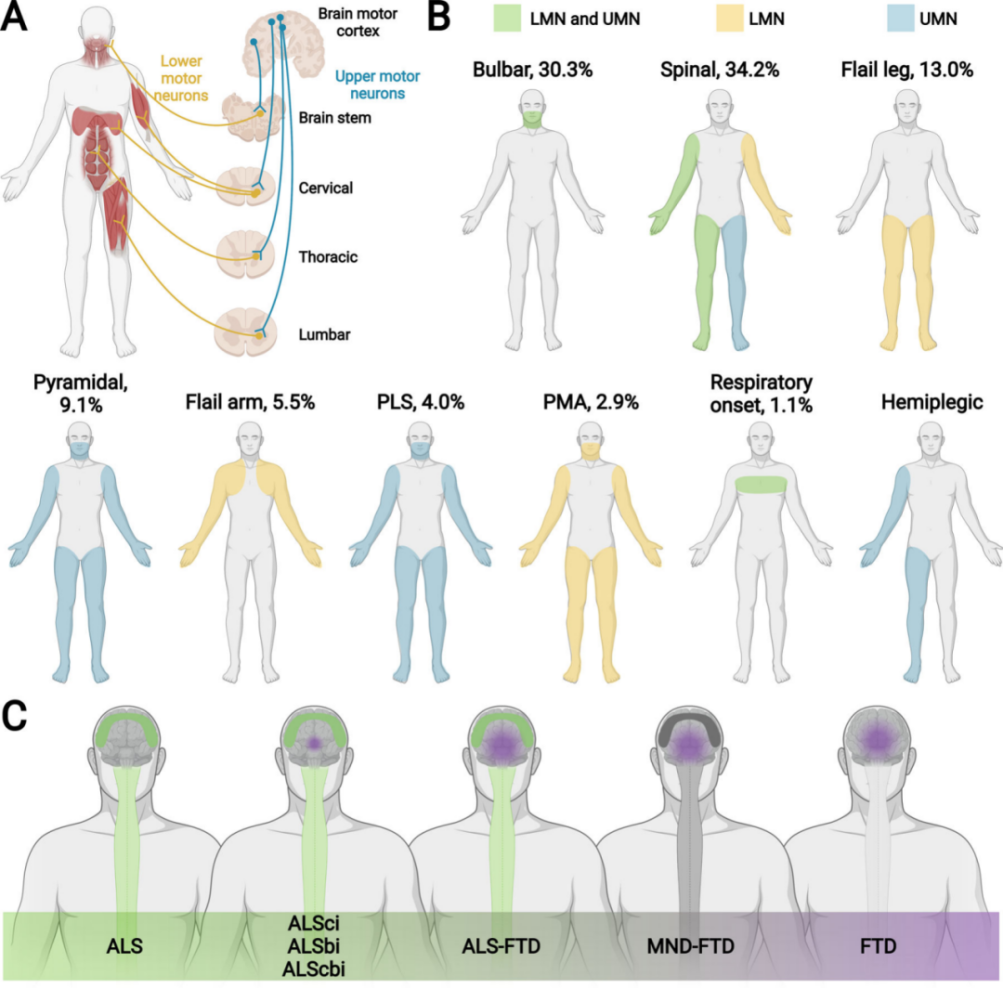
그림 1. 상하 운동 뉴런(UMN&LMN)의 다양한 기능 장애 유형에 따라 ALS 하위 유형과 FTD의 발달 단계를 나눕니다.
TDP-43 단백질 응집과 ALS의 관계
TAR DNA 결합 단백질 43 (TDP-43)은 TARDBP 유전자에 의해 인코딩되는 핵 단백질로, RNA의 가공, 운송 및 대사에 참여하며 단백질의 핵 내 진입, 일상 리듬 및 단백질 안정성을 조절합니다. TDP-43은 일반적으로 세포핵에 위치하며 세포핵과 세포질 간에 이동할 수 있습니다.일부 ALS 및 FTD 환자의 경우 TARDBP 유전자 돌연변이로 인해 TDP-43 단백질이 핵에서 세포질로 이동하여 봉입체 덩어리를 형성하게 되는데, 이러한 덩어리는 TDP-43의 정상적인 기능을 방해하고 독성을 생성하며 세포 과정을 방해할 수 있습니다. 궁극적으로 세포 사멸을 초래한다. 더 중요한 것은 TARDBP 돌연변이의 여부와 관계없이, 거의 모든 ALS 사례에서 TDP-43 단백질의 병리학적 이상을 관찰할 수 있습니다. 실제로, ALS 환자 사후 조직에서 TDP-43 단백질이 단백질 응집체의 주요 구성 성분임을 나타내며, 이는 TDP-43이 다양한 형태의 ALS에서 핵심적인 역할을 하는 것으로, 널리 퍼져있는 병리학적 표지 및 매우 유망한 치료 타깃임을 나타냅니다.

그림 2. TDP-43 단백질 불균형은 운동 뉴런(MN) 기능 장애 및 신경근 접합부(NMJ) 파괴의 잠재적 메커니즘을 초래합니다[5]
TDP-43 표적치료
다른 신경퇴행성 질환 치료의 현재 상태와 유사하게, ALS에 대한 약물 개발은 심각한 도전에 직면해 있습니다. 현재 연구의 초점 중 하나는 TARDBP 유전자 또는 TDP-43 단백질을 표적으로 삼는 것이지만, TDP-43을 표적으로 하는 치료법은 아직 질병 진행을 성공적으로 늦추거나 역전시키는 데 성공하지 못했습니다.TDP-43 단백질 표적 치료법은 주로 두 가지 전략을 채택합니다. 하나는 TDP-43 단백질 응집체의 형성을 억제하거나 형성된 응집체를 제거하는 것이고, 다른 하나는 병리학적 TDP-43의 분해를 유도하는 것입니다.또한 스트레스 과립(SG) 동적 조절, 자가포식 활성화, TDP-43 단백질 핵세포질 이동 조절, RNA 대사 복구 및 비정상적인 스플라이싱 이벤트 교정과 같은 몇 가지 관련 전략이 있습니다. 새로운 연구 방향에는 작은 핵산 약물을 사용하여 TARDBP 유전자의 병원성 돌연변이를 교정하고, AAV 벡터를 통해 TARDBP 유전자의 정확한 복사본을 전달하고, 유전자 치료를 위한 CRISPR와 같은 기술을 사용하는 것이 포함됩니다.
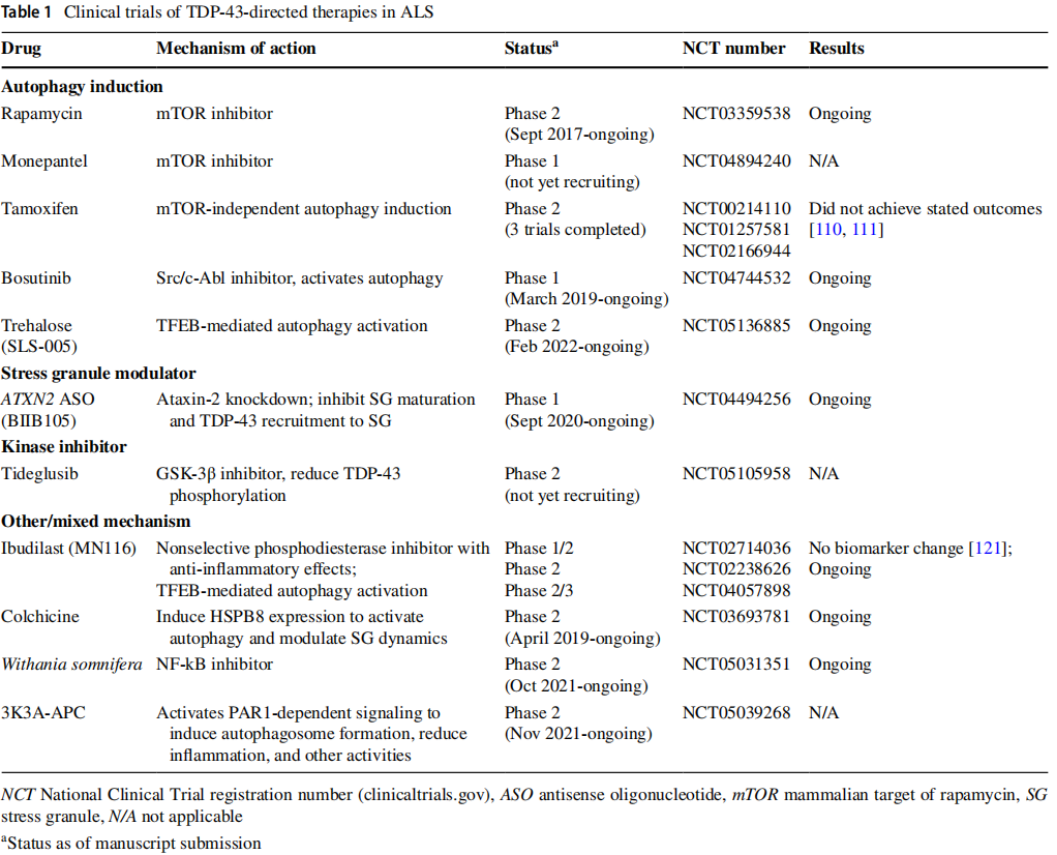
그림 3. 임상 단계에 진입한 TDP-43 표적 ALS 요법[6]
임상 시험을 진행하기 전에 각 치료 방법은 엄격한 임상 전 동물 평가를 거쳐야 하며, 서로 다른 치료 방법에는 각각 다른 유형의 동물 모델이 필요합니다.TDP-43 단백질 질환과 근위축성 척수측삭경화증 (ALS) 연구 분야에서, Cyagen은 다양한 유전자 조작, 과발현 또는 점 돌연변이 질병 모델을 제공하여 항체, 소분자 및 다양한 펩타이드와 같은 전통적인 약물 개발 평가 요구를 충족시킬 수 있습니다. Cyagen은 인간화 마우스 Tardbp 유전자를 사용하여 B6-hTARDBP 마우스 모델(제품 번호: C001418)을 성공적으로 개발했습니다. 이 모델은 인기있는 병원성 점 돌연변이의 인간화 모델을 구축하는 데 사용될 수 있으며, CRISPR, ASO, siRNA 및 miRNA 등의 신흥 치료법 연구 요구를 충족시키기 위해 사용될 수 있습니다. 아래는 해당 모델의 자세한 정보입니다.
B6-hTARDBP 마우스는 인간 TARDBP 유전자를 성공적으로 표현
RT-qPCR 테스트 결과는 야생형 마우스와 비교하여 B6-hTARDBP 마우스가 인간 TARDBP 유전자를 성공적으로 발현하고 마우스 Tardbp 유전자를 발현하지 않는 것으로 나타났습니다.
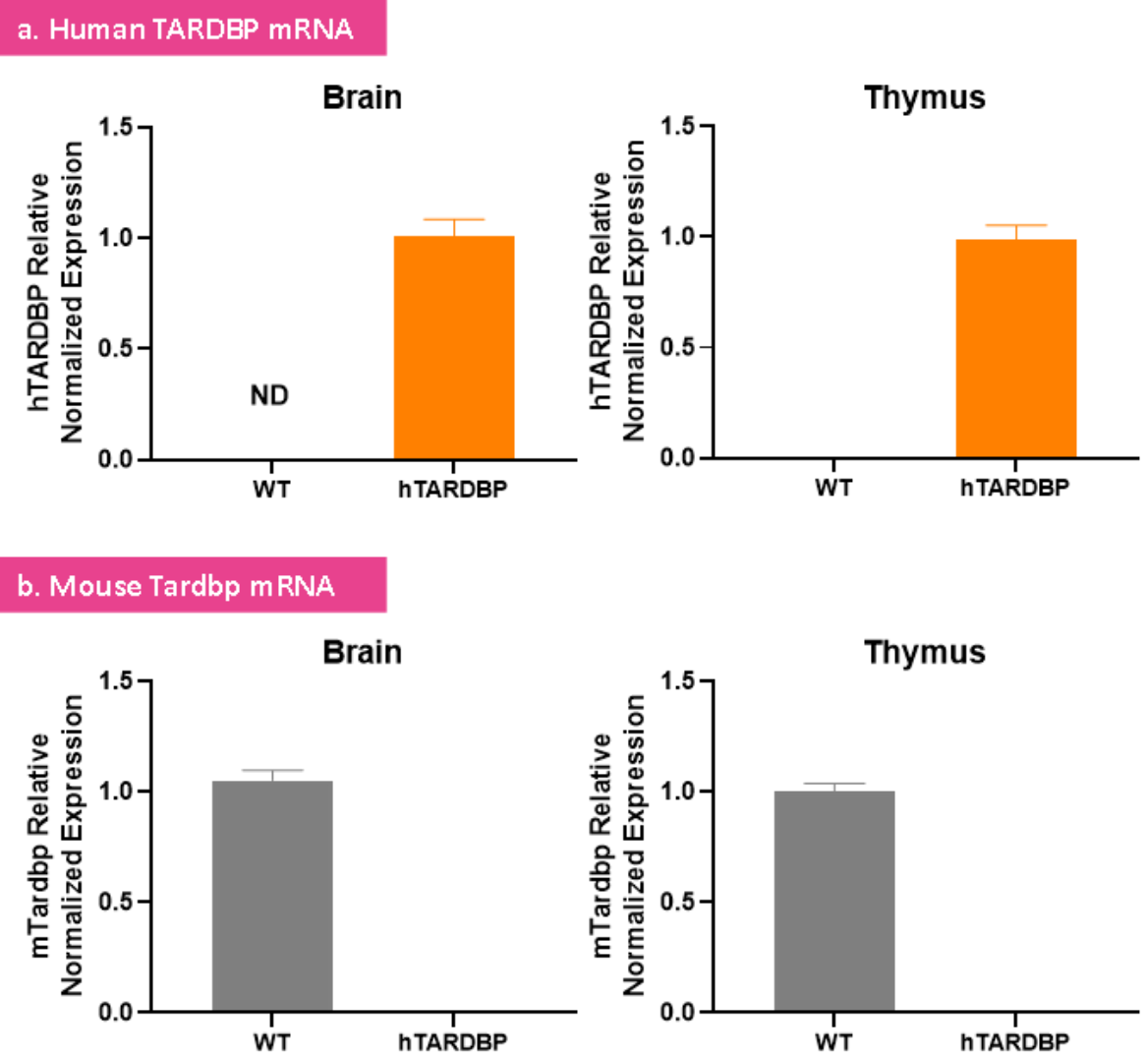
그림 4. 야생형 마우스(WT) 및 B6-hTARDBP 마우스(hTARDBP)에서의 유전자 표현 검출
B6-hTARDBP 마우스 뇌는 인간화 TDP-43 단백질을 성공적으로 표현
Western Blot 테스트 결과 B6-hTARDBP 마우스의 뇌에서 인간화 TDP-43 단백질의 상당한 표현이 나타났습니다. 그 표현 수준은 신경계에서 TARDBP*A315T 돌연변이 유전자를 과표현하는 Tg(TARDBP*A315T) 형질전환 마우스와 유사합니다.

그림 5. 뇌 조직 중 인간화 TDP-43 단백질의(hTDP-43) 표현 검출
인간화 TDP-43 단백질은 B6-hTARDBP 마우스의 척수에 널리 분포되어 있습니다
면역조직화학 (IHC) 검사 결과에 따르면, 야생형 (WT) 마우스의 척수에서는 인간 TDP-43 단백질이 발현되지 않으며, 반면에 B6-hTARDBP 마우스와 Tg(TARDBP*A315T) 마우스의 척수에서는 인간 TDP-43 단백질의 상당한 발현 및 널리 분포가 확인됩니다.

그림 6. 척수 조직에서 인간 TDP-43 단백질의 발현 및 분포 검측
결론
B6-hTARDBP 마우스 모델(제품번호: C001418)은 마우스 내인성 Tardbp 유전자를 표현하지 않고도 인간 TARDBP 유전자를 효과적으로 표현할 수 있습니다. 이 모델의 뇌 및 척수에서는 상당한 양의 인간 TDP-43 단백질이 발현되며, 이 표현 수준과 분포는 고전적인 유전자 조작 모델과 유사합니다. 따라서, B6-hTARDBP 마우스 모델은 ALS 및 FTD와 같은 TDP-43 단백질 관련 신경퇴행성 질환의 연구에 사용될 수 있습니다.
또한, Cyagen은 자체 개발한 TurboKnockout 융합 BAC 재조합 기술 혁신을 기반으로하여 이 모델을 기반으로 한 인기 있는 점 돌연변이 질환 모델을 제공할 뿐만 아니라, 다양한 점 돌연변이에 따라 맞춤형 서비스를 제공하여 ALS 및 FTD와 같은 질병에 대한 약물 스크리닝 및 약리학 실험 등의 요구를 충족시킬 수 있습니다.
신경근 질환 연구 모델 추천:
|
질병명 |
제품명 |
제품 번호 |
|
근위축성측색경화증, ALS |
B6-hTARDBP |
C001418 |
|
근위축성측색경화증, ALS |
B6-Fus*R513C |
C001438 |
|
전두측두엽성 치매, FD |
B6-htau |
C001410 |
|
척수 소뇌성 운동 실조,SCAs (Spinocerebellar Ataxias) |
B6-hATXN3 |
C001398 |
|
척수성 근위축증 동반 호흡곤란 I형(SMARD1) |
B6-hIGHMBP2 |
C001437 |
|
파킨슨병 (PD) |
B6-hSNCA |
C001427 |
|
헌팅턴병 (HD) |
FVB-HTTKI(nQ) |
C001404 |
|
척수성근위축 (SMA) |
B6-hSMN2(SMA) |
C001504 |
|
듀켄씨근이영양증, DMD |
DMD-Q995* |
C001518 |
|
레트 증후군(Rett Syndrome) |
B6-hMecp2 |
I001128 |
|
뇌전증(epilepsy) |
B6-hSCN2A |
I001131 |
참고 문헌:
[1] Hardiman O, Al-Chalabi A, Chio A, Corr EM, Logroscino G, Robberecht W, Shaw PJ, Simmons Z, van den Berg LH. Amyotrophic lateral sclerosis. Nat Rev Dis Primers. 2017 Oct 5;3:17071.
[2] Gregory, J.M., Fagegaltier, D., Phatnani, H. et al. Genetics of Amyotrophic Lateral Sclerosis. Curr Genet Med Rep 8, 121–131 (2020).
[3] Feldman EL, Goutman SA, Petri S, Mazzini L, Savelieff MG, Shaw PJ, Sobue G. Amyotrophic lateral sclerosis. Lancet. 2022 Oct 15;400(10360):1363-1380.
[4] Suk TR, Rousseaux MWC. The role of TDP-43 mislocalization in amyotrophic lateral sclerosis. Mol Neurodegener. 2020 Aug 15;15(1):45.
[5] Lépine S, Castellanos-Montiel MJ, Durcan TM. TDP-43 dysregulation and neuromuscular junction disruption in amyotrophic lateral sclerosis. Transl Neurodegener. 2022 Dec 27;11(1):56.
[6] Hayes LR, Kalab P. Emerging Therapies and Novel Targets for TDP-43 Proteinopathy in ALS/FTD. Neurotherapeutics. 2022 Jul;19(4):1061-1084.
[7] Francois-Moutal L, Scott DD, Khanna M. Direct targeting of TDP-43, from small molecules to biologics: the therapeutic landscape. RSC Chem Biol. 2021 Jun 21;2(4):1158-1166.
[8] Buratti E. Targeting TDP-43 proteinopathy with drugs and drug-like small molecules. Br J Pharmacol. 2021 Mar;178(6):1298-1315.
[9] ALS News Today. (n.d.). ALS Gene Therapy SOL-257 Targeting TDP-43 Shows Promise in Mouse Model. Retrieved from https://alsnewstoday.com/news/als-gene-therapy-sol-257-targeting-tdp-43-shows-promise-mouse-model/
[10] ALS News Today. (n.d.). Vectory Raises Millions to Advance ALS Antibody Therapy TDP-43. Retrieved from https://alsnewstoday.com/news/vectory-raises-millions-advance-als-antibody-therapy-tdp-43
[11] ALS News Today. (n.d.). Takeda Acquires License for ALS Therapy Aimed at Toxic TDP-43. Retrieved from https://alsnewstoday.com/news/takeda-acquires-license-als-therapy-aimed-toxic-tdp-43/




영업일 기준 1-2일 내에 답변해 드리겠습니다.