

가족성 고콜레스테롤혈증(familial hypercholesterolemia, 이하 FH)의 특징은 현저하게 높아진 저밀도 지질 단백질 콜레스테롤(LDL-C) 수준과 심혈관 질환의 조기 발생이다. FH는 저밀도지단백수용체(LDLR), 아포 지단백 B(APOB) 서브틸리신전환효소 9 (PCSK9)를 암호화하는 유전자의 돌연변이로 인해 발생하는 상염색체 우성 유전질환이며 유전자 선량효과를 가지고 있다. 그중 FH의 90 %는 LDLR 돌연변이에 의해 발생한다. LDLR의 돌연변이는 기능성 LDLR의 발현 수준을 낮추고 혈액 순환에서 LDL-C를 제거하는 간의 능력이 떨어져 혈액 순환에서 과도한 LDL-C를 유발하여 죽상동맥경화반의 발생 및 발달로 이어진다. 죽상경화증의 심각 정도는 간 조직에서 저밀도 지질 단백질 수용체의 수준과 활성과 밀접한 관련이 있다.
대부분의 국가에서 동형접합 가족성 고콜레스테롤혈증(HoFH) 유병률은 100만분의 1이며 영유아기에 심각한 죽상경화증 및 심혈관 질환으로 빠르게 발전하여 조기사망으로 이어진다. 이형접합 FH 환자(HeFH)는 기능성 LDLR 단백질을 가지고 있기 때문에 현재의 FH 약물 치료(예: MG-CoA 환원 효소 억제제(스타틴 계열))는 보통 HeFH에만 효과가 있으며, 고강도 스타틴 계열 약물과 PCSK9 억제제는 HoFH 치료에 효과가 제한적이다. 이러한 차이는 낮은 수준의 LDLR 발현과 활성으로도 FH의 심각 정도와 발전 속도에 상당한 영향을 미칠 수 있음을 나타낸다.
CRISPR/Cas9 시스템은 DNA 수준에서 병리학적 돌연변이를 교정할 수 있는 효과적인 유전자 편집 도구이며 유전자 결함으로 인한 인간 질병에 대한 유망한 치료법이다. 아데노관련바이러스(AAV)는 높은 안전성과 안정적인 장기 발현으로 인해 가장 유망한 유전자 치료 벡터로 간주된다. AAV를 이용한 유전자 치료는 현재 80개 이상의 질병에 허용돼 임상시험에 사용되고 있다.
2019년 11월 29일, 중국과학원 생물화학과 세포생물학연구소의 주빈(周斌) 과제팀과 교통대학 국제부녀아동보건원의 황하봉(黃荷鳳)팀은 Circulation에 “In Vivo AAV-CRISPR/Cas9-mediated Gene Editing Ameliorates Atherosclerosis in Familial Hypercholesterolemia”이라는 제목의 논문을 발표하였으며, 대학원생 조환(趙歡) 등이 제1저자로 병렬되었다. 논문에서는 AAV-CRISPR/Cas9 시스템이 Ldlr 돌연변이를 가진 마우스(Cyagen에 의해 구축됨)에 대해 LDLR 유전자 교정을 진행하면 LDLR 발현을 일부 복구할 수 있고 LDLR 돌연변이체 중의 죽상경화증을 효과적으로 개선할 수 있음을 발견하여 FH환자의 치료에 잠재적인 치료 방법을 제공하였다.
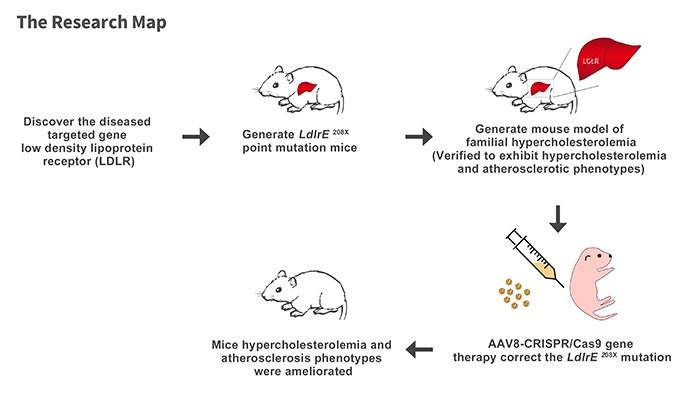
Figure 1. The Research Map
AAV-CRISPR/Cas9 시스템에 의해 수행된 생체내 체세포 유전자 편집이 마우스 모델에서 Ldlr 돌연변이로 인한 FH를 치료할 수 있는지 확인하기 위해 연구자들은 LDLR 게놈에서 넌센스 돌연변이를 가진 가족성 고콜레스테롤혈증을 앓고 있는 개체를 기반으로 마우스 strain LdlrE208X를 제작했다. 이 마우스는 LDLR 유전자의 네 번째 엑손에 넌센스 돌연변이를 가지며 고지방식이를 먹은 후에는 간에서 LDLR 단백질 발현이 없으며 심각한 죽상경화증이 발생한다.
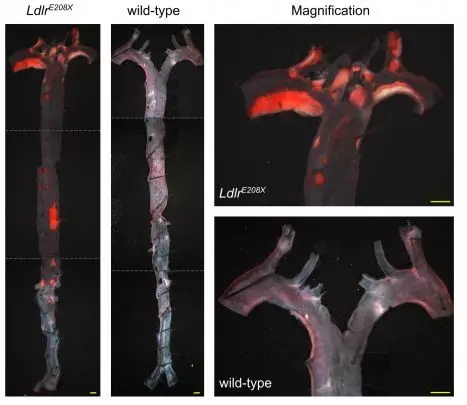
Figure 2. 대동맥 죽상경화성 병변의 Oil-red O staining 이미지 및 마우스의 혈장 총콜레스테롤, 총트리글리세리드 및 저밀도 지단백 콜레스테롤 수준 비교
AAV-CRISPR/Cas9 시스템을 사용하여 LdlrE208X 마우스에서 유전자 편집을 수행함으로써 일부 간세포의 Ldlr 돌연변이를 교정하였으며, 이 중 LDLR 단백질 발현이 부분적으로 회복되었다(n = 6). 대조그룹(n = 6)에 비해 AAV-CRISPR/Cas9 시스템으로 처리된 LdlrE208X 마우스(n = 6) 혈청에서의 총콜레스테롤, 총트리글리세리드 및 LDL-C 수준이 현저히 낮아졌고 대동맥궁 죽상동맥경화반이 작다. 또한 대식세포 침윤 정도가 낮으며 LdlrE208X 마우스에서 간 지방 축적을 효과적으로 감소시킨다. 이러한 결과는 AAV-CRISPR/Cas9 시스템을 통한 생체내 유전자 편집이 HoFH에 대한 유망한 치료가 될 수 있으며 기존 지질강하제의 치료 효과를 개선하는 데 도움이 될 수 있음을 나타낸다.
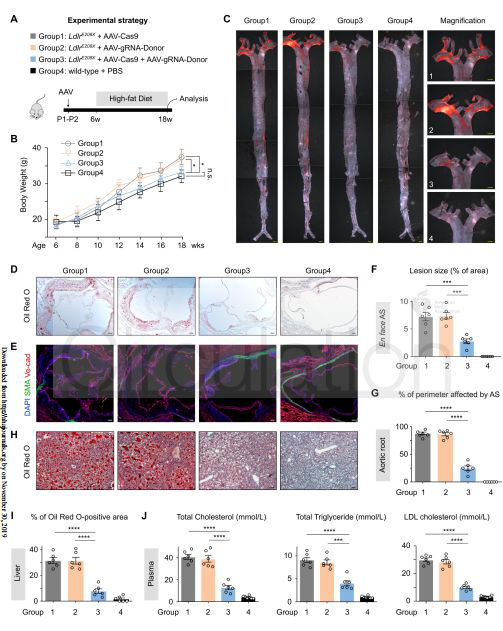
Figure 3. Atherosclerosis in Ldlr-E208X mice after a high-fat diet regimen.
이 연구는 AAV-CRISPR/Cas9 시스템이 체세포 유전자 돌연변이를 교정하는 효과적인 방법임을 입증했다. 전장유전체분석의 비용이 낮아지면서 가족 구성원과 태아에 대한 선별 검사가 보다 편리하고 쉬워질 것이다. 따라서 질병 진행 초기 단계에서 FH를 확인할 수 있어 유전자 교정을 통해 조기 치료가 가능하다. 앞으로 AAV에서 제공하는 CRISPR/Cas9 시스템은 유전성 심혈관 질환 중 일부 체세포의 유전자 돌연변이를 교정하여 질병을 개선하거나 심지어 완치하는 데 사용할 수 있습니다.




영업일 기준 1-2일 내에 답변해 드리겠습니다.