

많은 고령자가 나이가 들어감에 따라 눈에 띄는 시력 저하를 경험하지만 시야 중심부의 세세한 부분을 볼 수 없는 것은 노년기 황반변성(AMD)의 징후일 수 있습니다. AMD 증상이 있는 사람은 휴대전화를 보거나 신문을 읽을 때 색상이 덜 선명하고 문자가 흐리게 보일 뿐만 아니라 때로는 사물이 구별할 수 없는 덩어리로 보이기 시작한다는 것을 알게 됩니다. 나중에는 문자 뿐만 아니라 인물과 풍경도 비뚤어지거나 물결 모양으로 보이기 시작합니다. 사람들은 이러한 증상이 노안이 악화된 것 때문이라고 잘못 생각하는 경우가 많지만 실제로는 황반변성의 증상일 가능성이 높습니다.
노년기 황반변성(AMD) 은 고령층에서 영구적이고 비가역적인 시력 상실을 일으키는 주요 원인입니다. 이는 환자의 중심 시력 상실을 초래하는 황반의 퇴행성 질환으로, 읽기, 운전, 얼굴 및 색상 인식과 같은 환자의 시각 기능에 영향을 미칩니다. 하지만, 초기 또는 중기 AMD 환자 중 상당수에서는 증상이 나타나지 않기 때문에 시각이 매우 흐려질 때까지 자신에게 질환이 있다는 사실을 깨닫지 못합니다. 황반변성은 다인성 질환으로 관련 기전은 아직 밝혀지지 않았지만 장기적인 빛 손상, 유전, 신진대사, 만성 염증, 면역 반응 및 그 외 요인이 모두 황반변성을 유발할 수 있는 것으로 여겨지고 있습니다.
AMD 는 임상적으로 건성(비삼출성 또는 위축성) AMD와 습성(삼출성 또는 신생혈관성) AMD의 두 가지 주요 범주로 분류됩니다. 건성 AMD는 맥락막하 드루젠(drusen) 침전과 지도 모양 위축(geographic atrophy)이 특징이며 습성 AMD는 맥락막 신생혈관 형성 및 황반 손상이 특징입니다.
건성 AMD는 망막색소상피(retinal pigment epithelium)에 변성을 일으키며 일반적으로 어두운 핀 모양 반점 부위로 나타납니다. 발병 기전은 광수용체, 망막색소상피(retinal pigment epithelium, RPE) 및 맥락막 모세혈관층의 느린 진행성 위축입니다. 간단히 비유하면, 황반 부위에 드루젠(drusen)이라고 하는 검버섯과 비슷한 것이 생기는 것과 유사합니다. 이러한 드루젠(drusen)이 완전 실명을 초래하지는 않지만 중심 시력을 상실할 수 있습니다. 건성 AMD의 경우 비교적 느리게 발병하는 경향이 있으며 초기에는 증상이 없다가 점진적으로 양안 시력이 상실되고 시각 왜곡이 발생합니다.
습성 AMD의 경우 맥락막 신생혈관(비정상적인 혈관 형성)이라는 과정을 통해 망막 안쪽에 비정상적인 새 혈관이 생깁니다. 습성 AMD는 빠르게 진행되며 제때 치료하지 않으면 단기간에 시력이 급격히 저하되고 심하면 실명에 이를 수 있습니다.
AMD 동물 모델의 구축은 발병 기전을 심도 있게 이해하는 데 큰 의미가 있습니다. Cyagen은 유전자 편집, 레이저 모델링, 약물 유도 등을 통해 구축된 AMD 동물 모델을 제공할 수 있습니다.
Cyagen이 신생혈관성 AMD 질환을 위해 구축한 인간화 VEGF(hVEGF) 과발현 형질전환(TG) 마우스 모델은 안구 구조를 온전하게 유지하면서 명백한 병변이 나타나는 등 관련 질환 병리를 자발적으로 진행시킬 수 있어 신생혈관성 AMD 질환의 약물 평가 및 관련 연구에 사용될 수 있습니다.
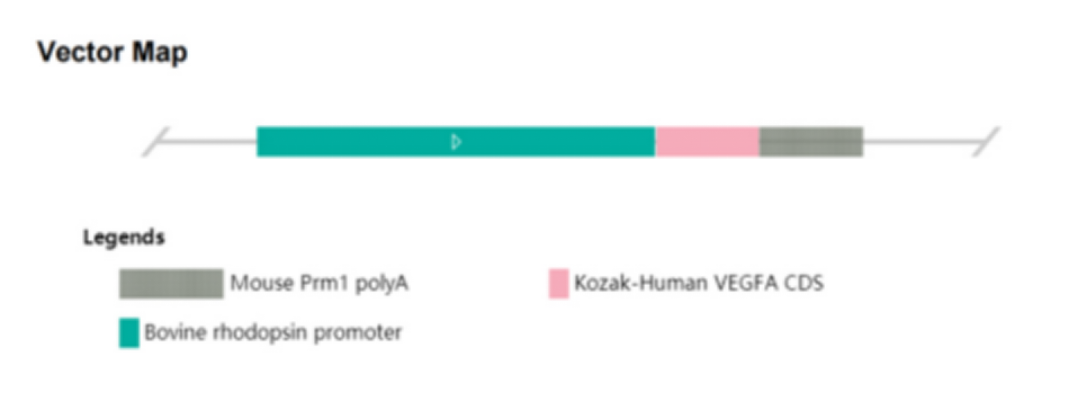
그림 1. 인간화 VEGFA
과발현 마우스(TG) 구축 전략의 구성도.

그림 2. 6주령 및 7주령 hVEGF 형질전환 마우스(F0 세대, TG)의 FFA, 결과는 F0 세대 hVEGF 마우스의 안구가 FFA 검출에서 명백한 국소 플루오레세인 누출 및 명백한 혈관 병변을 나타낸다는 점을 보여주었습니다. 병변은 주령이 증가함에 따라 지속되었습니다.
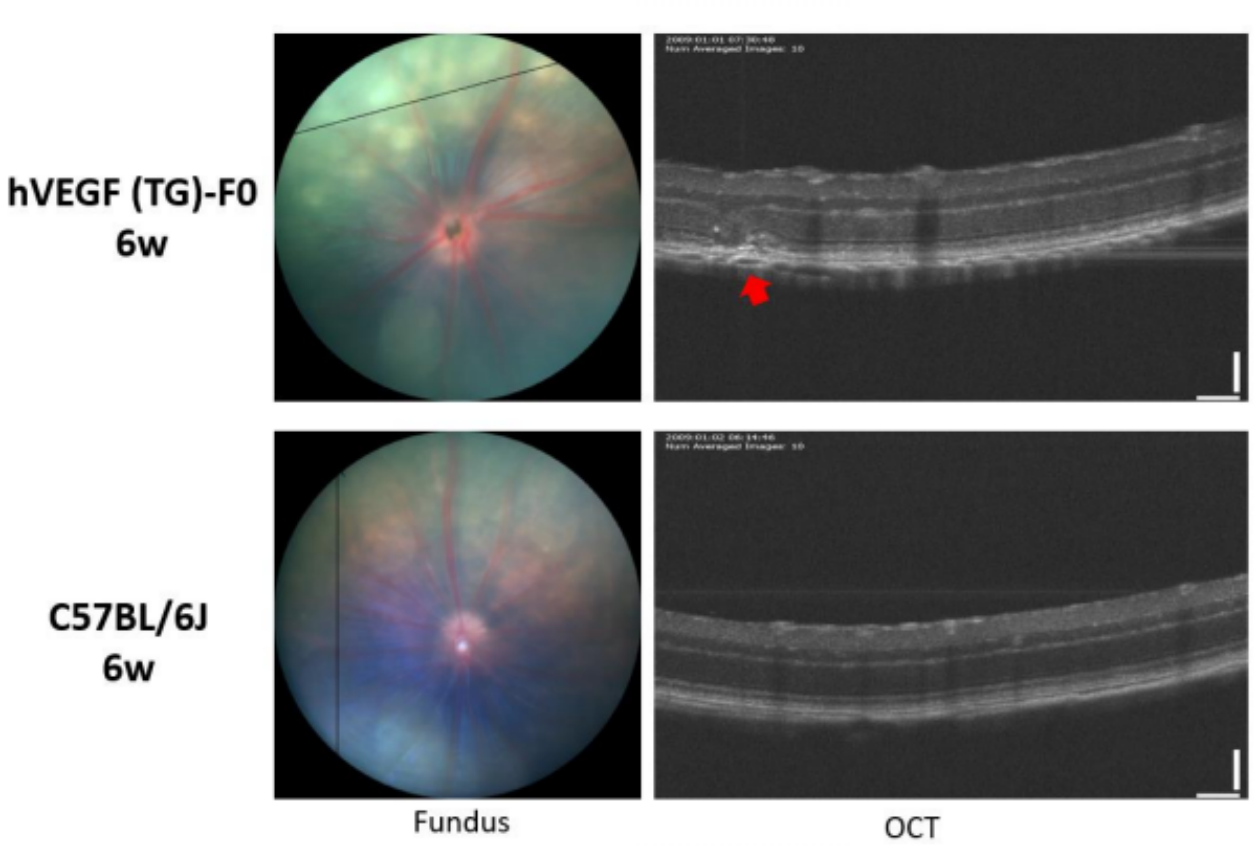
그림 3. 6주령 hVEGF 마우스(F0 세대, TG)의 광간섭단층영상(optical coherence tomography, OCT) 결과로, 동일한 연령의 C57BL/6J 마우스와 비교했을 때 F0 세대 hVEGF 마우스의 안구는 OCT 검출에서 망막 맥락막층에 국소적으로 구조적 장애가 나타났습니다.

그림 4. 6주령 hVEGF 마우스(F0 세대, TG)의 망막전도(electroretinogram, ERG) 결과로, 동일한 연령의 C57BL/6J 마우스와 비교했을 때 F0 세대 hVEGF 마우스의 ERG 결과는 이러한 차이를 보이지 않았으며, 이는 현재 병변의 정도가 광수용체에 영향을 미치지 않았다는 것을 의미합니다.
Cyagen은 고전적인 레이저 광응고술(photocoagulation)을 통해 레이저를 사용하여 외부 망막과 브루크막(Bruch's membrane)을 파괴하여 맥락막 신생혈관(choroidal neovascularization, CNV)을 형성하는데, 이는 신생혈관성 AMD(습성 황반변성으로도 불림)에서 관찰되는 특징적인 병리를 모방한 것입니다. CNV의 발생률은 형광안저조영술(Fundus fluorescein angiography, FFA), OCT 스캔, 병리 조직 슬라이드 관찰을 통해 평가할 수 있습니다.
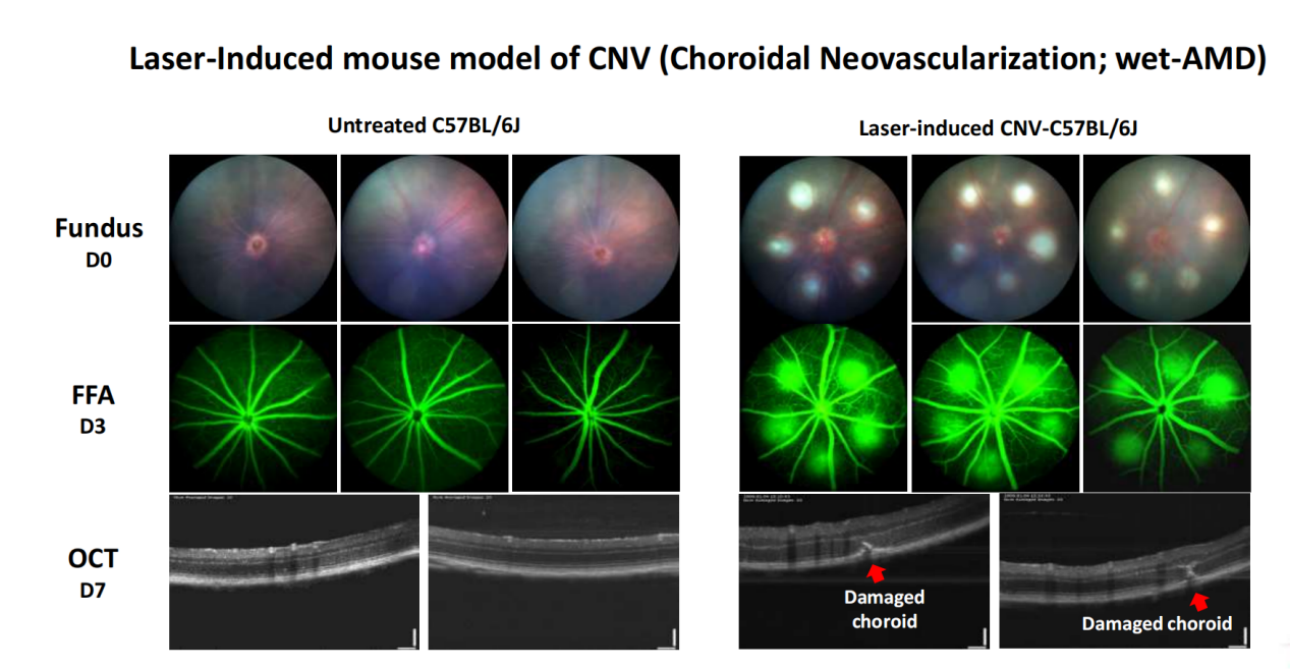
그림 5. 레이저 유도 CNV(맥락막 신생혈관)는 신생혈관성 AMD에서 관찰되는 특징적인 병리를 모방하는 혈관 신생을 유도하는 RPE 및 브루크막(Bruch's membrane)의 안저 레이저 광응고술에 의한 표적 레이저 손상을 초래합니다. 수술 3일 후 시행한 FFA의 결과에 따르면, 자극 부위에 뚜렷한 윤곽선과 함께 상당한 플루오레세인 누출이 있었으나 유전자 편집(형질전환) 모델에 비해 병변이 더 짧은 시간 동안 지속되어 수술이 더 어려웠으며 재현성이 떨어졌습니다.
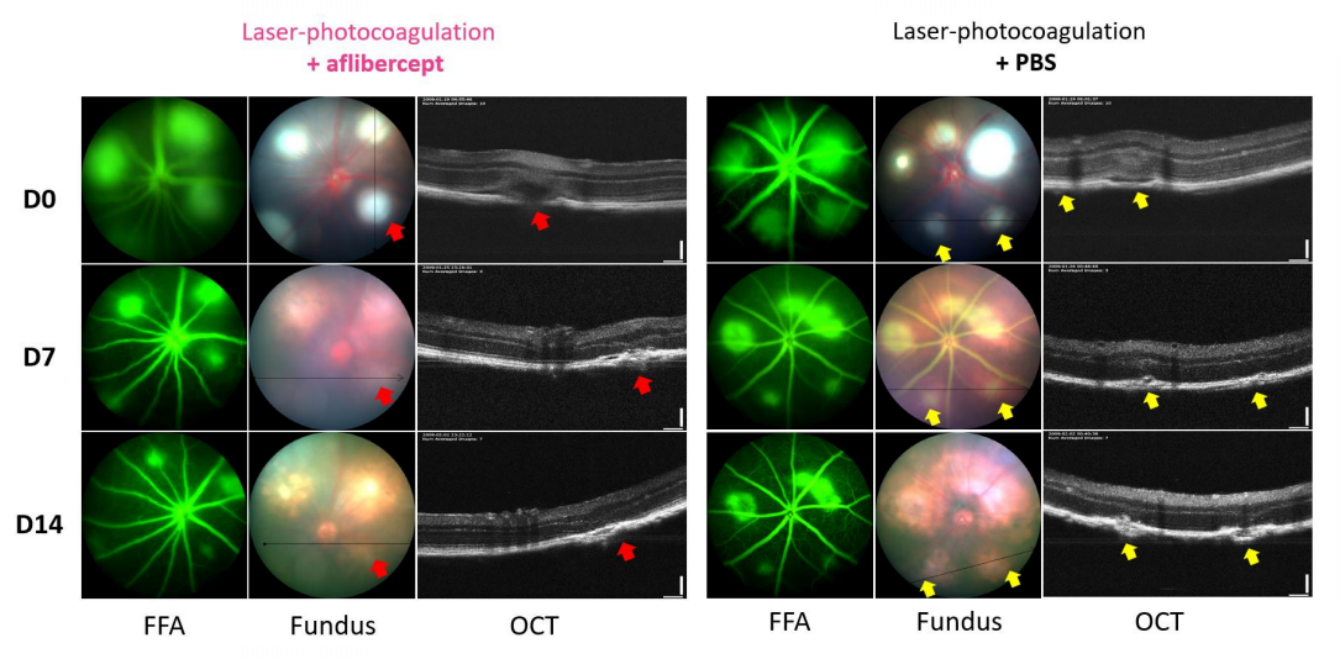
그림 6. 유리강을 통해 주입한 애플리버셉트의 유효성 시험 결과는 위 그림과 같습니다.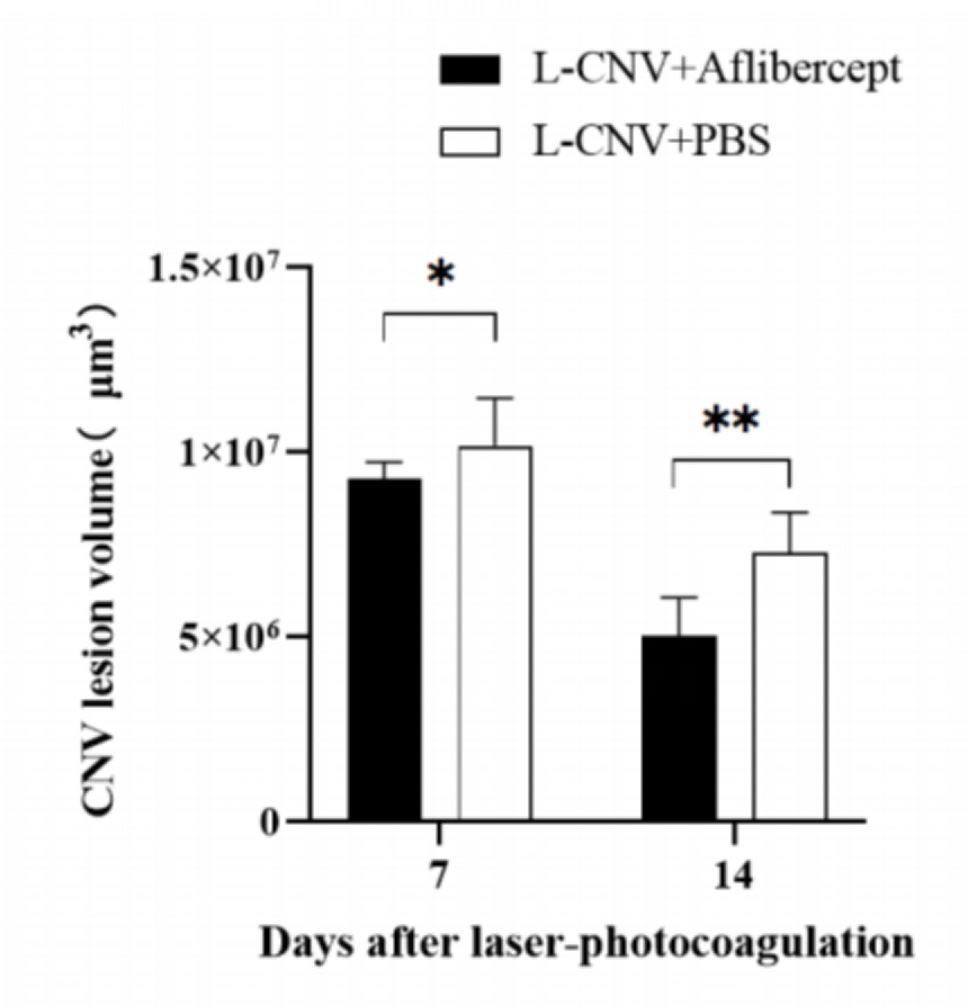
그림 7. OCT 검사 결과에 따르면, 애플리버셉트 주입 후 7일 차와 14일 차에 L-CNV 병변의 부피가 PBS 주입 대조군의 데이터에 비해 유의하게 감소한 것으로 나타났습니다.
Cyagen은 요오드화나트륨(NaIO3)을 사용하여 건성 AMD 마우스 모델을 유도합니다. 마우스의 꼬리 정맥에 NaIO3를 주입한 후 건성 AMD(dAMD)의 표현형, 즉 망막색소상피(RPE)와 광수용체의 진행성 황반변성이 나타났습니다.
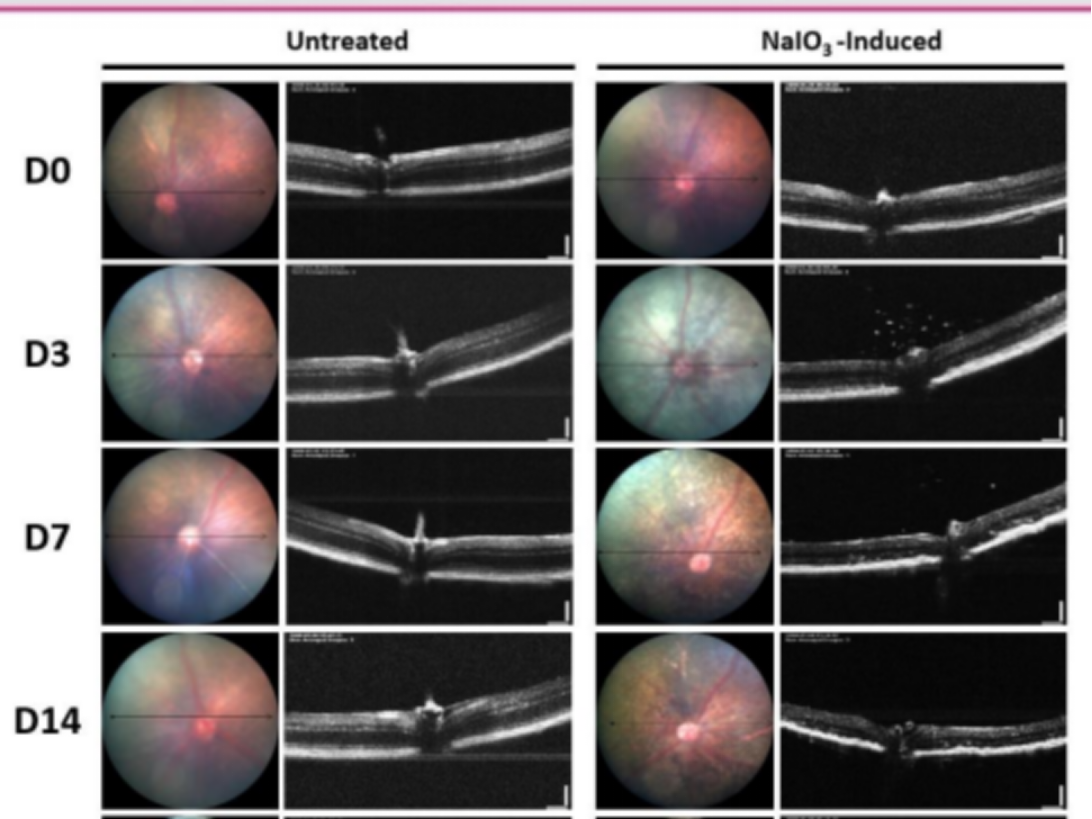
그림 8. NaIO3를 투여한 마우스의 3일 차, 7일 차, 14일 차 검안경 검사 영상에서 0일 차에 비해 망막 색소 손실 면적이 증가했으며 OCT 영상에서는 전체 망막 두께가 0일 차에 비해 치료 전보다 현저히 감소한 것으로 나타났습니다.
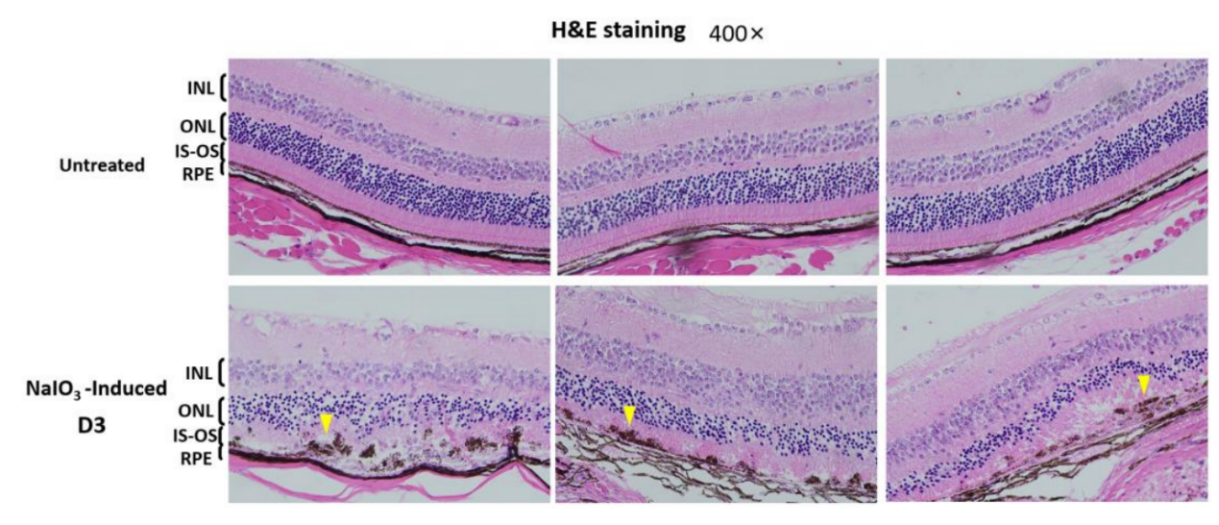
그림 9. NalO3는 RPE 세포층의 무결성을 저해합니다. 마우스 망막 단면을 H&E 염색한 결과, NaIO3 꼬리 정맥 주입 후 3일 차에 RPE 층의 파열, 고르지 못한 RPE의 손실, RPE 세포 응집(HE 염색 노란색 화살표), 광수용체 세포 변성이 관찰되었으며 NaIO3를 투여한 마우스의 중심 망막 내 광수용체 핵의 개수가 3일 차에 현저하게 감소했고 외핵층(outer nuclear layer, ONL) 두께가 얇아졌습니다.

그림 10. TUNEL 염색 결과는 광수용체 세포의 사멸을 보여주며 이는 광수용체 세포의 퇴화를 시사합니다.

그림 11. NaIO3 주입 후 3일 차의 근전도 기록을 통해 망막 기능을 분석한 결과에 따르면, NaIO3 투여군은 미투여 대조군에 비해 암순응 및 명순응 a파 및 b파 진폭이 유의하게 감소했습니다.
Cyagen은 맞춤형 동물 모델 분야에서 16년간의 업력을 보유하고 있으며, 안과 질환(예: 망막색소변성증(RP), 망막변성, 레버 선천성 흑암시 2(Leber congenital amaurosis 2, LCA2), 황반변성, 레버 선천성 흑암시 10(Leber congenital amaurosis 10, LCA10), 각막내피이상증(endothelial corneal dystrophy)을 대상으로 하는 일련의 유전자 변형 녹아웃(KO), 녹인(KI), 형질전환(TG), 편집, 인간화 마우스 모델을 독자적으로 개발했습니다. 당사는 또한 유전자 조작 마우스 모델, 완전 인간화 마우스 모델, 수술 모델을 맞춤 개발하기 위해 협력하여 귀사의 전임상 약력학 평가를 가속화할 수 있습니다.
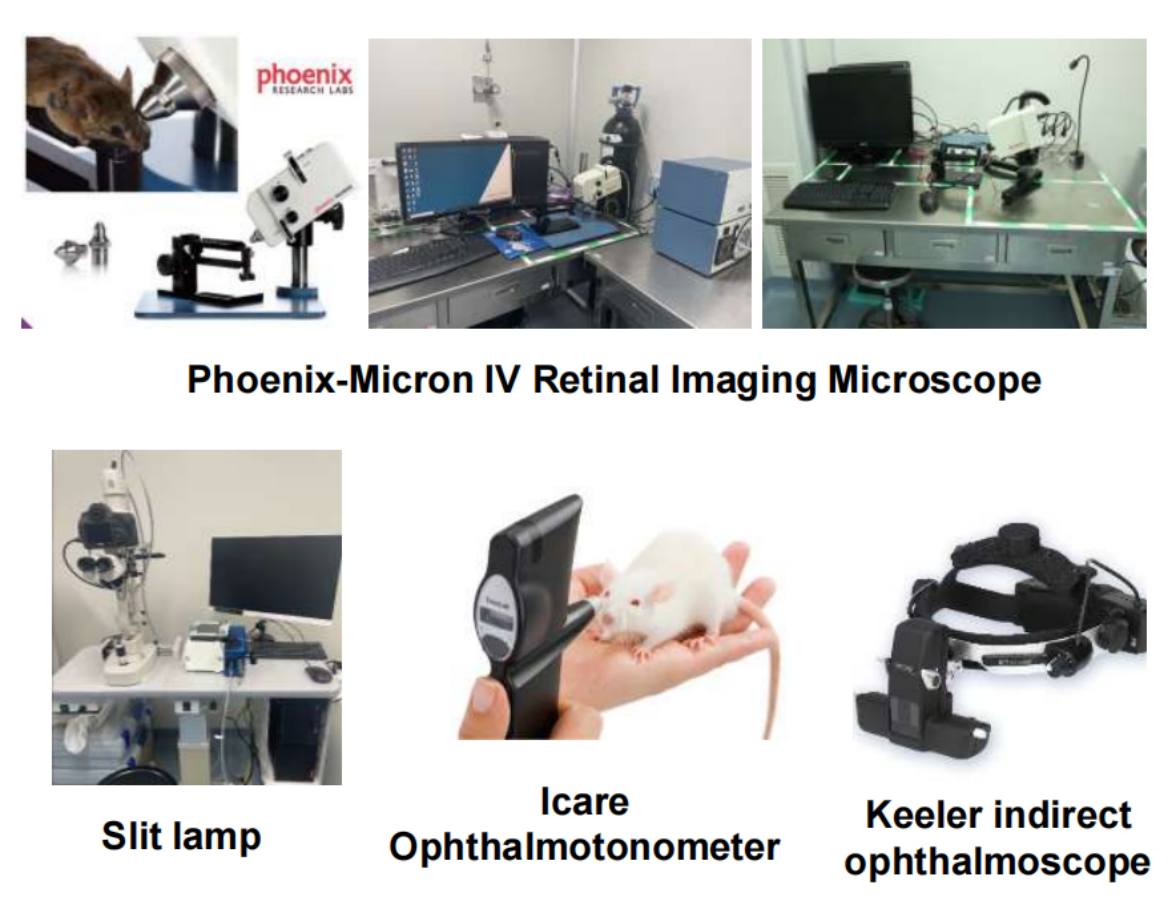
Cyagen은 동물 모델 외에도 안구 주입 및 투여, 물질 샘플링, 검출 및 분석, 유효성 평가 등을 포함한 일련의 전임상 안과 약력학 분석 서비스를 제공할 수 있습니다. 무료로 받을 수 있는 프로젝트 상담을 원하시는 경우 86 20-31601779 또는 이메일(service-apac@cyagen.com)로 문의하시기 바랍니다.
|
자체 개발한 안과 질환 모델 목록 |
||
|
질환 |
표적 유전자 |
표적 유형 |
|
노년기 황반변성 (Age-related Macular Degeneration) |
hVEGFA |
KI, TG, 인간화 |
|
황반변성 (Macular Degeneration) |
ABCA4(ABCR) |
KO, 인간화 |
|
망막색소변성증 (Retinitis Pigmentosa) |
Tub |
KO |
|
만성망막변성증 (Chronic Retinal Degeneration) |
Prph2 |
KO |
|
레버 선천성 흑암시 2 (Leber congenital amaurosis 2) |
Rpe65 |
KO, MU |
|
레버 선천성 흑암시 4 (Leber congenital amaurosis 4) |
Aipl1 |
KO |
|
레버 선천성 흑암시 10 (Leber congenital amaurosis 10) |
CEP290 |
인간화 |
|
레버 선천성 흑암시 13 (Leber congenital amaurosis 13) |
Rdh12 |
KO |
|
망막색소변성증 (Retinitis Pigmentosa) |
RHO |
KO, CKO |
|
인간화, 인간화(MU) |
||
|
망막색소변성증 (Retinitis Pigmentosa) |
Mertk |
KO, CKO |
|
망막색소변성증 (Retinitis Pigmentosa) |
Rpgr |
KO |
|
망막색소변성증 (Retinitis Pigmentosa) |
Crb1 |
KO |
|
망막색소변성증 (Retinitis Pigmentosa) |
Rd1(Pde6b) |
KO, MU |
|
망막색소변성증 (Retinitis Pigmentosa) |
Rd10(Pde6b) |
MU |
|
망막색소변성증 (Retinitis Pigmentosa) |
RP2 |
KO, CKO |
|
색맹 (Achromatopsia) |
Cnga3 |
CKO |
|
각막내피이상증 (Corneal Endothelial Dystrophy) |
TCF4 |
CKO, 인간화 |
|
무홍채증 (Aniridia) |
Pax6 |
CKO |
|
범맥락막위축 (Choroideremia) |
Chm |
CKO |
|
어셔 증후군 (Usher Syndrome) |
USH2A |
인간화, 인간화(MU) |
|
어셔 증후군 (Usher Syndrome) |
Myo7a |
CKO |
|
난황형 황반부 이영양증(Vitelliform Macular Dystrophy) |
Best1 |
KO |
|
유년기 망막층간분리증 (Juvenile Retinoschisis) |
Rs1 |
KO, CKO |
|
제1형 범발성 백색증(Oculocutaneous Albinism Type 1) |
Tyr |
CKO |
|
제3형 범발성 백색증(Oculocutaneous Albinism Type 3) |
Tyrp1 |
KO, CKO |
|
볼프람 증후군 (Wolfram Syndrome) |
Wfs1 |
KO, CKO |
|
탄력섬유성위황색종 (Pseudoxanthoma Elasticum) |
Abcc6 |
KO, CKO |
Cyagen은 동물 모델 외에, 안과 유전자 치료가 직면한 장기적인 난제를 해결하기 위해 안과 유전자 치료 플랫폼도 개발했습니다. 당사의 플랫폼은 최첨단 정제 소동물 안과 장비와 선임 전문 인력을 갖추고 안구 주입 및 투여, 물질 샘플링, 검출 및 분석, 유효성 평가 등을 포함한 포괄적인 전임상 안과 약력학 분석 서비스를 제공하고 있습니다. 무료로 받을 수 있는 프로젝트 상담을 원하시는 경우 800-921-8930 또는 이메일(animal-service@cyagen.com)로 문의하시기 바랍니다.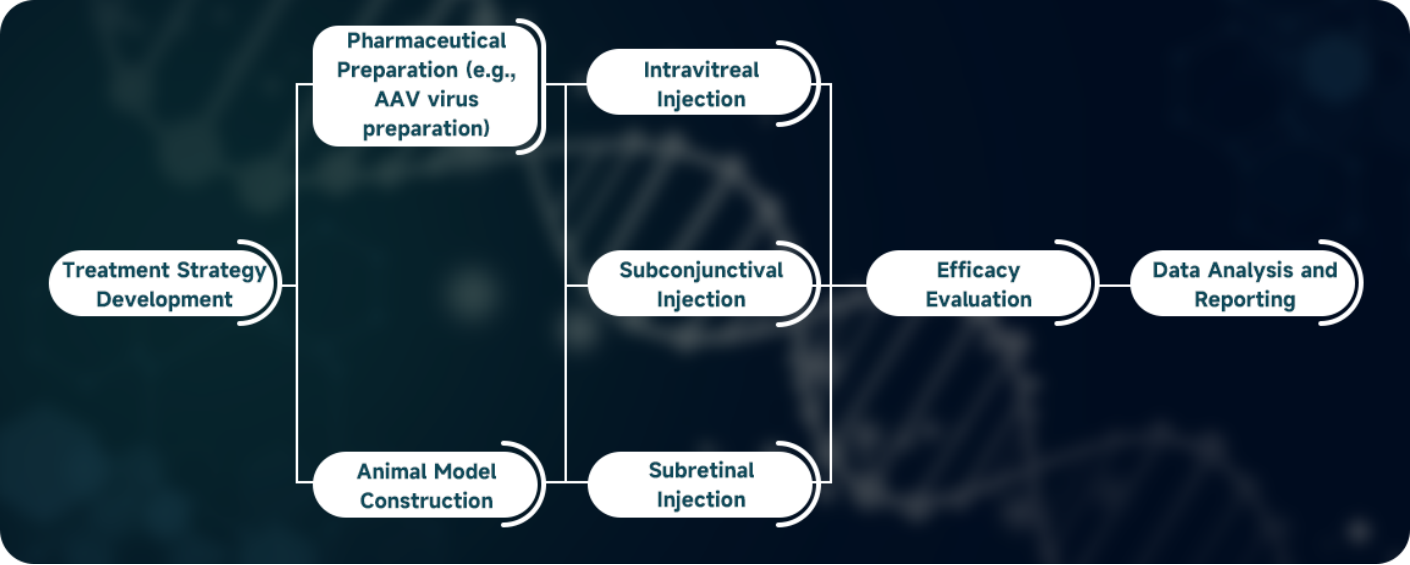
모든 관련 당사자의 노력을 통해, 보다 많은 유전자 치료법이 임상시험에 진입하여 선천성 시각 장애인들이 하루 빨리 앞을 볼 수 있기를 진심으로 기원합니다.




영업일 기준 1-2일 내에 답변해 드리겠습니다.