

【희귀병의 열 가지 죄】특집에서 희귀병의 발생, 발전 메커니즘, 산업 연구 진전(유전자 치료 등), 성과를 임상 전 단계로 전환하는 혁신 전략(모델 구축 및 약물 스크리닝 등)을 소개합니다.
지난 회 되돌아보기:
❖RHO 및 관련 병원성 메커니즘은 무엇입니까? RHO 유전자 치료의 연구 진행 상황은 어떻습니까?
❖희귀병의 열 가지 죄2: 왜 차세대 인간화 마우스 모델이 ‘남성이 많고 여성이 적은’ 혈우병 연구에 더 효과적인지 원인 분석
❖루게릭병 ALS와 밀접한 관계가 있는 발병 유전자 TARDBP는 과연 천사인가 악마인가?
❖근이영양증 '사천왕' 관련 질환에 관한 연구 [희귀병 10종죄 4]

SMA환자는 휠체어로 이동 가능
매년 8월 7일은 '국제 SMA 환자의 날'로써, 척수성 근위축증(Spinal Muscular Atrophy, SMA)은 척수전각의 1차성 변성에 따라 근력저하, 근위축 및 섬유속성 연축을 일으키는 염색체 열성 유전병으로 영유아 시기에 흔한 치사성 신경 유전병으로 발병률은 약 1/6000-1/10000입니다.
현재 SMA 질병에 대한 치료 약물이 많지 않은 상황에서 유전자 치료는 환자에게 어느 정도 긍정적인 효과를 가져다줍니다. 아시나요? 이와 같은 신기한 요법의 응용에서 유전자 SMN2가 중요한 역할을 해서 조연에서 주연으로 역전하는 역주행을 실현했다고 합니다.
SMA질병의 발병 메커니즘
인간 게놈에는 상동성이 높은 SMN1 유전자 및 SMN2 유전자가 있는데, 단지 몇 개 염기의 차이만 있습니다. 그러나 SMN2 유전자 중의 7번 엑손의 핵심적인 염기 차이 c.840C>T로 인해, 두 유전자에 의해 전사된 pre-mRNA의 스플라이싱 방식을 달라지게 함에 따라, SMN2 유전자가 주로 7번 엑손이 결실된 불안정한 SMNΔ7 단백질[1]을 생성시키도록 합니다.
대부분의 SMA 환자는 SMN1 유전자 변이가 있는 반면, 고도 동원의 SMN2 유전자는 충분한 전장 SMN 단백질을 생산시키지 못해 SMN1 유전자의 기능적 결실을 보완시킬 수 없기 때문에 발병을 초래하게 되는 것입니다. 그러므로 SMN 단백질(SMN protein)의 생산 과정에서 SMN1을 주연, SMN2를 조연으로 여길 수 있습니다.
SMA 질병 관련 유전자 치료
현재 SMA 질병의 치료법은 주로 보충 치료법 및 SMN2를 표적으로 하여 스플라이싱 방식을 바꿈으로써 SMN 전장 단백질의 발현을 증가시키는 것입니다. 해당 과정에서 조연(SMN2)은 개조를 통해 치료 주연으로 역전할 수 있으므로 SMN 전장 단백질을 표현하려고 합니다. 예를 들어, Ionis의 ASO 약물인 스핀라자주(Nusinersen sodium)는 SMN2 유전자 전사에 의해 형성된 mRNA와 결합함으로써 RNA 스플라이싱 과정을 변경하여 정상 SMN 단백질의 발현을 증가시킵니다[2].
SMA 관련 전임상 연구에서 대부분의 질병 모델은 Δ7 마우스이고, 이는 삼중 동형의 유전자 변형 마우스입니다: Smn1-/-;SMN2tg/tg;SMNΔ7tg/tg. 관련 질병 약물에 대한 연구 개발을 촉진시키기 위해, Cyagon 바이오는 hSMN2 차세대 인간화 마우스 모델을 자체 개발하고, 마우스 내인성 Smn1 유전자를 인간 SMN2 유전자의 전장 단편으로 대체하여, 연구진에게 실제 생물학적 메커니즘에 더 가까운 인간 질병 모델을 제공할 수 있습니다.
hSMN2 차세대 인간화 마우스 모델 검증 데이터
1. hSMN2 차세대 인간화 마우스 모델 hSMN2, mSmn1의 발현 검사

그림 1 hSMN2 마우스 및 야생 마우스(B6N) 인간 SMN2 유전자, 마우스 Smn1 유전자 mRNA의 발현 검사
뇌와 간장 조직 qPCR 검사 결과에 따라, 대조 팀 B6N과 비교하여 hSMN2 마우스는 마우스 Smn1를 드러내지 않고 인간 hSMN2를 성공적으로 발현한다고 보여줍니다. (주: E7+& E7-는 모든 hSMN2의 전사본을 나타내며; E7-는 E7을 결실한 hSMN2 전사본을 의미합니다.)
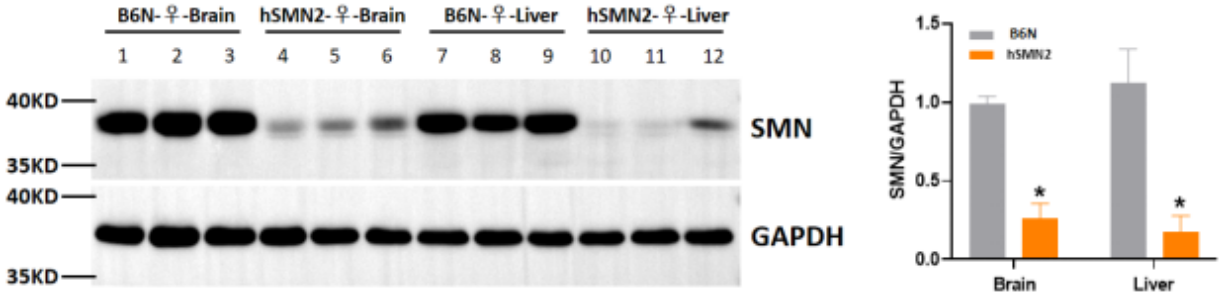
그림 2 hSMN2 마우스 및 야생 마우스의 SMN 단백질 발현 검사
hSMN2 마우스의 뇌와 간에서 SMN 단백질의 발현은 야생 마우스보다 확연히 낮아, hSMN2 마우스의 SMN 단백질 합성 능력이 감소함을 확인하였습니다.
1. hSMN2 마우스 체형 이상
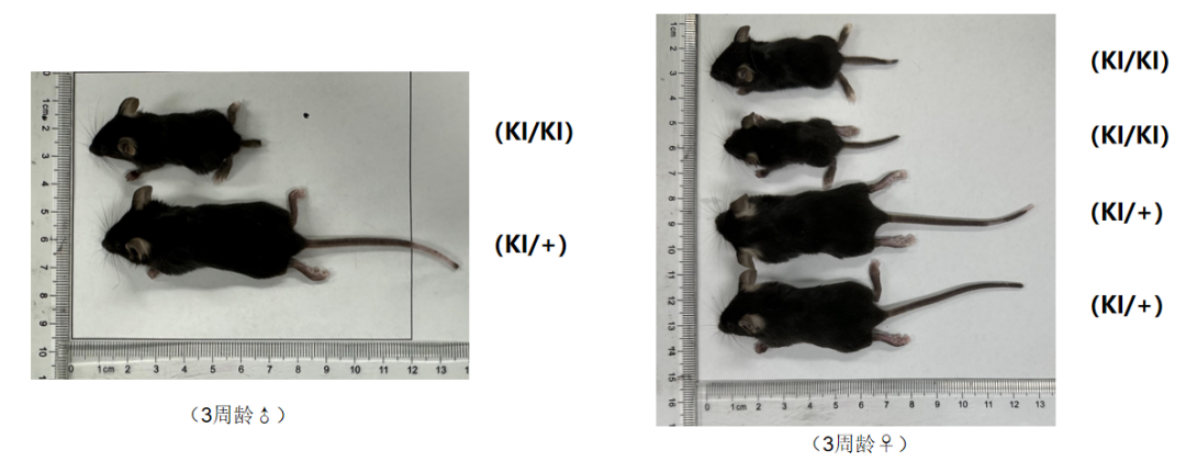
그림 3 마우스 신장 대조도
hSMN2 마우스는(KI/KI) 같이 태어난 마우스들과 비교하여 근육 위축과 함께 똑바로 서 있지 못해 몸집이 작아지고 신장이 짧아지며 꼬리가 잘 부러지는 현상이 더 많이 발생합니다.
2. hSMN2 마우스 근육 조직 이상
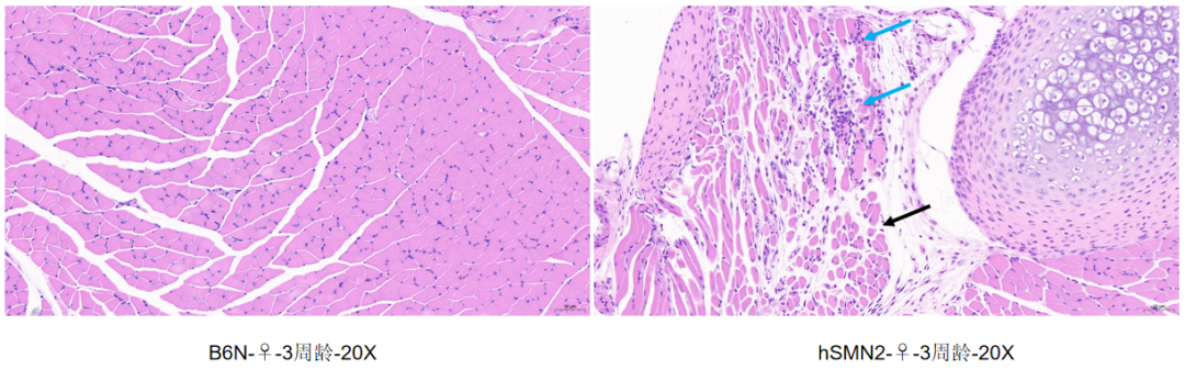
그림 4 근육조직 HE 염색
B6N 야생 마우스와 비교하여 hSMN2 마우스의 근육조직은 소량의 근세포 괴사, 세포질 붕괴, 극소량의 림프구 침윤(파란색 화살표)을 동반하고 주변에 근세포 위축, 부피 감소, 근세포 간격 확장 및 느슨한 배열(검은색 화살표)을 볼 수 있습니다.
요약하면, hSMN2 마우스는 인간 SMN2 유전자를 성공적으로 발현하였고, SMN 단백질의 발현은 대폭 감소하였으며, hSMN2 마우스의 근육 조직 및 체형 발달 이상은 SMA 환자의 일부 표현형을 성공적으로 재현했습니다.
HUGO-GTTM 차세대 인간화 마우스 모델 구축 프로젝트
척수성 근위축(SMA) 뿐만 아니라 망막색소변성(RP), 황반 변성(AMD), 파킨슨병(PD) 등과 같은 다양한 질병 유형에 대해 병원성 메커니즘을 깊이 연구하려면 긴 단편 또는 차세대 인간화 마우스 모델은 보다 더 나은 선택입니다. 그러나 전체 게놈 교체에 필요한 기술적 어려움이 크고 대규모로 도입된 외인성 서열은 기존의 유전자 발현 조절을 교란시킬 수도 있습니다.
이를 위해 Cyagen 바이오는 HUGO-GTTM 프로그램을 시작하여, 자체 개발한 TurboKnockout-Pro 기술을 기반으로 마우스 유전자를 제자리에서 교체하여 더 풍부한 개입 표적을 포함하는 전체 게놈 인간화 마우스를 성공적으로 구축하였습니다. HUGOTM 마우스는 보다 더 효율적인 큰 단위의 융합 기술을 이용하여 어떤 경우에도 적용될 수 있는 템플릿으로서 현실 세계 바이오 메커니즘으로 사용할 수 있으며 현실 세계 생물 메커니즘에 더 가깝게 만드는 약물 임상 연구 모델을 탑재하였습니다.
비고: HUGO-GT는 Humanized Genomic Ortholog for Gene Therapy 의 약자입니다.

코드 스캔 상담/협력 상담
아래 그림 클릭해서 더 자세히 알아보실 수 있습니다

참고 문헌:
[1]Gladman JT, Chandler DS. Intron 7 conserved sequence elements regulate the splicing of the SMN genes. Hum Genet. 2009 Dec;126(6):833-41. doi: 10.1007/s00439-009-0733-7. PMID: 19701774; PMCID: PMC2891348.
[2]Hill SF, Meisler MH. Antisense Oligonucleotide Therapy for Neurodevelopmental Disorders[J]. Dev Neurosci. 2021;43(3-4):247-252. doi: 10.1159/000517686.




영업일 기준 1-2일 내에 답변해 드리겠습니다.