

폐암은 전 세계적으로 가장 흔한 암이며 2020년에 전 세계적으로 220만 건 이상의 새로운 폐암 사례가 발생할 것입니다. 국립암센터가 발표한 데이터에 따르면 2015년 이전에 폐암 환자와 사망자는 우리나라 악성 종양 중 1위를 차지했습니다. 폐암의 높은 발병률과 치사율은 세계 공중 보건에 큰 부담을 주고 있으며 더 많은 임상 및 전 임상 연구가 시급합니다.

그림 1. 1990년부터 2015년까지 중국에서 가장 흔한 암 10종의 사망률 [1]
유전자 돌연변이와 폐암 발생
폐암은 비소세포폐암(NSCLC)과 소세포폐암(SCLC)의 두 가지 조직학적 하위 유형으로 나뉘며, 비소세포폐암(NSCLC)은 전체 폐암의 약 85%, 소세포폐암(SCLC)은 15%를 차지합니다. 비소세포폐암(NSCLC)은 폐선암(LUAD), 폐편평 세포암(LSCC) 및 대세포폐암(LCC)으로 나눌 수 있습니다. KRAS는 NSCLC에서 가장 흔한 병원성 유전자로 정상세포에서 세포성장신호의 정보중심으로 작용하여 암을 억제하는 역할을 하며 돌연변이는 KRAS를 지속적으로 활성화시켜 세포의 통제되지 않은 증식을 유발하고 NSCLC에서 선암으로 발전합니다. KRASG12D는 폐암에서 흔히 볼 수 있는 돌연변이이며 다양한 폐암 모델의 구축도 KRASG12D 과발현 마우스를 기반으로 합니다 [2-3].

그림 2. 비소세포폐암(NSCLC)에서 흔히 볼 수 있는 병원성 유전자 [2]
최근 Ferone 등은 다양한 폐암 마우스 모델의 특성을 요약하고 마우스 폐암 모델에서 종양 이질성, 침식성 및 치료 반응/약물 내성과 같은 특성이 기원 세포와 유전적 병변에 의해 결정된다는 것을 발견했습니다. 예를 들어, 연구에 따르면 KRAS 또는 EGFR 병원성 돌연변이를 운반하는 유형 II 폐포 세포가 LUAD의 주요 기원인 반면 돌연변이를 운반하는 클럽 세포의 증식은 유두 종양 표현형[4-5]을 더 많이 나타냅니다.
SFTPC는 II형 폐포 세포의 마커 유전자로, Cyagen은 조건적으로 KRASG12D 돌연변이를 과발현하는 LSL-K-rasG12D 마우스를 Sftpc-MerCreMer 마우스와 교배하여 자손을 생성하고 타목시펜 유도를 통해 KRASG12D 돌연변이에 의해 구동되고 SFTPC 양성 II형 폐포 세포에서 유래한 KS 폐암 마우스 모델을 얻었습니다.
타목시펜(Tamoxifen) 처리 6주 후 KS 생쥐의 폐에 뚜렷한 종양 조직 침윤이 나타났습니다
저선량 나선 CT는 '중국 폐암 검진 표준'에서 권장하는 폐암 검진 기술이며, Cyagen은 종양 발생을 확인하기 위해 KS 쥐의 초기 모델에서 폐 CT 스캔을 수행했습니다. 결과는 타목시펜(Tamoxifen) 처리 6주 후 쥐의 폐에 명백한 종양 조직 침윤이 있음을 보여주었습니다.

그림 3. 4주령 KS 생쥐 타목시펜 처리 6주 후 폐에 명백한 종양 조직 침윤이 나타났습니다(그림의 밝은 색 음영 부분)
동시 기간에 KS 쥐의 헤마톡싄-에오신 (H&E) 염색 결과는 폐 조직에서 종양의 침윤이 나타나며 명백한 병변이 나타나며 12 주 때 후기 표현에 도달했습니다.
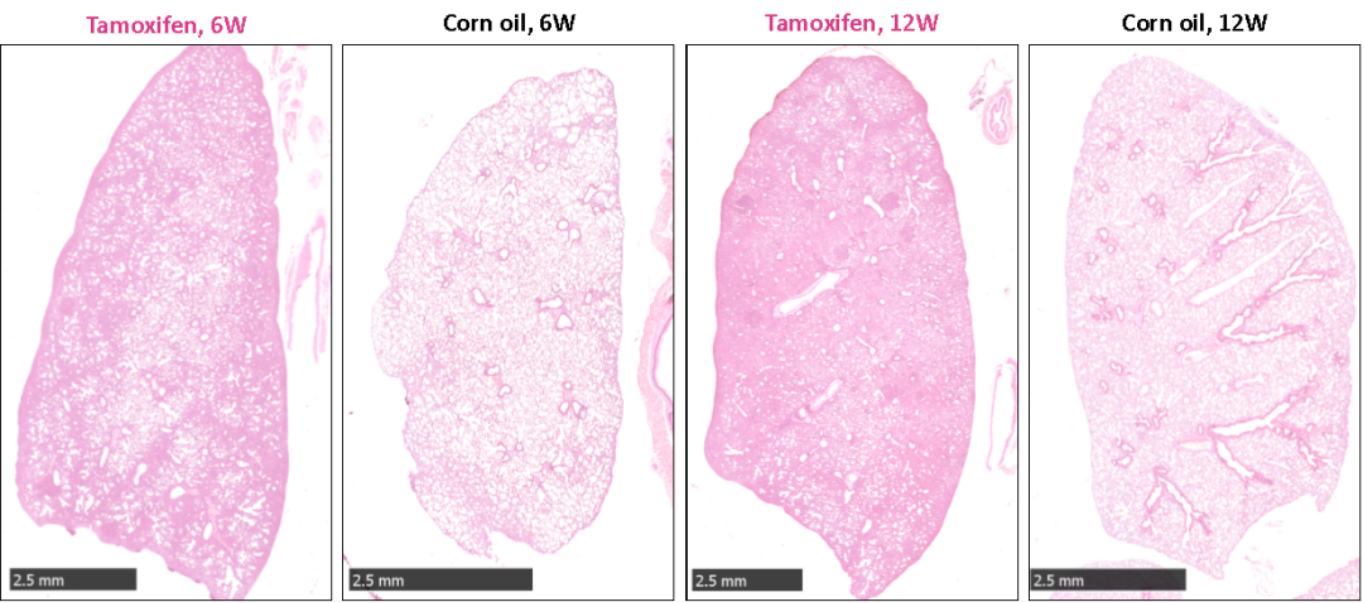
그림 4. H&E 염색 결과, 4주령 KS 쥐의 타목시펜(Tamoxifen) 처리 후 6주 동안 폐 조직에서 종양이 명확한 침윤을 나타내며, 12주 이후에는 병변이 더욱 악화되었습니다
KS 쥐는 성장 및 발달 이상이 존재합니다
성장곡선 및 생존곡선 데이터에 따르면, 타목시펜(Tamoxifen) 처리 후의 KS 쥐의 체중은 야생형 쥐보다 현저히 낮으며, 이 경향은 암수 모두에서 나타납니다. 게다가, 타목시펜(Tamoxifen) 유도 후 9주차에 KS 쥐의 생존율이 감소하기 시작하였으며, 유도 13주 후에는 전부 사망하였는데, 이는 문헌에서 보고된 생존 기간과 일치합니다[5].
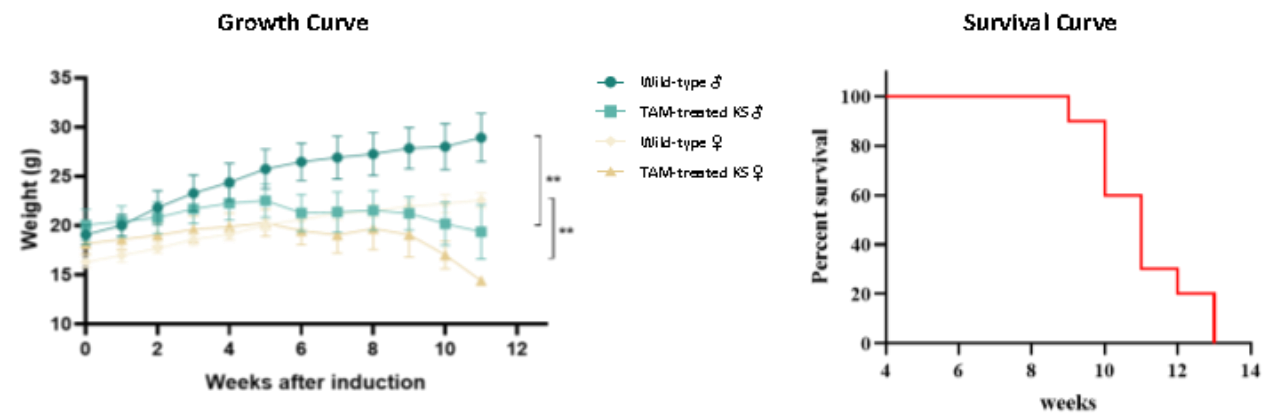
그림 5. KS 생쥐의 성장 곡선과 생존 곡선
KS 생쥐는 폐와 비장의 이상이 존재합니다
유도가 완료된 후 다른 기간의 KS 생쥐의 폐를 채취하여 관찰한 결과, 야생형 생쥐와 비교하여 유도가 완료된 후 6주째의 KS 생쥐의 폐에 종양 세포 침습이 나타났고 폐는 조밀하고 팽창된 구조를 보였습니다. 유도가 완료된 후 12주 차에 KS 쥐의 비장에서 비정상적인 증식이 발생했습니다.
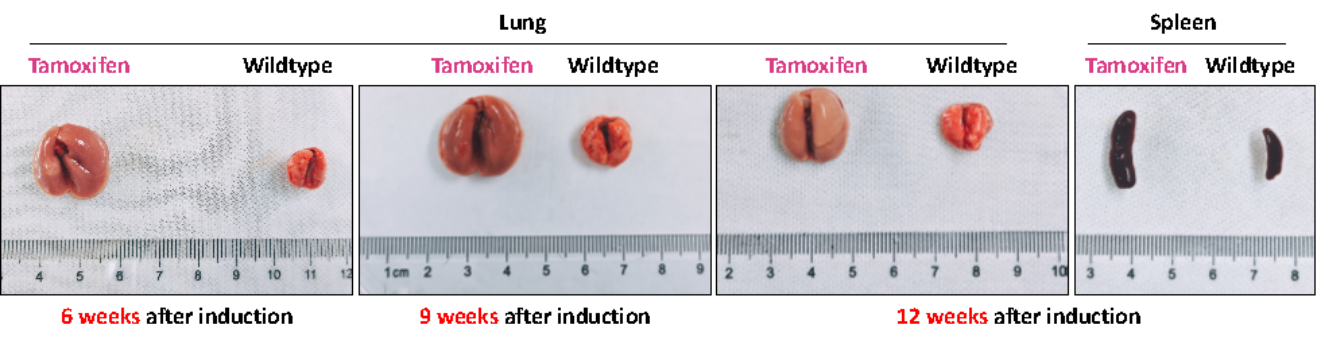
그림 6. KS 쥐는 밀집하게 팽창된 폐 구조와 비정상적인 비장 증식이 존재합니다
기타 조직의 병변 상태
유도 완료 후 12주 차에 KS 쥐의 비장, 신장, 간 및 췌장 조직을 H&E 염색으로 조사한 결과, 비교 대조군과 비교하여 신장, 간 및 췌장에서는 이상이 없으나 비장에서는 백수의 비정상적인 증식이 나타났습니다.
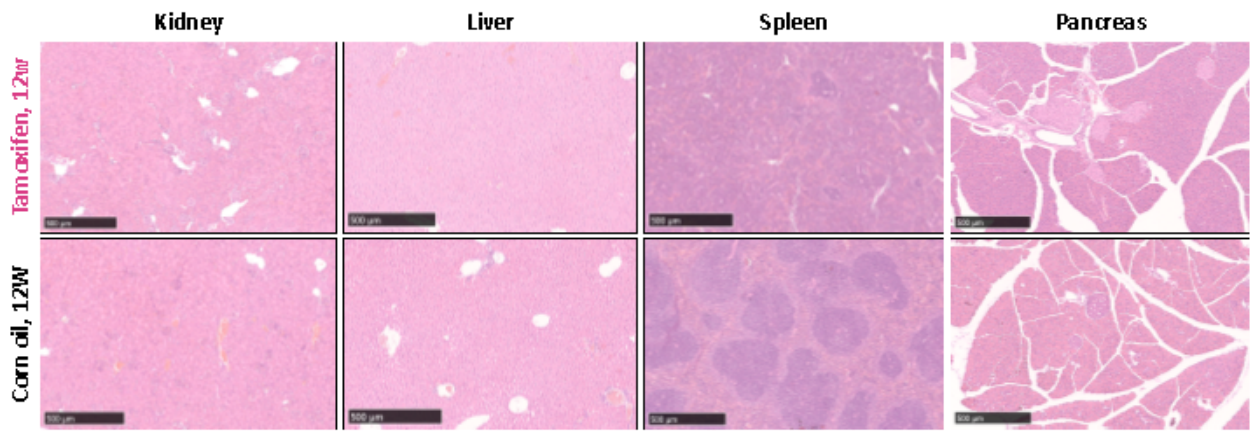
그림 7. 유도 완료 후 12주 된 KS 쥐의 신장, 간, 비장 및 췌장 조직의 H&E 염색
결론
타목시펜(Tamoxifen) 유도 후 6주 차부터 KS 쥐의 체중이 감소하기 시작하며, 연령이 증가함에 따라 호흡 곤란한 증상이 나타나고, 유도 후 13주차에는 전부 사망하였습니다.구체적으로, 병리 표현 측면에서 KS 쥐는 유도 후 6주차부터 폐 부위에서 뚜렷한 종양 세포의 침윤이 나타나며, 폐는 팽창되어 변형되어 밀집하고 외관이 홍조한 조직 구조를 나타내며, 유도 후 12주 차에는 후기 단계에 도달하였습니다.따라서 KS 마우스는 종양의 효율적이고 빠른 발전을 보장하면서 메커니즘 연구와 약물 개발을 위한 긴 실험 창구 기간을 제공하고 KRAS G12D 요법을 겨냥한 평가를 위한 보다 적합한 임상 전 도구를 제공한다.
Cyagen 은 KS 폐암 마우스 모델 외에도 간암, 췌장암, 유방암, 소화관암을 포함한 다양한 자발적, 유도 또는 CDX 종양 모델을 제공합니다. 연구원의 요구에 따라 사용자 정의하거나 공동 개발할 수도 있습니다.
참고 문헌:
[1] Sun D, Li H, Cao M, He S, Lei L, Peng J, Chen W. Cancer burden in China: trends, risk factors and prevention. Cancer Biol Med. 2020 Nov 15;17(4):879-895.
[2] Kwon MC, Berns A. Mouse models for lung cancer. Mol Oncol. 2013 Apr;7(2):165-77.
[3] WebMD. (2023, December 19). Gene Mutations in Non-Small-Cell Lung Cancer. Retrieved from https://www.webmd.com/lung-cancer/story/nsclc-gene-mutations
[4] Ferone G, Lee MC, Sage J, Berns A. Cells of origin of lung cancers: lessons from mouse studies. Genes Dev. 2020 Aug 1;34(15-16):1017-1032.
[5] Xu X, Rock JR, Lu Y, Futtner C, Schwab B, Guinney J, Hogan BL, Onaitis MW. Evidence for type II cells as cells of origin of K-Ras-induced distal lung adenocarcinoma. Proc Natl Acad Sci U S A. 2012 Mar 27;109(13):4910-5.
[6] China National Cancer Prevention and Control Network. (2023, December 19). Guide Standard Detail. Retrieved from http://www.chinancpcn.org.cn/guideStandardDetail?id=6




영업일 기준 1-2일 내에 답변해 드리겠습니다.