

이번에 소개할 모델은 척수성 근위축증(SMA, Spinal Muscular Atrophy) 모델-B6-hSMN2(SMA) 마우스입니다. 먼저 SMA에 대해 알아봅시다. SMA는 척수 전각세포의 운동 뉴런이 퇴행함으로써 발생하는 상염색체 열성 유전병입니다. 심각한 진행성 근무력 및 근위축이 특징이며 영유아기에 흔히 발생하는 치명적인 희귀 유전병입니다. SMA의 전 세계 발병률은 1/6,000~1/10,000으로 희귀병 중에서는 상대적으로 높은 수준이며 희귀병 중 '흔한 병'으로 불립니다[1].
SMA( Spinal Muscular Atrophy)의 대부분은 SMN1 유전자의 변이에 의해 발생
SMA는 생존 운동 뉴런(SMN, Survival of Motor Neuron) 단백질과 관련이 있으며 이 단백질이 결핍되면 척수 운동 뉴런에서 광범위한 스플라이싱 결함 및 기능 결핍을 유발합니다. 인간의 SMN 암호화 유전자는 SMN1과 SMN2로 구분됩니다. SMN1은 전사 및 전환을 통해 완전한 기능성 단백질을 생성하며 체내 SMN 단백질의 주요 공급원입니다. SMN2는 SMN1과 고도로 유지되지만 7번 외부 엑손 스플라이싱 인핸서에서 뉴클레오티드 차이가 있어 생성된 대부분의 SMN2 mRNA에 7번째 엑손이 결핍되고, 기능이 결여된 SMN 절단 단백질을 암호화하며 세포 내에서 빠르게 분해됩니다[2, 3]. SMN2 Pre-mRNA 중 일부(10~15%)만이 전체 길이 mRNA로 절단되어 정상적인 기능을 가진 SMN 단백질을 암호화합니다(그림 1).
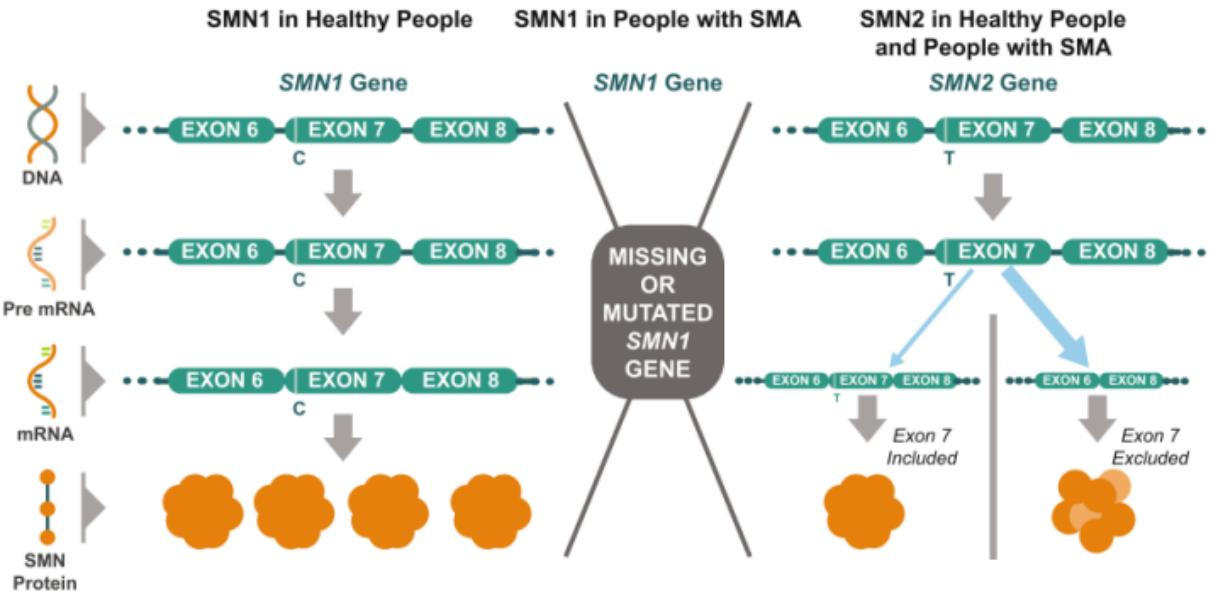
그림 1. SMN2 유전자가 암호화하는 소량의 기능성 SMN 단백질은 SMN1 유전자의 결핍을 완전히 보충하지 못합니다[3].
SMA 환자의 약 95%가 SMN1의 제7 엑손 동형 접합 결핍 돌연변이 혹은 SMN1을 SMN2로 전환시키는 돌연변이를 가지고 있으며, SMN2 발현은 체내의 SMN 단백질 결핍을 대체할 수 없습니다. 이로 인해 운동, 호흡, 연하에 영향을 줘 비장, 심장, 췌장 등 기관에 악영향을 주고 심지어 생명을 위협합니다. SMN1이 결핍된 경우, SMA는 환자의 체내 SMN2 복제 수에 따라 0~IV 유형으로 나눌 수 있습니다. I형 SMA 환자는 2개의 SMN2 복제를 가지고 있으며, II형 SMA 환자는 3개의 SMN2 복제를 가지고 있고, III형 및 IV형 SMA 환자는 더 많은 SMN2 복제를 가지고 있습니다. 일반적으로 환자의 체내 SMN2 복제 수가 많을수록 질병의 중증도가 낮아집니다. I형 SMA는 보다 심각한 아형으로 전체 SMA 환자의 약 60%를 차지합니다[4-5].
SMA 모델의 구축 전략
마우스의 SMN 유전자 특성(Smn1 유전자만 존재)과 다수의 SMA의 유전적 특성(SMN2가 SMN1의 결핍을 대체할 수 없음)에 기반하여, Cyagen은 마우스의 Smn1 유전자를 인간 SMN2 유전자로 치환하고 SMN1이 결핍되고 및 인체 유전자 SMN2(hSMN2)를 발현하는 Ⅰ형 SMA 모델을 구축했습니다(그림 2).
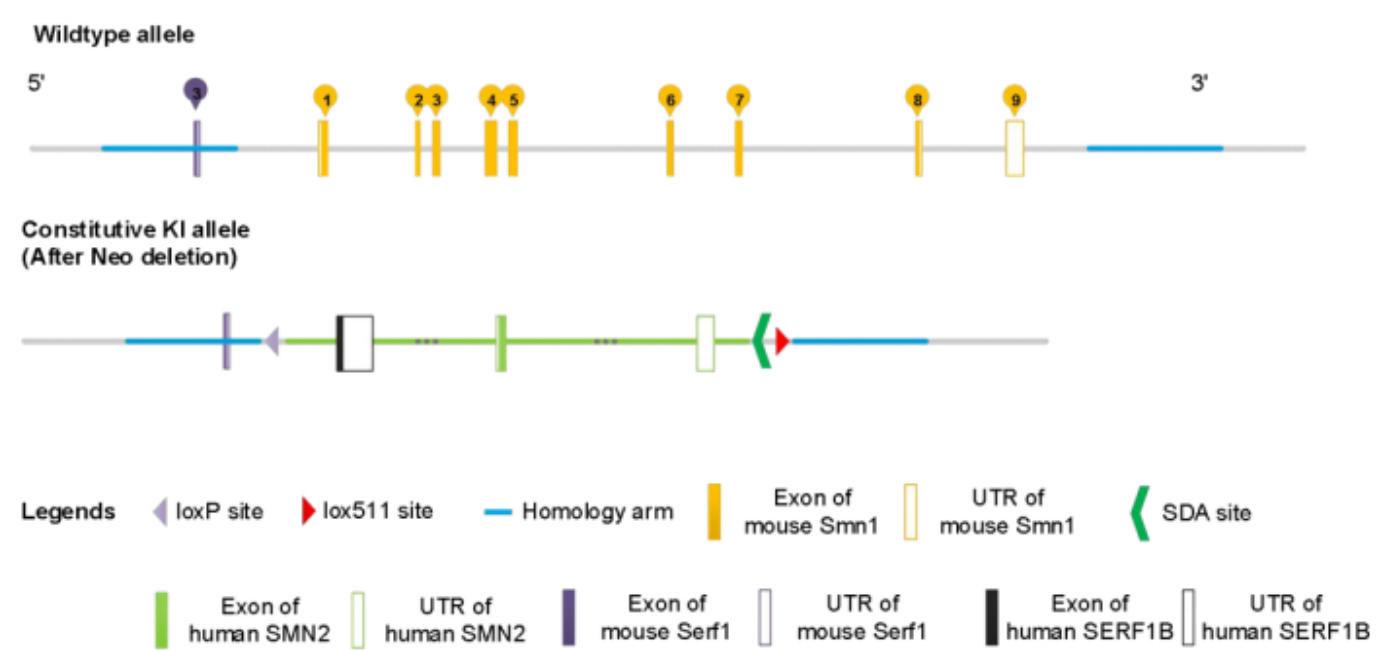
그림 2. B6-hSMN2(SMA) 마우스 유전자 편집(CRISPER) 전략
이 전략은 대부분의 SMA의 유전적 특성, 즉 SMN1 동형 접합 결핍 및 SMN2 이중 복제를 모방합니다. 전통적인 방법으로 마우스 Smn1 유전자를 녹아웃하고, 유전자 변형을 통해 임의의 수의 SMN2 복제 유전자를 삽입하는 것과 달리, 이 전략은 SMN2 유전자의 임의 삽입이 없으며, 마우스는 명확한 SMN2 유전자 복제 수를 가지고 있고 안전적으로 유전될 수 있어서 대다수 SMA의 상황에 부합합니다. 또한 본 모델은 6번 염색체에 SMN2 유전자를 삽입한 Rosa26-hSMN2 마우스와 교배하여, 다양한 SMA 아형을 시뮬레이션하기 위해 마우스 체내의 SMN2 복제를 모방할 수 있습니다.
B6-hSMN2(SMA) 마우스 인체 유전자 발현
SMN2 유전자는 마우스 Smn1 유전자를 발현하지 않습니다
야생형 대조군(B6N)과 비교하면 동형 접합 B6-hSMN2(SMA) 마우스는 마우스 Smn1 mRNA(그림 3d)를 발현하지 않습니다. 체내에는 7번 엑손이 결손된(E7-)과 7번 엑손을 포함하는(E7+) 인간 SMN2 전사체(그림 3a-b)가 동시에 존재합니다. SMN2 E7+ 전사체는 전체 SMN2 전사체(E7+&E7-)의 극히 일부만을 차지합니다(그림 3c).
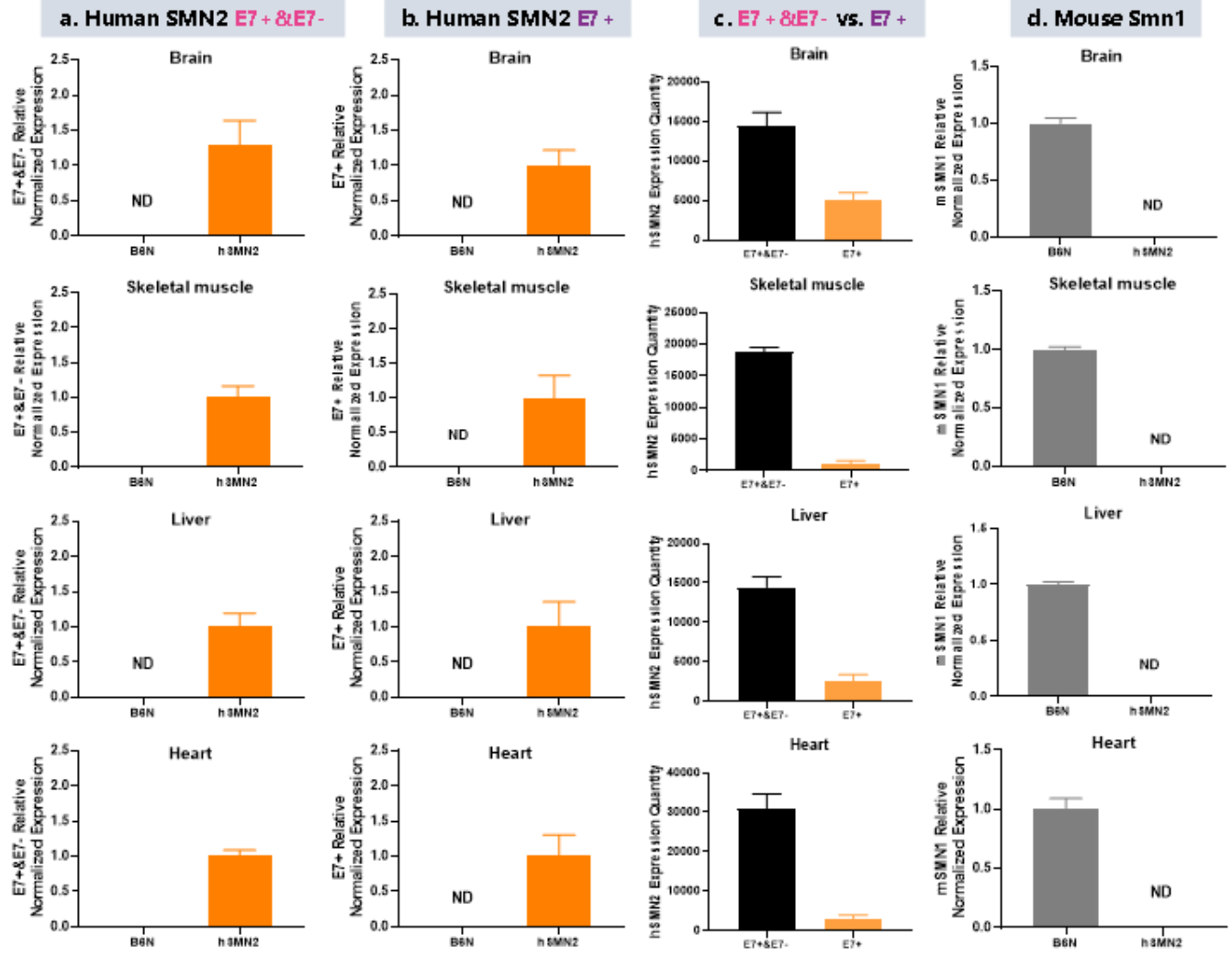
그림 3. 3주 된 B6-hSMN2(SMA) 마우스 및 야생형 마우스(B6N) 유전자 발현 검측
B6-hSMN2(SMA) 마우스는 SMN 단백질이 결핍
유전자의 변화로 인해 SMN 단백질의 수준에 영향을 미치며 야생형에 비해 동형 접합 B6-hSMN2(SMA) 마우스의 척수, 심장, 골격근, 뇌, 간, 신장에 SMN2 유전자에 의해 암호화된 SMN 단백질이 소량만 존재합니다(그림 4). 이는 인간 SMA 환자 체내의 단백질 발현 패턴과 유사합니다.
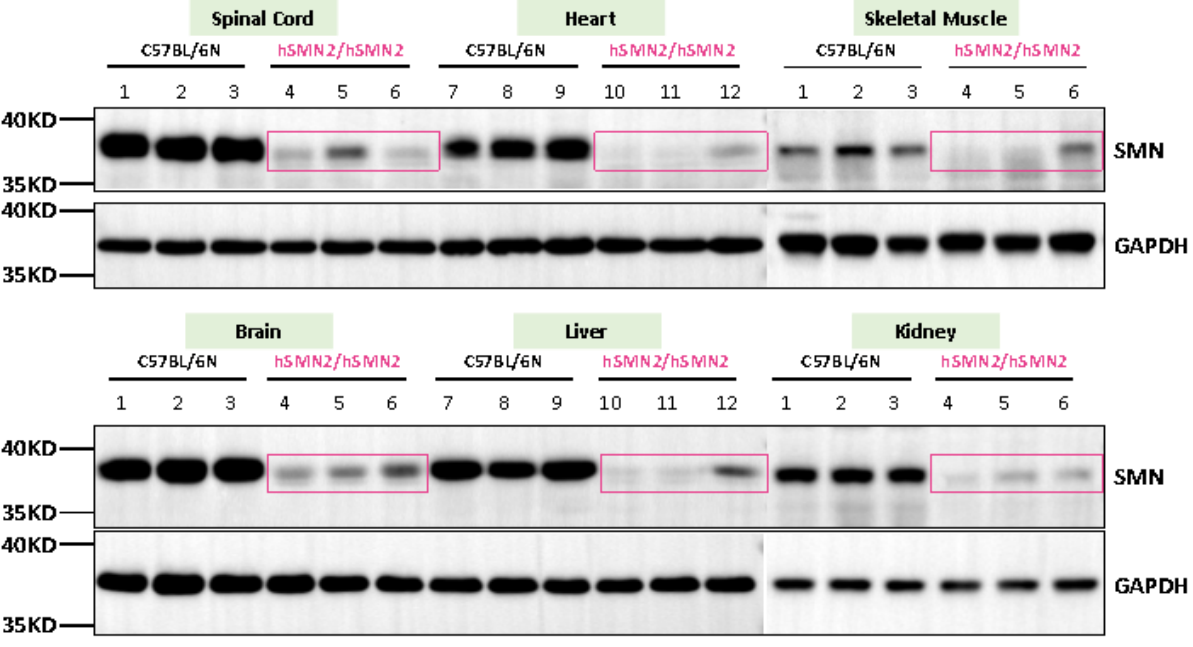
그림 4. 3주 된 야생형 마우스(C57BL/6N) 및 B6-hSMN2(SMA) 마우스 체내 SMN 단백질 검측
B6-hSMN2(SMA) 마우스는 다 조직 병리를 보입니다
조직학적 검사 결과, 동형 접합 B6-hSMN2(SMA) 마우스는 근세포 괴사 및 위축, 세포질 붕괴, 림프구 침윤 및 근세포 간격 확장/배열 느슨함 등 근육 조직 병리를 보이며, 국소 근섬유 괴사 용해/구조 소실, 결합 조직 증식, 과립구 침윤, 장골 절단 및 피하 부종과 같은 발바닥 및 발가락 병리를 보입니다. 또한 국소 피하 부종, 결합 조직 배열 느슨함, 혈관 확장 및 근세포 위축과 소량의 림프구 침윤과 같은 꼬리부 병리(그림 5)를 보입니다.
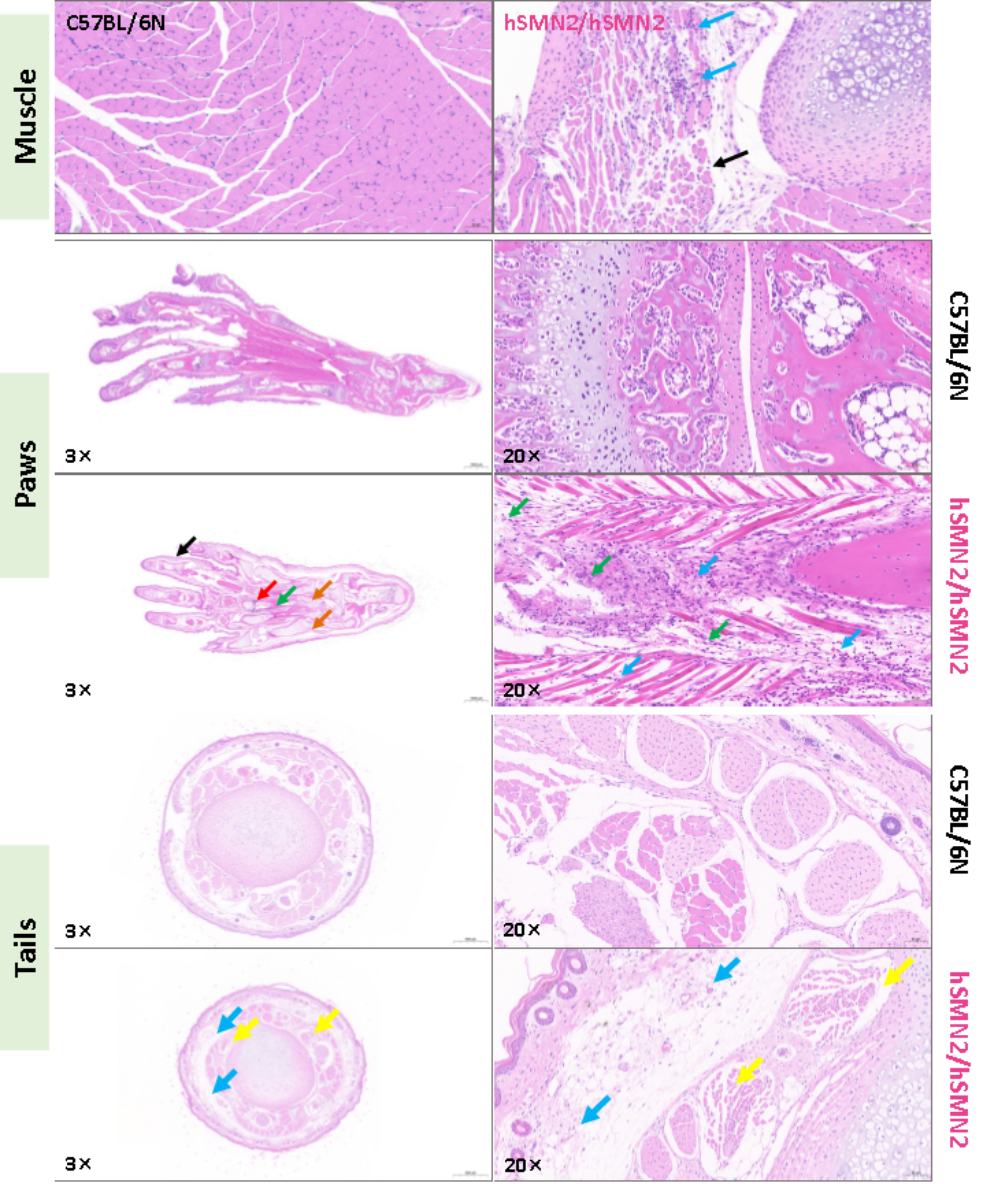
그림 5. 3주 된 동형 접합 B6-hSMN2(SMA) 마우스의 근육, 발바닥, 꼬리부에서 명백한 병리 표현형 확인
B6-hSMN2(SMA) 마우스는
심각한 발육 결함 및 점진적인 질병 경과를 보이고 있습니다
SMN 단백질의 결핍은 B6-hSMN2(SMA) 마우스의 발달 결함을 초래하며 이는 근육 위축, 불안정한 기립, 작은 체형, 짧은 신장, 절단된 꼬리, 사지 부종 등의 심각한 표현형으로 나타납니다(그림 6).
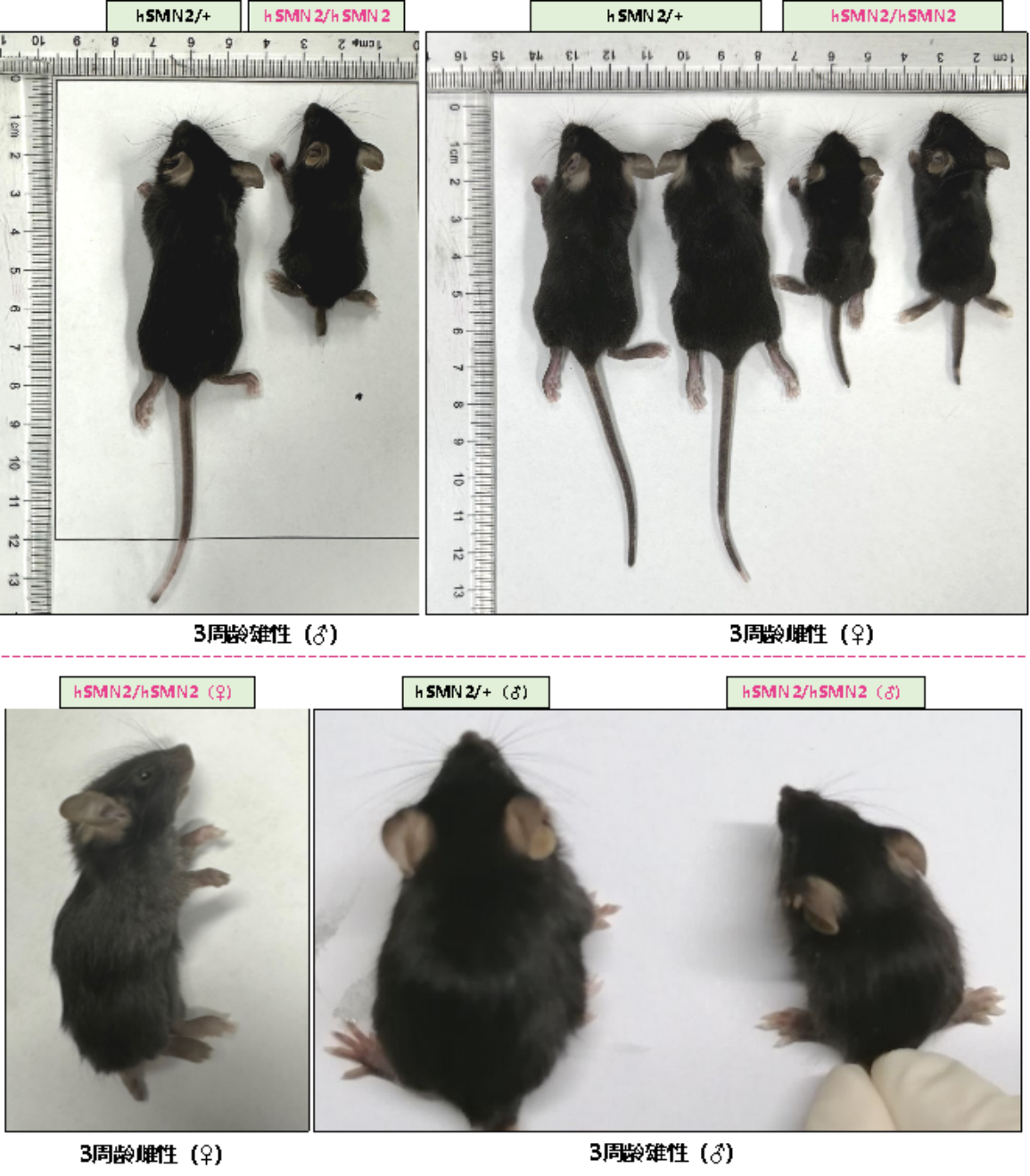
그림 6. 3주 된 이형 B6-hSMN2(SMA) 마우스(hSMN2/+)와 동형 접합 B6-hSMN2(SMA) 마우스(hSMN2/hSMN2) 외형
또한 동형 접합 B6-hSMN2(SMA) 마우스는 약 20일경 사망하기 시작하여 약 30일경에 치사율의 절반에 도달했습니다. 생존한 동형 접합 B6-hSMN2(SMA) 마우스는 생후 30일경에 발가락 괴사와 완전한 꼬리 절단 현상이 나타났으며, 50일경에는 귀 괴사가 발생했고, 66일경에는 귀 주변 털이 하얗게 변했습니다(그림 7). 이형 B6-hSMN2(SMA) 마우스는 야생형과 유사하고 이상이 없으며 SMA 환자의 상염색체 열성 유전 패턴과 일치합니다.
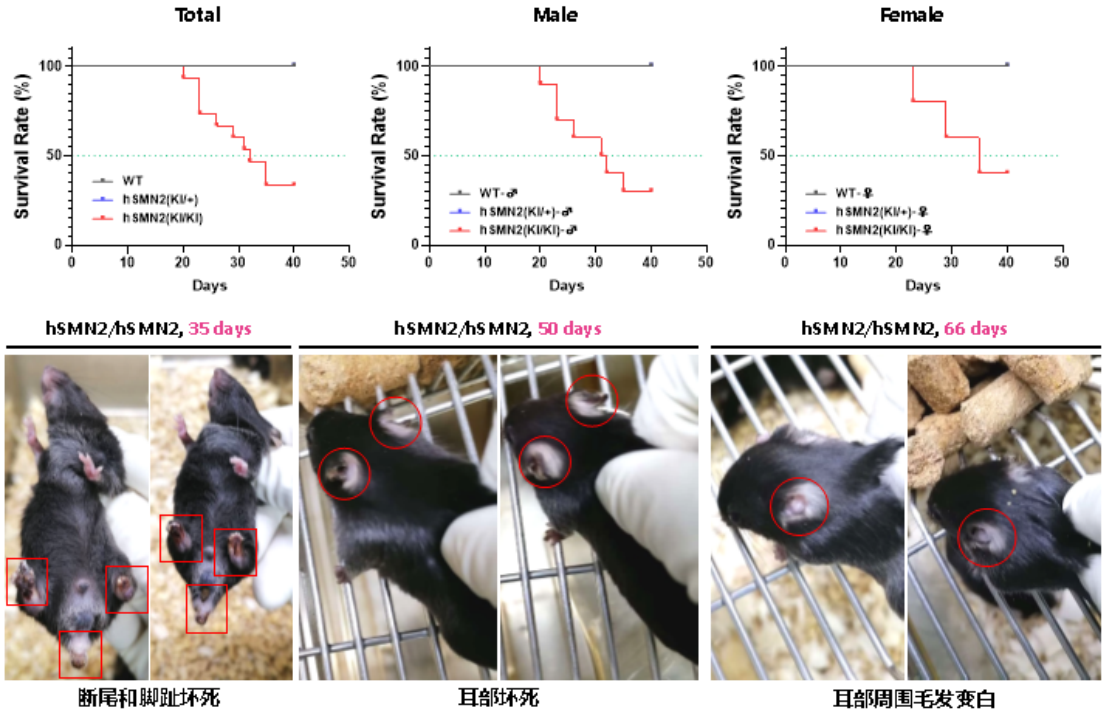
그림 7. B6-hSMN2(SMA) 마우스 생존 곡선 및 질병 경과
소핵산 약물은 B6-hSMN2(SMA)
마우스의 질병 표현형을 완화하고 생존율을 높입니다
현재 졸겐스마(Zolgensma), 스핀라자(Spinraza, 에브리스디(Evrysdi) 3종 SMA 약물이 출시 허가를 받았습니다. 스핀라자(Spinraza)는 최초 승인된 약물로 뉴시너센(ASO, Antisense Oligonucleotide)를 통해 SMN2 mRNA의 스플라이싱 패턴을 수정하여 기능성 SMN 단백질을 암호화하기 위해 7번 엑손이 포함된 다량의 정상 SMN2 mRNA를 생성하도록 합니다. 이는 SMA 치료의 주요 방향 중 하나입니다[3]. 스핀라자9Spinraza)의 공개 정보를 바탕으로 구조와 기능이 유사한 뉴시너센(ASO10-27, GenScript에 의해 합성)를 합성하고 뇌실 내 주사(icv, Intracerebroventricular)와 피하 주사(s.c., Subcutaneous)의 방식으로 B6-hSMN2(SMA) 마우스에 다양한 용량의 ASO10-27을 투여했습니다. 데이터에 따르면 뇌실 내 주사(icv)로 투여된 ASO는 B6-hSMN2(SMA) 마우스의 뇌에서 SMN 단백질의 발현량(그림 8a)과 척수 전각 운동 뉴런의 수를 증가시킬 수 있습니다(그림 8b).
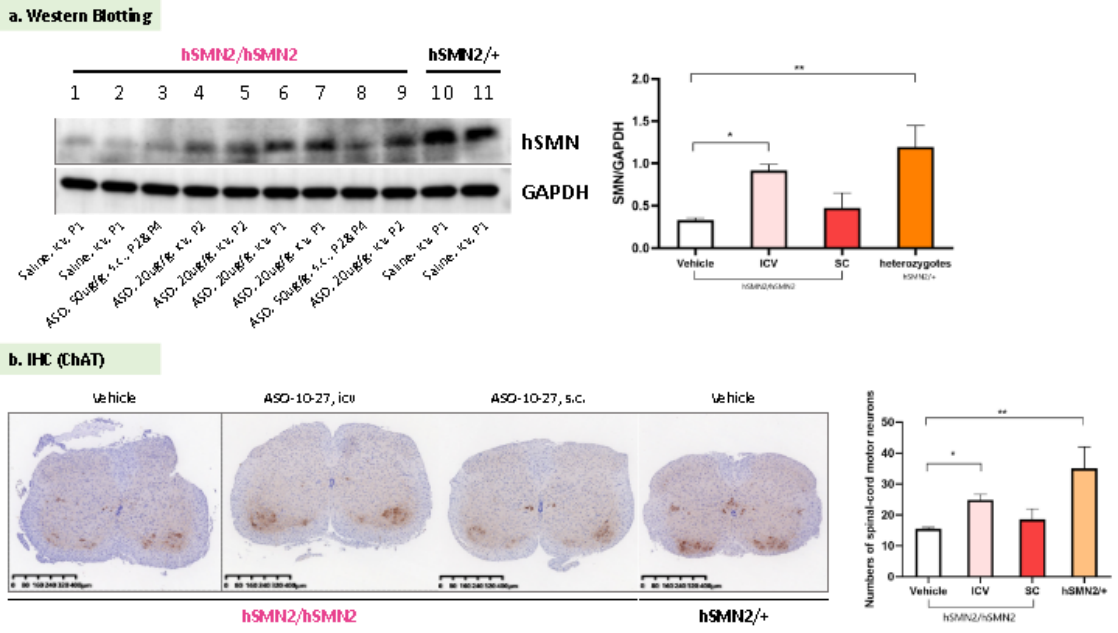
그림 8. SMN2를 타깃으로 한 ASO의 B6-hSMN2(SMA) 마우스 SMN 단백질 및 운동 뉴런에 대한 영향
뇌실 내 주사(icv) 방식으로 투여된 B6-hSMN2(SMA) 마우스의 생존율은 유의하게 증가하였고, 마우스는 78일경까지도 생존을 유지하였습니다. ASO 치료를 거치지 않은 B6-hSMN2(SMA) 마우스는 35일경에 발가락 괴사와 꼬리 절단 현상을 보였고, ASO 치료군 마우스는 43일경에 발가락이 약간 부어오르기만 했으며 발가락 괴사나 꼬리 절단이 없었습니다. 78일경에는 일부 ASO 처리군 마우스에서 꼬리 절단 현상이 나타났지만 발가락 괴사는 나타나지 않았습니다(그림 9).
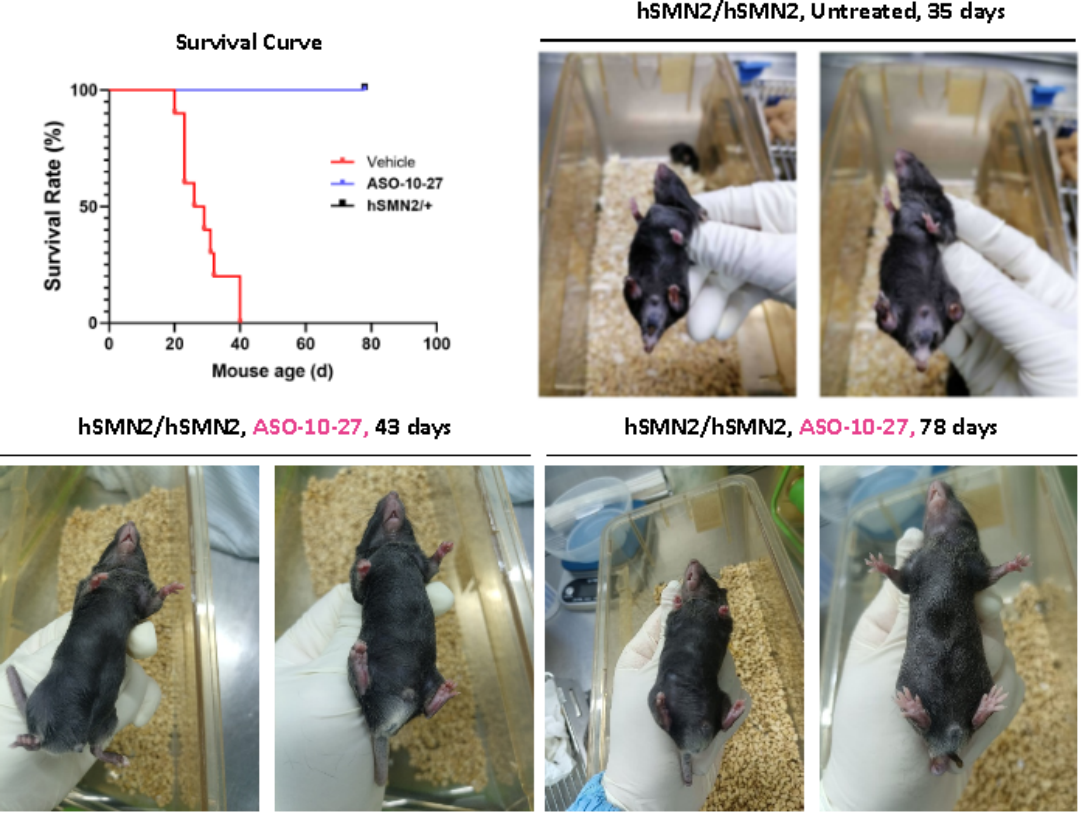
그림 9. ASO 치료는 B6-hSMN2(SMA) 마우스의 생존율을 증가시키고 조직 병변을 지연시켰습니다.
결 론
종합하면, B6-hSMN2(SMA) 마우스는 인간 SMN2 유전자를 발현하고, SMN2 mRNA의 선택적 스플라이싱으로 인해 마우스 체내의 SMN 단백질이 결핍되어 전형적인 SMA 모델과 유사한 표현형을 유발합니다. ASO, siRNA, miRNA와 같은 소핵산은 최근 몇 년 동안 빠르게 발전한 신약으로 유전자가 아닌 mRNA를 타깃으로 하여 질병을 치료하고 유전적 위험이 없기 때문에 특히 희귀 유전 질환 분야에서 많은 관심을 받고 있습니다. B6-hSMN2(SMA) 마우스는 인간 SMA의 유전적 메커니즘과 질병 경과를 모방하며 SMN2를 타깃으로 하는 ASO 약물에 대해 좋은 반응을 보여줍니다. 이는 이 모델이 SMN2를 타깃으로 하는 소핵산 및 기타 유형의 약물 개발, 선별 및 평가 등 연구에 사용될 수 있음을 나타냅니다.
Cyagen HUGO 프로젝트
Cyagen은 HUGO(Humanized Genomic Ortholog) 프로젝트를 시작했습니다. 신약 연구 개발을 돕기 위해 차세대 인간화 모델을 공동으로 개발하는 글로벌 파트너분들을 진심으로 초대합니다.
HUGO-AbTM 차세대 인간화 항체 마우스 모델 항체의 가변 영역의 유전자는 모두 화 인간화 정도를 보이며 체내에서 높은 친화력과 낮은 면역원성을 가진 차세대 인간화 항체를 생성할 수 있습니다.
HUGO-GTTM 차세대 인간화 마우스 모델은 자체 개발한 TurboKnockout-Pro 기술을 기반으로 마우스 유전자의 원위 교체를 실현하여 보다 풍부한 개입 타깃을 포함하고 병원성 유전자 돌연변이 위치를 완전히 커버합니다. 그중 차세대 인간화 유전자화 타깃 유전자는 약물 선별 효율성을 효과적으로 향상시키며 다양한 유형의 약물에 대한 임상 전 실험에 널리 사용될 수 있습니다.
참고 문헌:
[1]Nicolau S, Waldrop MA, Connolly AM, Mendell JR. Spinal Muscular Atrophy. Semin Pediatr Neurol. 2021 Apr;37:100878.
[2]Kolb SJ, Kissel JT. Spinal Muscular Atrophy. Neurol Clin. 2015 Nov;33(4):831-46.
[3]Day JW, Howell K, Place A, Long K, Rossello J, Kertesz N, Nomikos G. Advances and limitations for the treatment of spinal muscular atrophy. BMC Pediatr. 2022 Nov 3;22(1):632.
[4]Edens BM, Ajroud-Driss S, Ma L, Ma YC. Molecular mechanisms and animal models of spinal muscular atrophy. Biochim Biophys Acta. 2015 Apr;1852(4):685-92.
[5]Keinath MC, Prior DE, Prior TW. Spinal Muscular Atrophy: Mutations, Testing, and Clinical Relevance. Appl Clin Genet. 2021 Jan 25;14:11-25.




영업일 기준 1-2일 내에 답변해 드리겠습니다.