

비만 메커니즘에 대하여
많은 비만증 환자는 가족력이 있는데, 이는 가족 구성원이 유사한 유전자를 가지고 있고 종종 동일한 식단과 활동 습관을 가지고 있기 때문입니다. 포만감, 스트레스 및 불안, 지방 합성 및 분해, 체내 에너지 대사 등 과정 조정의 이상은 모두 비만의 발생을 유발할 수 있습니다, 그 중 렙틴 신호 전달 경로와 렙틴 기능을 매개하는 신경 및 세포 경로의 분자 신호의 이상은 가장 흔한 비만증 유전적 요인입니다.
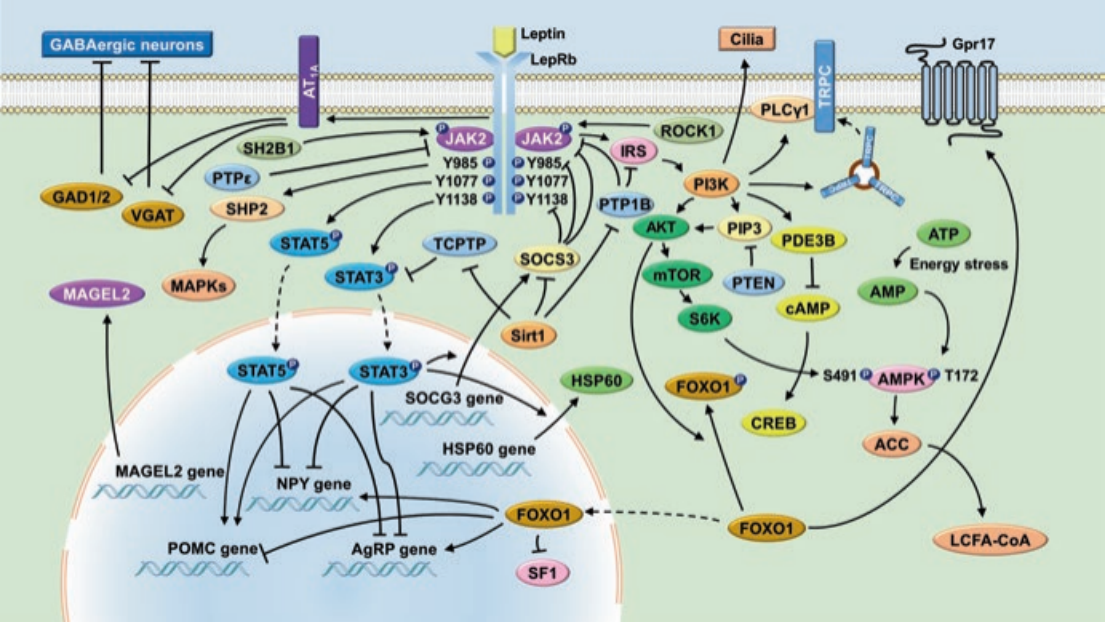
그림1 렙틴-렙틴 수용체 신호 및 렙틴 기능을 매개하는 신경 및 세포 경로
전형적인 ob/ob 생쥐 및 db/db 생쥐
렙틴(Leptin, LEP)은 백색 지방 조직 세포에서 생성되며, 렙틴 수용체(Leptin receptor, LEPR)와 결합하고 이 수용체를 활성화하여 하위로 신호를 전달하며 지방 조직과 시상하부 사이의 네거티브 피드백 메커니즘과 체중의 조절에 아주 중요한 역할을 합니다. 인간과 생쥐에서 LEP와 LEPR 돌연변이는 모두 비만을 유발합니다.
ob/ob 생쥐(Obesity mouse)는 자가 동형 접합 Lep 유전자 돌연변이를 가지고 있어 과식을 유발하고 매우 심각한 비만 표현형을 초래합니다[3]. db/db 생쥐(Diabetes mouse)는 동형 접합 Lepr 돌연변이를 가지고 있으며, 생쥐는 한 달에 과식하고 살이 찌기 시작함과 동시에 글루카곤도 증가하여 제2형 당뇨병[4]이 발생합니다.
Cygen은 Lep 및 Lepr 유전자를 녹아웃하거나 돌연변이를 도입하여 각각 ob/ob 생쥐(제품 번호: C001368) 및 db/db 생쥐(제품 번호: C001291)를 구성하고 검증했습니다. 그 결과 이 생쥐들은 전형적인 모형과 표현형이 동일하고 모두 심각한 비만과 고혈당 표현형을 가지고 있어 비만증 및 제2형 당뇨병 연구에 사용할 수 있음을 보여주었습니다.
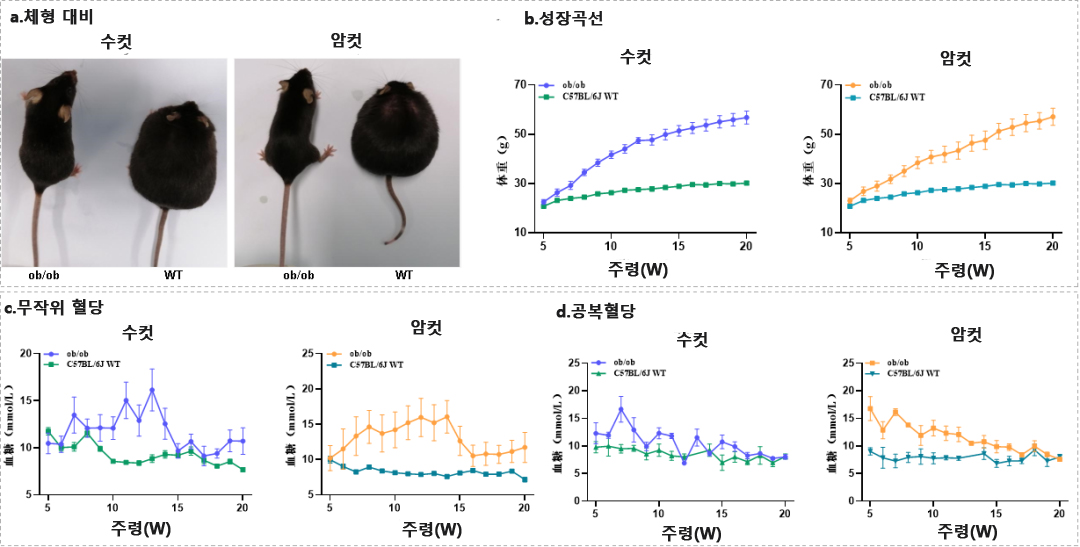
그림2 수컷 및 암컷 ob/ob 생쥐는 모두 심각한 비만 표현형을 보였습니다
LEP/LEPR 하위 경로 결함 모형
Pomc-KO 생쥐
시상하부 궁상핵 중 POMC를 자극하는 양성 신경원은 렙틴의 직접적인 표적인 반면 POMC는 α-멜라닌 세포 자극 호르몬(αMSH)을 포함한 다양한 생물 활성 펩타이드의 전구체입니다. 뇌에서 αMSH는 일종의 강력한 식욕 부진 신경 펩티드이며, 시상하부 실방핵과 기타 부위의 멜라닌 피질 호르몬(MC) 3 및 4 수용체(MCR3/MCR4)를 활성화하여 섭식을 줄이고 에너지 소모를 증가시킵니다. POMC 녹아웃 및 POMC에서 파생된 펩타이드 결핍 생쥐는 과식 및 명백한 비만증을 유발할 수 있으며, 고지방 식사의 경우 비만증이 더욱 심각해지고 집합된 POMC-KO 생쥐도 똑같이 비교적 가벼운 비만 표현형을 가지고 있습니다[5].

그림3 Pomc-KO 생쥐는 심각하고 고지방 식사가 격화된 비만 표현형으로 나타납니다[5]
Mc4r KO 생쥐
AGRP 굶주림 뉴런과 αMSH는 멜라노코르틴 수용체(MCR)를 통해 에너지 균형에 영향을 미치며 멜라노코르틴 수용체 아형4(MCR4)는 음식 섭취량 조절에 관여하는 주요 수용체로 포만감과 에너지 정상 상태에 중요한 역할을 하고 돌연변이도 인간 비만증의 흔한 유전적 원인 중 하나입니다. 방향성 녹아웃을 통해 Mc4r를 비활성화하면 생쥐가 식용 항진 및 병적 비만을 유발할 수 있으며 고인슐린혈증, 고혈당 및 고렙틴혈증과 같은 혈당 표현형이 나타날 수 있습니다. 다른 많은 비만 모형과 다른 것은 Mc4r-KO 생쥐는 순환 코르티코스테론 수준이 증가하지 않았으며, 렙틴, AgRP 혹은 αMSH에 반응하지 않았다는 것입니다[6].
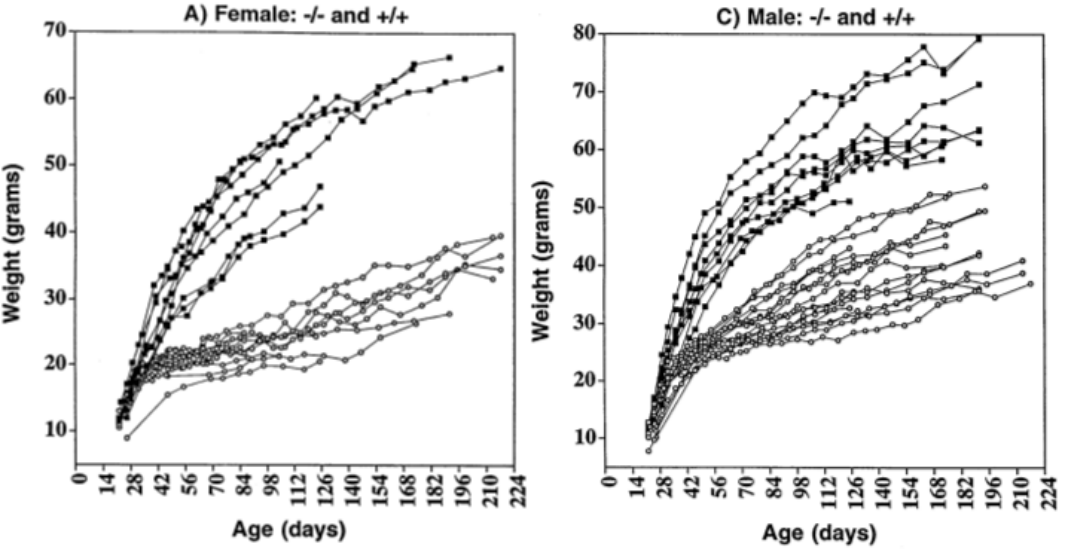
그림4 Mc4r-KO 생쥐는 대조군의 한배 생쥐에 비해 뚜렷한 체중 증가를 보였습니다[6]
Mc3r KO 생쥐
멜라노코르틴 수용체 아형3(MC3R)은 동일하게 일종의 에너지 균형 조절에 관여하는 단백질이며 MC3R은 MC4R과 함께 렙틴-멜라닌 피질 호르몬 신호 캐스게이드에서 멜라닌 피질 호르몬 펩타이드의 핵심 수용체 역할을 합니다. 일부 집단에서 MC3R의 변이는 비만과 관련이 있으며 일부 드물게 보이는 변이는 개체의 체중 증가 이환성에 더 큰 영향을 미칠 수 있습니다. Mc3r-KO 생쥐는 살코기량 감소, 지방량 증가, DIO 가속화 및 낮 동안 섭식 제한 행동 및 대사 적응 약화를 보이는 경증 비만증 및 대사 증후군 표현형과 함께 고렙틴혈증, 상대적으로 경미한 고인슐린혈증, 상대적으로 운동 행위가 감소하는 증상을 보였습니다.
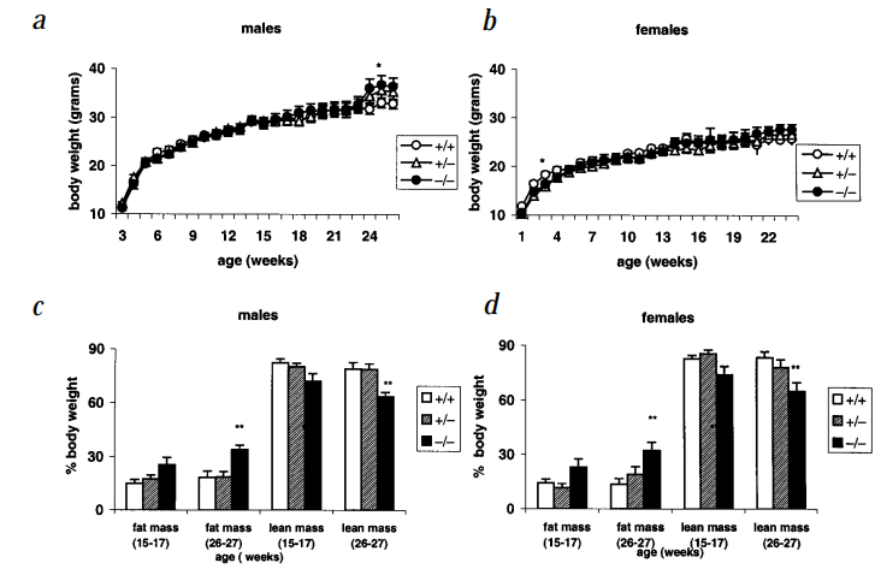
그림5 Mc3r-KO 생쥐는 경미한 비만과 지방 함량 증가를 보였습니다[7]
Mc3r/Mc4r-DKO 생쥐
MC3R과 MC4R은 일정한 시너지 효과가 존재하는 신경 멜라노코르틴 수용체로 에너지 균형을 조절할 수 있습니다. 따라서 Mc3r/Mc4r 이중 유전자 녹아웃 생쥐(Mc3r/Mc4r-DKO)의 비만 정도는Mc3r-KO 생쥐 및 Mc4r-KO 생쥐보다 유의하게 높았습니다[10]. 생쥐에서도 유사한 현상이 관찰되었는데 Mc3r/Mc4r 이중 녹아웃이 Mc3r 혹은 Mc4r 단일 유전자 녹아웃보다 더 심각한 포도당 불내증과 고혈당을 나타내었습니다.
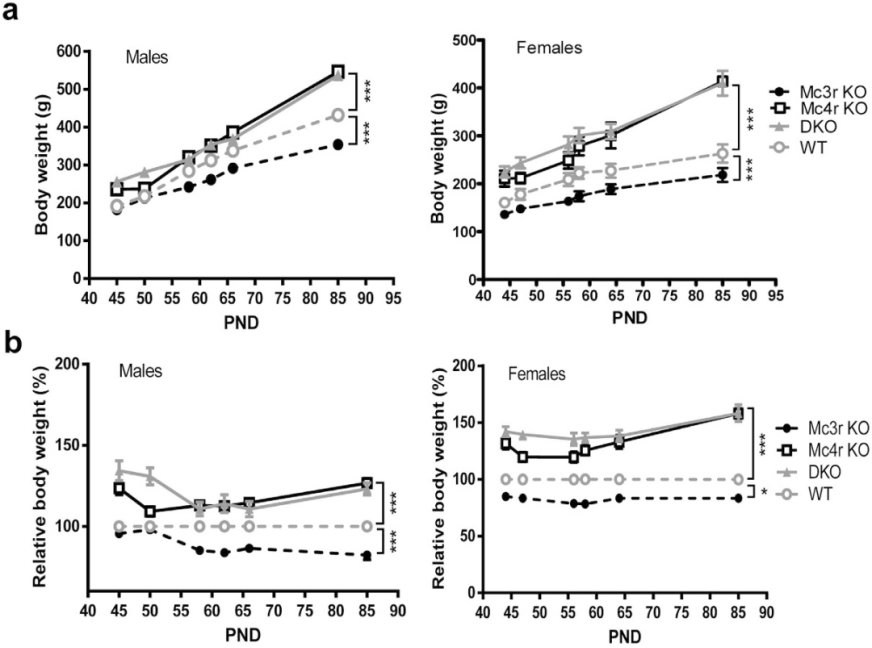
그림6. Mc3r/Mc4r 이중 녹아웃은 Mc3r 혹은 Mc4r 단일 유전자 녹아웃보다 더 심각한 비만 표현형을 초래했습니다[11]
비만증 연구 모형 추천
생쥐 유전자 편집 모형은 비만 및 기타 대사 질환 메커니즘과 약물 연구 개발 평가에 중요한 역할을 하며 Cygen은 수천 개의 자체 연구 개발한 유전자 편집 생쥐 품종이 있으며 LEP, LEPR, POMC, MC4R 등을 포함한 다양한 유전자 녹아웃 또는 조건부 녹아웃 생쥐 모형을 제공할 수 있습니다. 동시에 과학 연구 요구에 따라 전문화된 맞춤형 서비스를 제공하여 프로젝트 연구를 가속화할 수 있습니다.
|
모형 명칭 |
제품코드 |
유전자 |
|
B6-ob/ob |
C001368 |
LEP |
|
B6-db/db |
C001291 |
LEPR |
|
Pomc-KO |
S-KO-03735 |
POMC |
|
Mc3r-KO |
S-KO-03150 |
MC3R |
|
Mc4r-KO |
S-KO-03151 |
MC4R |
대사 및 심혈관 질환 특선 모델-유전자 편집
|
제품코드 |
제품명 |
제품 백그라운드 |
제품 백그라운드 |
|
C001067 |
APOE |
C57BL/6N |
죽상동맥경화증 |
|
C001291 |
B6-db/db |
C57BL/6J |
고혈당 및 비만 |
|
C001392 |
Ldlr KO(em) |
C57BL/6J |
가족성 고콜레스테롤혈증 |
|
C001368 |
B6-ob/ob(Lep KO) |
C57BL/6J |
II형 당뇨병 및 비만 |
|
C001393 |
Uox-KO(Prolonged) |
C57BL/6J |
고요산혈증 |
|
C001267 |
Atp 7b KO |
C57BL/6N |
구리대사장애질환(윌슨병) |
|
C001265 |
Foxj1 KO |
C57BL/6N |
원발성 섬모 이상운동증 |
|
C001266 |
Usp26 KO |
C57BL/6N |
클라인펠터 증후군 |
|
C001273 |
Fah KO |
C57BL/6N |
타이로신혈증 I형 |
|
C001383 |
Alb-Cre/LSL-hLPA |
C57BL/6N |
심혈관 목표 환부 |
|
C001421 |
B6-hGLP-1R |
C57BL/6N |
대사 목표 환부 |
|
C001400 |
B6J-hANGPTL3 |
C57BL/6J |
대사 목표 환부 |
|
C001493 |
FVB-Abcb1a&Abcb1bDKO(Mdr1a/b KO) |
FVB |
혈액뇌장벽 투과성 관련 질환 |
대사 및 심혈관 질환 특선 모델-유도 모델
|
폐고혈압 모델 |
심혈관질환 모델 |
동맥경화 모델 |
말초혈관질환 모델 |
|
알코올성 지방간염 모델 |
비알코올성 지방간염 모델 |
CCL4에 의한 급성 간손상 모델 |
만성 간손상 모델 |
|
당뇨병 및 합병증 모델 |
비만 모델 |
신장질환 모델 |
뇌졸중 모델 |
참고 문헌:
[1]Jiang, Junkun., Zhou, Donglei., Zhou, Donglei., Zhang, Anke., and Yu, Wenjing.. "Thermogenic adipocyte-derived zinc promotes sympathetic innervation in male mice." Nature metabolism.
[2]Liu J, Yang X, Yu S, Zheng R. The Leptin Signaling. Adv Exp Med Biol. 2018;1090:123-144.
[3]Zhang Y, Proenca R, Maffei M, Barone M, Leopold L, Friedman JM. Positional cloning of the mouse obese gene and its human homologue. Nature. 1994 Dec 1;372(6505):425-32.
[4]Coleman DL. Obese and diabetes: two mutant genes causing diabetes-obesity syndromes in mice. Diabetologia. 1978 Mar;14(3):141-8.
[5]Yaswen L, Diehl N, Brennan MB, Hochgeschwender U. Obesity in the mouse model of pro-opiomelanocortin deficiency responds to peripheral melanocortin. Nat Med. 1999 Sep;5(9):1066-70.
[6]Huszar D, Lynch CA, Fairchild-Huntress V, Dunmore JH, Fang Q, Berkemeier LR, Gu W, Kesterson RA, Boston BA, Cone RD, Smith FJ, Campfield LA, Burn P, Lee F. Targeted disruption of the melanocortin-4 receptor results in obesity in mice. Cell. 1997 Jan 10;88(1):131-41.
[7]Butler AA, Kesterson RA, Khong K, Cullen MJ, Pelleymounter MA, Dekoning J, Baetscher M, Cone RD. A unique metabolic syndrome causes obesity in the melanocortin-3 receptor-deficient mouse. Endocrinology. 2000 Sep;141(9):3518-21.
[8]Sutton GM, Begriche K, Kumar KG, Gimble JM, Perez-Tilve D, Nogueiras R, McMillan RP, Hulver MW, Tschöp MH, Butler AA. Central nervous system melanocortin-3 receptors are required for synchronizing metabolism during entrainment to restricted feeding during the light cycle. FASEB J. 2010 Mar;24(3):862-72.
[9] Feng Y, Cao L, Metzger JM, Strack AM, Camacho RE, Mellin TN, Nunes CN, Min W, Fisher J, Gopal-Truter S, MacIntyre DE, Chen HY, Van der Ploeg LH. Inactivation of the mouse melanocortin-3 receptor results in increased fat mass and reduced lean body mass. Nat Genet. 2000 Sep;26(1):97-102.
[10] Chen AS, Marsh DJ, Trumbauer ME, Frazier EG, Guan XM, Yu H, Rosenblum CI, Vongs A, Feng Y, Cao L, Metzger JM, Strack AM, Camacho RE, Mellin TN, Nunes CN, Min W, Fisher J, Gopal-Truter S, MacIntyre DE, Chen HY, Van der Ploeg LH. Inactivation of the mouse melanocortin-3 receptor results in increased fat mass and reduced lean body mass. Nat Genet. 2000 Sep;26(1):97-102.
[11]You P, Hu H, Chen Y, Zhao Y, Yang Y, Wang T, Xing R, Shao Y, Zhang W, Li D, Chen H, Liu M. Effects of Melanocortin 3 and 4 Receptor Deficiency on Energy Homeostasis in Rats. Sci Rep. 2016 Oct 7;6:34938.




영업일 기준 1-2일 내에 답변해 드리겠습니다.