

병원성 유전자
낭포성 섬유화(pulmonary cystic fibrosis, CF)는 흔히 볼 수 있는 상염색체 열성 유전병으로 단유전자병에 속하며 CFTR 유전자의 돌연변이에 의해 발생한다. 주로 상피조직의 정상적인 기능에 영향을 미칩니다. 예를 들어 기도 상피세포, 소장, 췌장, 간, 침샘, 생식도 등이다.
CFTR 유전자는 7번 염색체의 긴 팔(7q31.2), 길이 250kb, 총 1480개의 아미노산에 27개의 엑손과 26개의 인트론을(Intron) 갖고 있다. 이 유전자는 정상적으로 코드화되어 CF 막간 조절기(CFTR)라고 불리는 단백질을 생산하는데, 막간 구조영역 12개와 뉴클레오티드 결합영역 2개(NBD1/2)를 가지고 있으며, 또한 하나의 조절영역 R을 포함하고 있다. 이 조절구에는 단백질 인산화효소A(PKA)와 단백질인산화효소C(PKC)가 공유하는 인산화 부위가 들어 있어 단백질인산화효소에 의해 인산화됐을 때 CFTR 염소이온 채널을 활성화시킬 수 있다.
이 단백질은 ABC 트랜스포터스 가문의 일원으로 영양분을 흡수하고 독소를 배출하며 진핵생물과 세균의 세포간 통신을 매개하는 기능을 한다. 이 단백질은 점액선에서 발현돼 액체와 전해질의 분비를 구동하고 점액선체, 당복합체, 항균제 등을 분비해 호흡기로 유입시켜 점액의 섬모 제거와 자기방어를 촉진한다.
CFTR에 돌연변이가 발생할 때 염소이온 통로는 이상 활성화되어 세포의 전체 소금 조절과 수분 섭취에 영향을 미쳐 통로의 점액을 걸쭉하게 하고 일부 기관(예를 들어 췌장, 호흡기 등)에 색전증을 형성한다. 피부 땀관에서 염화나트륨이 많이 흡수되지 않아 짜게 땀이 난다.
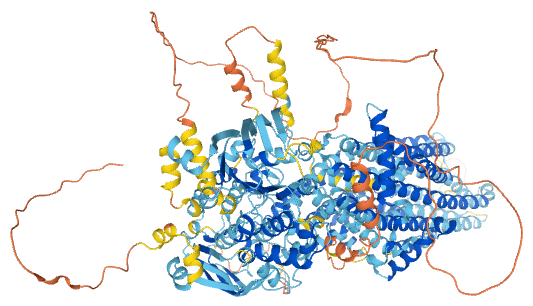
그림 1. CFTR 단백질 구조 예측
CFTR의 활성화는 cAMP 매개가 필요하며, NBD 영역은 ATP와 결합하지만, CFTR은 cAMP에 의존하지 않는 경로로 활성화될 수 있다는 연구도 있다.
CFTR은 이온통로를 조절하는 과정에서 중요한 역할을 하는데, CFTR은 주로 세포 내 염소이온이 막을 가로질러 세포 밖으로 이동하는 것을 매개하고 동시에 물 분자의 수송을 수반한다. CFTR 이 염소 이온 채널 열기를 제어하는 과정은 cAMP 의 수준이 높아지면 인산 키나아제 인산화 R 도메인의 세린 (Serine) 을 촉진하는 것이다.인산화 후, ATP 는 NBD 도메인과 결합되었다. NBD1 말단의 인산기가 전단되면 CFTR의 입체 구조도 바뀌어 이온 통로가 열리고 염소 이온이 유출된다.그 후 NDB2의 ATP가 가수분해되면 CFTR의 입체구조가 다시 바뀌어 채널이 폐쇄된다.
CFTR은 자체 염소이온의 유출을 매개할 수 있을 뿐만 아니라 ROMK2를 통해 세포 내의 NBD1과 제어 R구조 영역과의 상호작용을 통해 칼륨이온을 매개해 세포 밖으로 수송할 수 있다. 또한 ATP에서 PY2R 단백질에 결합하여 ORCC가 매개하는 염소이온의 유출로를 조절하고, 또한 ENaC 단백의 활성을 억제하여 나트륨 이온의 내류를 조절할 수 있다.
현재 CFTR에서 발견된 돌연변이는 1800여 종. 연구진은 CFTR 유전자의 돌연변이를 6가지로 분류했다.정상적인 세포 안에서 기능이 정상인 CFTR 단백질이 세포막으로 옮겨진다.
❖Class I 돌연변이(G543X)
단백질 합성에 이상이 생길 수 있다.
❖Class II돌연변이(△F508)
가장 흔한 돌연변이의 일종인 이 돌연변이는 10번 엑손에 3개의 염기쌍이 없어져 이 단백질 508번 위치에서 페닐알라닌(Phenylalanine)이 없어진다. 낭포성 섬유화에서는 △F508 돌연변이 유전자를 가진 환자가 전체의 88.5%를 차지했다. 이 돌연변이는 CFTR 성숙과정을 막고 잘못 접힌 단백질이 소포체에서 분해된다.
❖Class III돌연변이(G551D)
CFTR 단백질의 조절 능력에 영향을 주어 CFTR 단백질이 형성하는 통로가 기능을 하지 못하게 한다.
❖Class IV돌연변이(R117H)
염소 이온의 전기 전도도를 낮출 수 있다.
❖Class V돌연변이(3849+10kb C-T)
기능이 있는 CFTR 단백질의 합성량을 감소시킨다.
❖Class VI돌연변이(Q1412X)
세포막에서 CFTR의 안정성이 저하될 수 있다.
마우스 모형
사람과 마우스는 아미노산 서열의 상동성이 78%이며, 이 유전자 10번 엑손에 종단코돈(S489X)을 삽입하여 제1종 CFTR 녹아웃 마우스 CFTRtm1UNC를 구축하였으며, 이 마우스 모델은 비교적 심각한 장 합병증을 가지고 있다.
다른 방법으로 얻은 CFTR 전유전자 녹아웃 마우스 모델로는 CFTRtm1CAM, CFTRtm1HSC, CFTRtm1BAY, CFTRtm3BAY가 있다. 이 마우스들은 모두 야생형 CFTR의 mRNA를 검출할 수 없으며, 그 중 CFTRtm1CAM은 췌관이 심하게 막힌 장표현형을 가지고 있으며, CFTRtm1HSC, CFTRtm1BAY, CFTRtm3BAY 모두 심각한 장 합병증을 가지고 있다.
녹아웃 모델 외에도 KI 돌연변이점 모델이 있다. 예를 들어 Class II 돌연변이를 발생시키는 △ F508 마우스 모델 CFTRtm1EUR, CFTRtm1KTH, CFTRtm2CAM; G480C 돌연변이 마우스 모델 CFTRtm2HGU, Class III 돌연변이의 G551D 마우스 모델 CFTRtm1G551D. 이 중 CFTRtm1EUR 돌연변이 마우스는 치명적이지 않은 장 이상표현형을 일으키지만 췌장과 간에는 이상이 없으며 CFTRtm1KTH 돌연변이 마우스의 정자는 이상표현형을 가지지만 담낭과 췌장은 이상이 없어 녹아웃하는 마우스보다 생존주기가 길다.
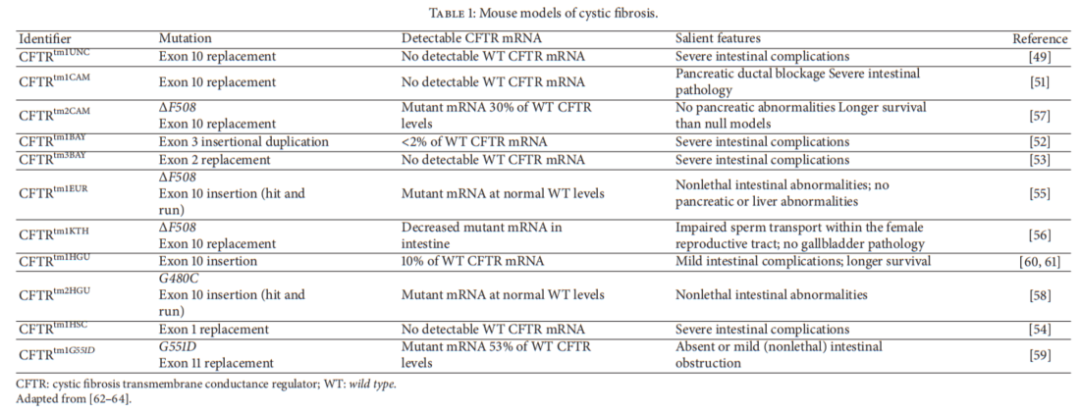
그림 2. 녹아웃 마우스와 KI 마우스 모델
녹아웃 마우스와 KI 마우스 모델을 사용하여 낭포성 섬유화를 연구하므로 구축이 용이하고 번식 주기가 짧으며 사육비용이 저렴한 장점이 있으나 종별 모델 간 질환의 중증도가 일치하지 않아 제약이 있다.
예를 들어 이들 마우스 모델은 환자와 비슷한 심각한 장폐색, 성장 억제, 코 전기생리학적 변화를 보여주지만 독극물 없이 자발적 폐 감염을 일으킬 수는 없다. 또 대부분의 실험 결과 마우스의 췌장, 간, 정관 등에 약간의 합병증만 있는 것으로 나타나 증상과 큰 차이를 보였다. 이러한 결과를 초래한 원인은 마우스의 저발현량의 CFTR이 충분한 이온전달능력을 만들어 심각도가 비교적 가벼워지게 할 수 있으며, 또한 마우스의 상피발현 염소이온통로가 존재하여 CFTR의 이온통로 기능을 대신 할 수 있기 때문일 수 있다.
이에 따라 이 제한을 돌파하기 위해 연구원들은 인간 CFTR 유전자가 포함된 세균 인공염색체 (BAC) 를 CFTR 을 제외한 마우스로 옮겨갔다. 실험 결과 인간 CFTR 마우스의 관련 장·호흡기 이상을 나타내는 표현형이 환자와 비슷했다.이 실험은 CFTR 유전자가 마우스와 사람 사이에서 어느 정도 보수적이라는 사실도 입증했다.
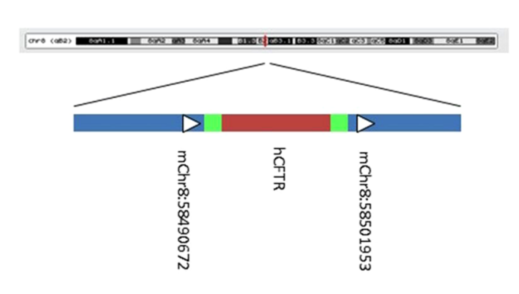
그림 3. 인간화 마우스의 구축
비코딩 영역 연구
연구원들은 CFTR 의 5'UTR 에서 녹색 상자 부분을 선택하고 돌연변이를 형광소 효소의 5' UTR 로 선택하고 형광소 효소의 형광으로 서열을 판단하는 기능을 한다. 그 결과 uAUG 가 uUUG 로 돌연변이하고 lower stem 의 서열을 돌연변이하면 야생형 CFTR 의 5'UTR 서열에 비해 돌연변이 서열 형광소 효소의 표현 효율이 현저히 높아진 것으로 나타났다.또한 top stem 의 서열을 돌연변이할 때도 비슷한 결과가 나왔다. 이 연구결과는 CFTR 의 5' UTR 의 잠재적 치료 가치를 제시했다.
★ 연구원들은 또한 CFTR mRNA 에서 많은 miRNA 결합점을 발견했는데, 그 중 miR-145-5p 는 CFTR 및 기타 요인과의 상호 작용을 통해 CFTR 의 합성을 억제하여 miR-145-5p 를 목표로 하는 펩타이드 핵산 (PNAS)R8-PNA-a145 를 추가로 합성했다. 실험 결과 이 PNA 는 miR-145-5p 의 표현을 억제하고 CFTR mRNA 의 표현을 올릴 수 있는 것으로 나타났다. 이 연구결과는 CFTR 의 3' UTR 의 잠재적 치료 가치를 제시했다.
RDDC는 CF등 희귀병 연구를 조력

중국 광저우 희귀병 유전자치료연맹 회원 중 한 명인 Cyagen는 '희귀병 유전자 디코딩 프로그램'을 시동을 걸어 AI가 희귀병 진료 호소에 적극 호응하고 RDDC 구축에 힘을 보태 희귀병 원인 유전체 데이터를 보완하는 데 주력하고 있다.
사용자가 RDDC에 접속하면 해당 희귀병에 대한 전반적인 정보를 알 수 있을 뿐만 아니라 각종 AI 도구를 이용하여 병원성 예측, 절개 부위 변경 예측 등 희귀병 진료 연구 및 치료 방안 개발에 박차를 가할 수 있다.
홈페이지(https://rddc.tsinghua-gd.org/)에 접속해 즐겨보세요!
참고 문헌 및 사진 출처:
[1] Lavelle GM, White MM, Browne N, McElvaney NG, Reeves EP. Animal Models of Cystic Fibrosis Pathology: Phenotypic Parallels and Divergences. Biomed Res Int. 2016;2016:5258727.doi:10.1155/2016/5258727. Epub 2016 Jun 1.
[2] Rosen BH, Chanson M, Gawenis LR, Liu J, Sofoluwe A, Zoso A, Engelhardt JF. Animal and model systems for studying cystic fibrosis. J Cyst Fibros. 2018 Mar;17(2S):S28-S34. doi: 10.1016/j.jcf.2017.09.001. Epub 2017 Sep 19.
[3] Gawenis LR, Hodges CA, McHugh DR, Valerio DM, Miron A, Cotton CU, Liu J, Walker NM, Strubberg AM, Gillen AE, Mutolo MJ, Kotzamanis G, Bosch J, Harris A, Drumm ML, Clarke LL. A BAC Transgene Expressing Human CFTR under Control of Its Regulatory Elements Rescues Cftr Knockout Mice. Sci Rep. 2019 Aug 14;9(1):11828. doi: 10.1038/s41598-019-48105-4.
[4] Fabbri E, Tamanini A, Jakova T, Gasparello J, Manicardi A, Corradini R, Sabbioni G, Finotti A, Borgatti M, Lampronti I, Munari S, Dechecchi MC, Cabrini G, Gambari R. A Peptide Nucleic Acid against MicroRNA miR-145-5p Enhances the Expression of the Cystic Fibrosis Transmembrane Conductance Regulator (CFTR) in Calu-3 Cells. Molecules. 2017 Dec 29;23(1):71. doi: 10.3390/molecules23010071.513.html




영업일 기준 1-2일 내에 답변해 드리겠습니다.