

파킨슨병은 흔히 볼 수 있는 신경 퇴행성 질환이지만, 조기발형 파킨슨병은 누진이나 오진을 당하기 쉽다. 이와 관련해 ATP13A2는 원인 돌연변이가 조기발형 파킨슨병(EOPD)과 Kufor-Rakeb증후군(KRS)을 일으키는 ATP 막 관통성 단백질(transmembrane protein)이다. 환자는 청소년기에 인지장애, 운동능력 저하, 뇌 위축 등의 증상이 나타난다.
ATP13A2 유전자 소개
사람 ATP13A2(PARK9)는 1180개의 아미노산을 부호화하여 막에 걸친 p5형 ATP 효소 가문에 속하며, P형 ATP 효소는 큰 단백질 가족으로 원핵생물과 진핵생물에 존재한다. 그것은 체내에서 광범위하게 표현되고, 또한 뇌에서 고도로 표현된다. 정상 ATP13A2는 리소좀, 내소체, 다포체(multivesicular body)에 위치하며망간 이온, 아연 이온 등 다양한 양이온의 막 이송에 관여한다. α-synuclein의 독성을 억제해 망간으로부터 세포를 보호하기도 한다.
그림1. ATP13A2 유전자 관련 정보
출처 : RDDC 희귀병 데이터센터 (https://rddc.tsinghua-gd.org/details/gene?gene=2j9XOm)
ATP13A2에서의 많은 돌연변이는 조발성 파킨슨병을 유발한다.현재 비교적 많은 연구가 진행되고 있는 것은 제24호 엑손(c.G2629A)로, 순합자 돌연변이는 단백질(p.G877R)의 잘못된 돌연변이를 일으킬 수 있다. 또 F182L, G877R, G504R 등이 있는데 G877R과 G504R에 대한 연구가 많다.
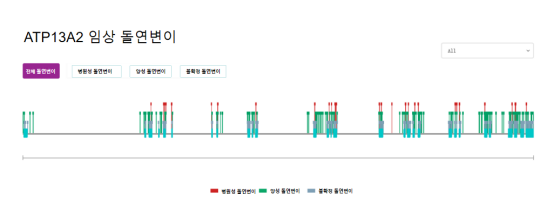
그림2. ATP13A2 유전자상 임상 돌연변이에 관한 정보
출처 : RDDC 희귀병 데이터센터 (https://rddc.tsinghua-gd.org/details/gene?gene=2j9XOm)
ATP13A2 관련 질환 소개
Kufor-Rakeb증후군(KRS)은 레보도파 반응성 파킨슨병으로 조발성 파킨슨병으로 드물게 상염색체인 음성유전을 하는 신경계 질환이다. 청소년기 상염색체인 열성 흑질선조체(Striatum)의 창백한 담창구(globus pallidum) 신경변성이 특징이다. KRS는 파킨슨병의 임상적 특징과 경련·핵상 성상성 마비(Supraoptic palsy), 인지능력 저하 등을 갖고 있다. 환자의 평균 발병 연령은 11±1이다. 그리고 운동이 느리고 서툴며 균형장애, 언어가 불분명하고 수직 시선이 제한되거나 마비등 추체외계손상의 징후를 나타났다. 그리고 미만성 뇌(Diffuse brain)와 소뇌가 위축증(cerebellar atrophy)된다. 일부 환자에게는 전신성 tonic clonic epileptic seizure 이 발생한다. ATP13A2는 뇌에서 보편적으로 발현되지만 서로 다른 뇌에서는 흑질 영역이 가장 강한다. 파킨슨 환자 흑질 도파민 뉴런에서 ATP13A2 유전자 mRNA 수준이 정상 대비 약 10배 높은 것을 발견했다.
그림3. ATP13A2 유전자 이상으로 인한 관련 질환
출처 : RDDC 희귀병 데이터센터 (https://rddc.tsinghua-gd.org/details/gene?gene=2j9XOm)
ATP13A2 유전자 녹아웃 마우스
해당 마우스 모델은 9종류이며 일부 모델은 구축방식이 중복되며 구체적인 정보는 RDDC 홈페이지에서 얻을 수 있다.(https://rddc.tsinghua-gd.org/search?type=model&query=ATP13A2) 이 모델에서 연구진은 마우스의 엑손 3, 4 사이에 선별소자를 삽입하고 엑손 2, 3 양쪽에 loxp 서열을 삽입해 flox 마우스를 구축한 뒤 Cre 마우스와 짝을 이뤄 2, 3번 엑손를 지우고 삭제하면 4번 엑손의 위치에서 조기종료 신호를 보낸다.
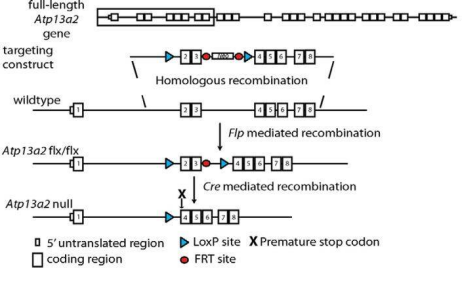
그림4. ATP13A2 녹아웃 마우스의 구축 전략[3]
연구진은 ATP13A2의 결핍으로 특정 단백질의 운반에 결함이 생길 수 있으며, 이단백질이 결핍된 생쥐는 나이와 관련된 운동 기능 장애가 나타날 수 있으며 신경병리학적 변화가 나타날 수 있으며 신경교화성 증식, 편재화된 단백질 (Ubiquitylated Protein) 집합체의 축적, 지갈소증 증착 (lipofuscinosis), 내리소좀 (endolysosome) 이상 등의 표형이 나타날 수 있다는 사실을 밝혀냈다.
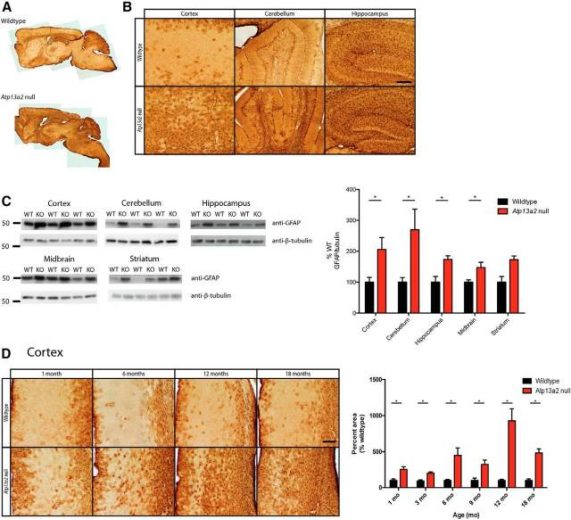
그림5. ATP13A2가 빠진 마우스의 중추신경계는 나이 의존성 교질세포 증식을 나타낸다[3]
결론
마우스 ATP13A2 기능 상실에 따른 파킨슨 표형의 임상적 의의가 있으며, 이 유전자에 대한 심층 연구는 이 유전자에 의한 파킨슨의 분자 메커니즘을 탐구하는 데 도움이 되며, 질병 치료의 새로운 방법 연구에도 활용될 수 있다.

Cyagen 'AI Knock- Out Mouse Model eBank'은 ATP13A2를 포함한다양한 시리즈의 완전녹아웃 마우스와 조건부 녹아웃 마우스 모델을 제공한다. 강력한 데이터베이스는 온라인에서 유전자 편집 방안을 조회·설계하고 최적화하며 연구 데이터와 성과를 비교하고 주문 상담을 받을 수 있는 보다 편리한 경험을 제공한다.
'AI Knock- Out Mouse Model eBank'는 3대 자원을 총망라한다
⭐다품종 KO/CKO 마우스 리소스 풀
⭐해상 돌연변이 위치 생쥐 데이터베이스
⭐ microRNA 녹아웃 마우스 데이터베이스
RDDC 조력 희귀병 연구

홈페이지(https://rddc.tsinghua-gd.org/)에 접속해 즐겨보세요!
*성명: RDDC 데이터와 도구는 연구용으로만 사용되며 참고만 할 뿐 의학적 진단과 평판의 최종적인 결론이 될 수 없다.
참고 문헌:
【1】 Daniel G, Musso A, Tsika E, Fiser A, Glauser L, Pletnikova O, Schneider BL, Moore DJ. α-Synuclein-induced dopaminergic neurodegeneration in a rat model of Parkinson's disease occurs independent of ATP13A2 (PARK9). Neurobiol Dis. 2015 Jan;73:229-43. doi: 10.1016/j.nbd.2014.10.007. Epub 2014 Oct 18. PMID: 25461191.
【2】 Kett LR, Dauer WT. Endolysosomal dysfunction in Parkinson's disease: Recent developments and future challenges. Mov Disord. 2016 Oct;31(10):1433-1443. doi: 10.1002/mds.26797. PMID: 27619535; PMCID: PMC5061051.
【3】 Kett LR, Stiller B, Bernath MM, et al. α-Synuclein-independent histopathological and motor deficits in mice lacking the endolysosomal Parkinsonism protein Atp13a2. J Neurosci. 2015;35(14):5724-5742. doi:10.1523/JNEUROSCI.0632-14.2015
【4】 张梦颖. ATP13A2 F182L基因打靶小鼠的致病机理研究[D]. 河南大学, 2019.




영업일 기준 1-2일 내에 답변해 드리겠습니다.