

2024년 4월, 국제 학술지 Cell 창간 50주년을 기념하여 “From Periphery to Center Stage: 50 Years of Advancements in Innate Immunity”라는 획기적인 리뷰 논문을 게재했습니다. 이 논문은 선천면역(Innate immunity)이 단순한 방어 장벽을 넘어, 적응면역(Adaptive immunity)을 조절하고 생체 항상성(homeostasis)을 유지하는 중심 시스템이라는 것을 체계적으로 강조했습니다. [1]
선천면역 경로를 타겟으로 하는 치료 전략은 감염, 염증성 질환, 암 등 다양한 질환에 대한 새로운 치료 가능성을 열어주고 있습니다. 특히 리뷰에서 ‘하나의 타겟으로 여러 질환을 조절할 수 있는 가능성’을 지닌 NLRP3 억제제(inhibitors)가 차세대 브로드 스펙트럼(Broad-Spectrum) 항염증제로 부상할 수 있으며, 골수계 세포(Myeloid cell)가 매개하는 만성 염증 질환에 대한 혁신적인 치료 옵션이 될 수 있다고 강조했습니다.
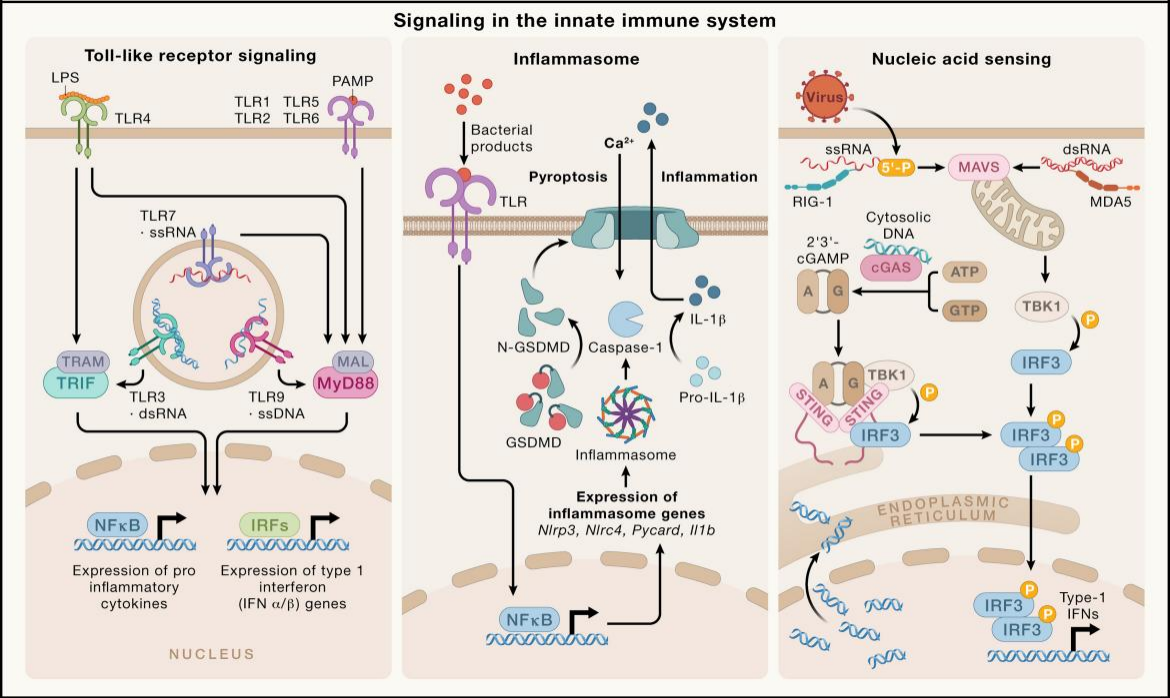
그림 1. 선천면역계의 주요 신호전달 경로 [1]
인플라마좀(inflammasome): 선천면역의 핵심 신호 조절 허브
선천면역계는 병원체에 대한 신체의 1차 방어선으로, 패턴 인식 수용체(PRRs)를 통해 병원체 관련 분자적 패턴(Pathogen-associated molecular patterns, PAMPs) 및 손상 관련 분자적 패턴(Damage-associated molecular patterns, DAMPs)을 인식합니다. 이를 통해 세포의 손상, 괴사, 기능 이상 등 질환 관련 신호를 빠르고 광범위하게 감지하고, 적절한 면역 반응을 유도할 수 있습니다. [2]
이러한 메커니즘 중 인플라마좀(inflammasome)은 다양한 패턴 인식 수용체(PRRs) 참여로 형성된 세포질 내 다중 단백질 복합체로서 선천면역 반응의 핵심 조절 요소로 작용합니다. 이는 interleukin-1β (IL-1β) 및 interleukin-18 (IL-18)과 같은 주요 염증성 사이토카인(cytokine)을 활성화하며, Gasdermin 계열 단백질 절단을 통해 Pyoroptosis(염증성 세포 사멸)를 유도합니다. [3]
NLRP3 인플라마좀(inflammasome)은 세균 독소, 대사 이상 등 다양한 위험 신호를 감지할 수 있으며, 알츠하이머병, 통풍, 당뇨병과 같은 주요 질환들과의 직접적인 관련성을 가지기 때문에 가장 활발히 연구되는 타겟이 되어 있습니다. [4]
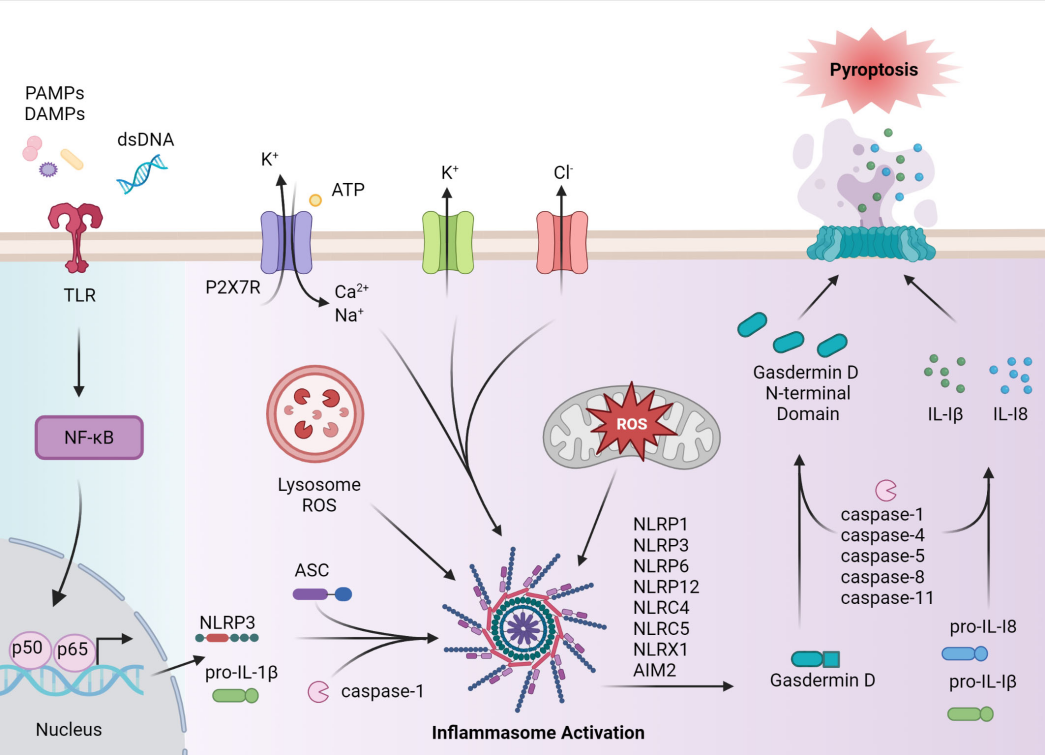
그림 2. 인플라마좀(inflammasome)의 분류, 조립 및 활성화. [4]
NLRP3 인플라마좀(inflammasome): 염증의 핵심 요소
NLRP3 (NOD-like receptor family pyrin domain-containing 3) 단백질은 인플라마좀(inflammasome) 활성화에 결정적인 역할을 하는 핵심 구성 요소입니다. NLRP3 단백질 영역은 PAMPs 또는 DAMPs 신호를 인식한 후 caspase-1을 활성화시켜 프로염증성 사이토카인(Pro-inflammatory cytokine)의 성숙과 분비를 촉진함으로써 염증 반응을 조절합니다. [5]
세포 내 스트레스나 손상을 감지하면 비활성 단량체 NLRP3는 올리고머화(Oligomerization)되어 활성 형태로 전환되며, 고도로 정렬된 인플라마좀(inflammasome) 복합체를 형성합니다. 이 복합체는 IL-1β, IL-18, 및 Gasdermin D(GSDMD)를 활성화하여 downstream 염증 반응과 염증성 세포 사멸(Pyroptosis)을 유발합니다. [5, 6]
특히, NLRP3 유전자의 기능 획득(Gain-of-Function, GOF) 돌연변이는 IL-1β와 IL-18의 과도한 생성을 유발하여 크리오피린 관련 주기적 증후군(Cryopyrin-Associated Periodic Syndroms, CAPS)과 같은 염증성 자가 면역 질환을 초래할 수 있습니다. [7]
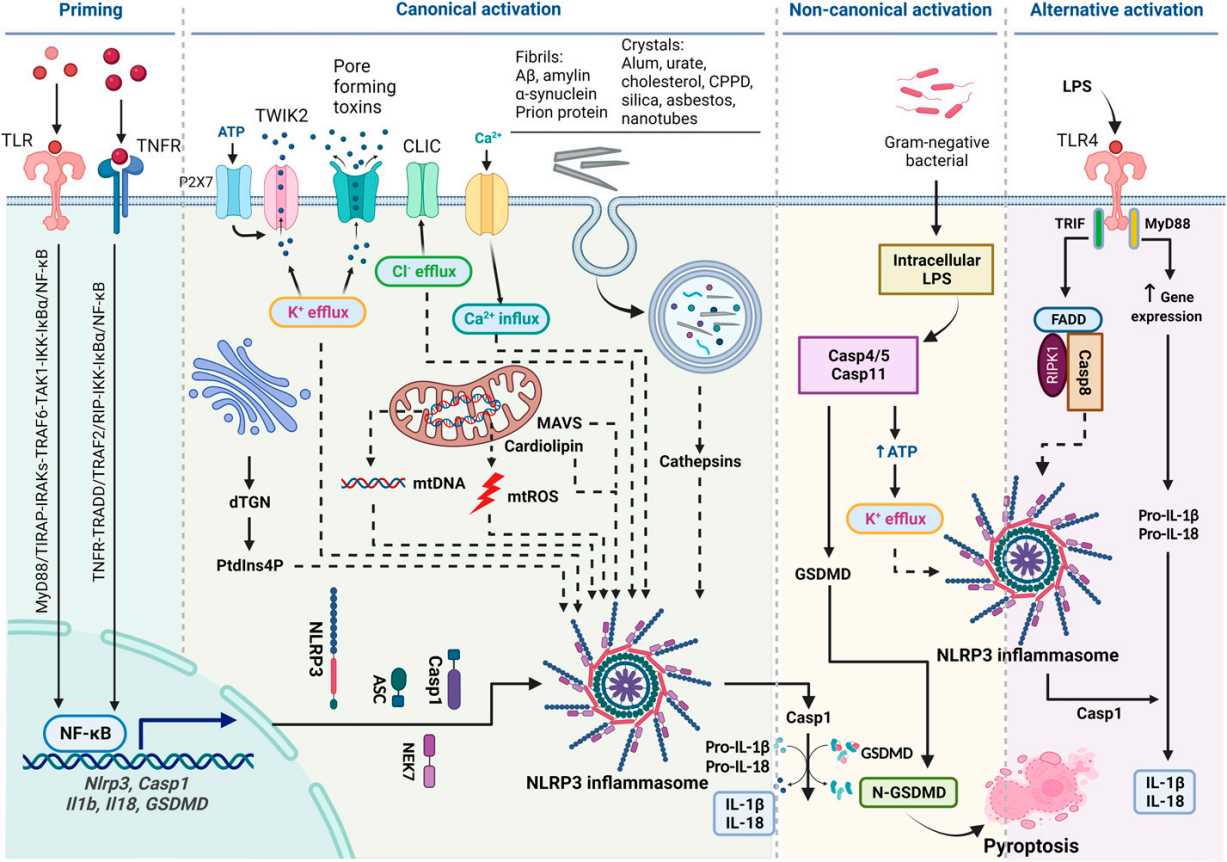
그림 3. NLRP3 인플라마좀(inflammasome)의 다중 활성화 메커니즘. [8]
NLRP3 억제제: 차세대 항염증 치료제
NLRP3는 중요한 염증성 사이토카인인 IL-1β 및 IL-18의 상위 조절자로 작용하기 때문에, NLRP3의 활성을 저해함으로써 만성 염증의 자가 증폭 사이클을 근본적으로 차단할 수 있습니다. 이는 염증 관련 질환을 치료하는 핵심 전략으로 간주됩니다. [5]
이 단일 분자를 억제함으로써 NLRP3 억제제는 다양한 염증성 질환에서 유용한 치료 효과를 제공할 수 있으며, 감염 질환 치료에서의 항생제처럼 “하나의 약물이 다양한 질환에 적용되는” 접근법으로 주목받고 있습니다. 특히, 골수계 세포로 유발한 염증(Myeloid cell-mediated inflammation) 치료에 적용됩니다. [1]
현재 NLRP3 억제제를 중심으로 한 100개 이상의 신약 개발 프로그램이 진행하고 있으며, 신경과학, 자가면역, 염증, 대사질환 등 분야에서 임상시험이 활발하게 이루어지고 있습니다. 일부 후보 약물은 이미 제3상 임상시험 단계에 진입했습니다. [8, 9]
특히 주목할 점은 NLRP3이 알츠하이머병과 파킨슨병 등 중추신경계(CNS) 질환에서 중요한 역할을 한다는 점이며, 이에 따라 NLRP3는 고부가가치 치료 타겟으로서의 잠재력을 드러내고 있습니다.
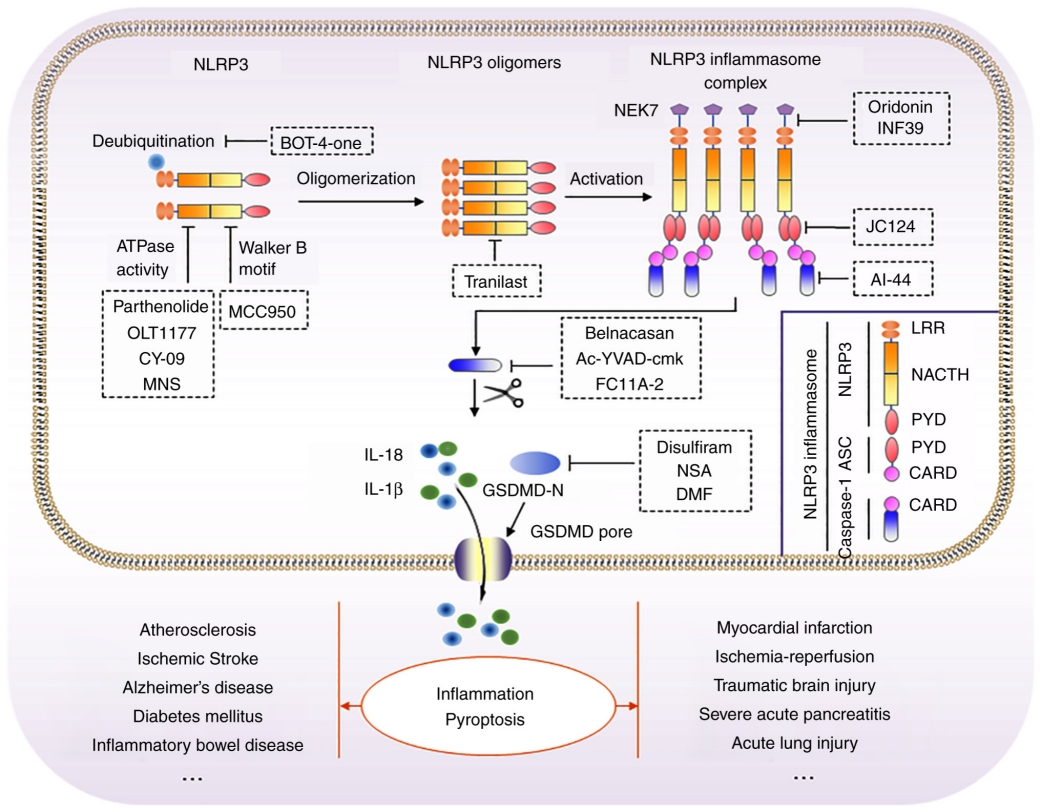
그림 4. 다양한 타겟팅 메커니즘을 가진 NLRP3 인플라마좀(inflammasome) 억제제 및 적용 가능 질환 [10]
NLRP3 타겟 약물 개발을 위한 혁신 - 인간화 마우스 모델
질환 평가 모델을 구축하기 위해 널리 사용되는 전략 중 하나는 인간 질환 병원성 돌연변이를 Homologous 마우스 유전자에 이식하는 것입니다.
하지만 초기 연구에서는 인간 NLRP3 돌연변이를 마우스 게놈에 도입하더라도 인간 질환에서 관찰되는 표현형보다 훨씬 약한 표현형이 나타난다는 사실이 밝혀졌습니다. [11, 12]
이러한 한계를 극복하고 더 높은 인간화된 연구 모델을 구축하기 위해, 여러 연구팀은 질환 관련 변이를 포함한 인간 NLRP3 유전자로 마우스 내인성 Nlrp3 유전자를 완전히 대체하는 모델 개발에 집중하고 있습니다. 예를 들어, D305N 돌연변이가 포함된 인간화 NLRP3 마우스 모델은 엔도톡신(endotoxin)에 대한 급성 민감성을 나타내며, 진행성 관절염을 유발하는 것으로 나타났습니다. [13]
한 제약사는 상기 인간화 모델을 사용하여 신규 NLRP3 저분자 억제제의 스크리닝과 in vivo 약물 효능 평가를 진행했습니다. 스크리닝 결과에 따르면 이 화합물은 마우스 NLRP3 단백질에 거의 억제 효과를 보이지 않으며, 인간 NLRP3 단백질에 대해서는 나노몰 수준의 억제 효과를 나타냈습니다.
이에 따라 연구팀은 해당 인간화 마우스 모델을 활용하여, NLRP3 억제제가 Wild-type NLRP3 활성화 및 질환 연관 NLRP3 유전자의 병원성 돌연변이(D305N)를 억제하는 능력에 대한 in vivo 평가를 진행했습니다. [14]
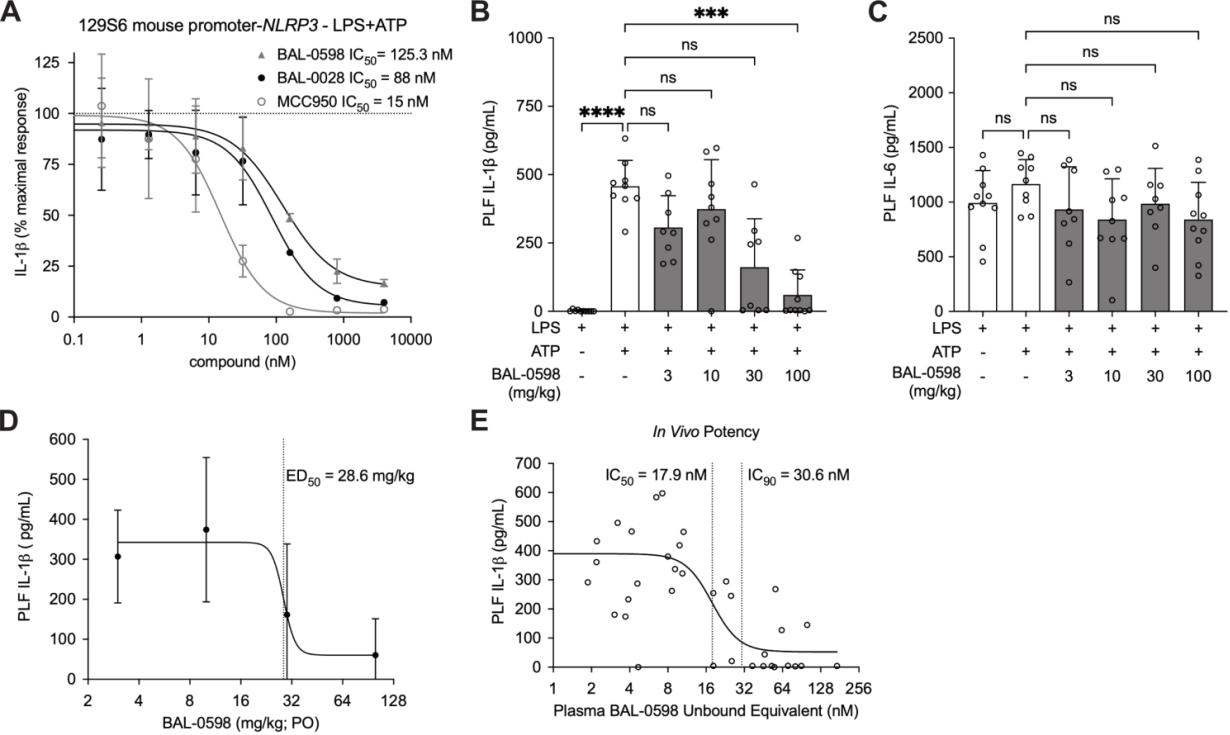
그림 5. 신규 NLRP3 억제제의 in vivo 효능 평가를 위한 NLRP3 인간화 마우스 복막염 모델을 구축합니다. [14]
또한, NLRP3 타겟팅 치료제 개발에 주력하는 NodThera는 여러 종류의 NLRP3 인간화 마우스 모델을 개발하고, species-specific NLRP3의 생리적 영향에 대한 포괄적인 연구를 진행했습니다. 해당 연구에 따르면, 인간과 마우스 간에 NLRP3 단백질의 구조는 매우 유사하지만, NLRP3가 자가염증성 질환 및 자가면역성 질환에서 하는 역할을 평가할 때, species-specific 단백질의 발현 및 그 조절 기능은 매우 중요하며, 인간화 NLRP3 유전자의 발현은 질환 발병 기전을 정밀하게 시뮬레이션하는 데 필수적입니다. [15]
따라서 NLRP3 인간화 마우스 모델은 NLRP3 타겟 치료제의 치료 효능을 더욱 정확히 예측하는 데 기여하며, 신약 개발을 촉진하는 유용한 연구 모델로 적용될 수 있습니다.
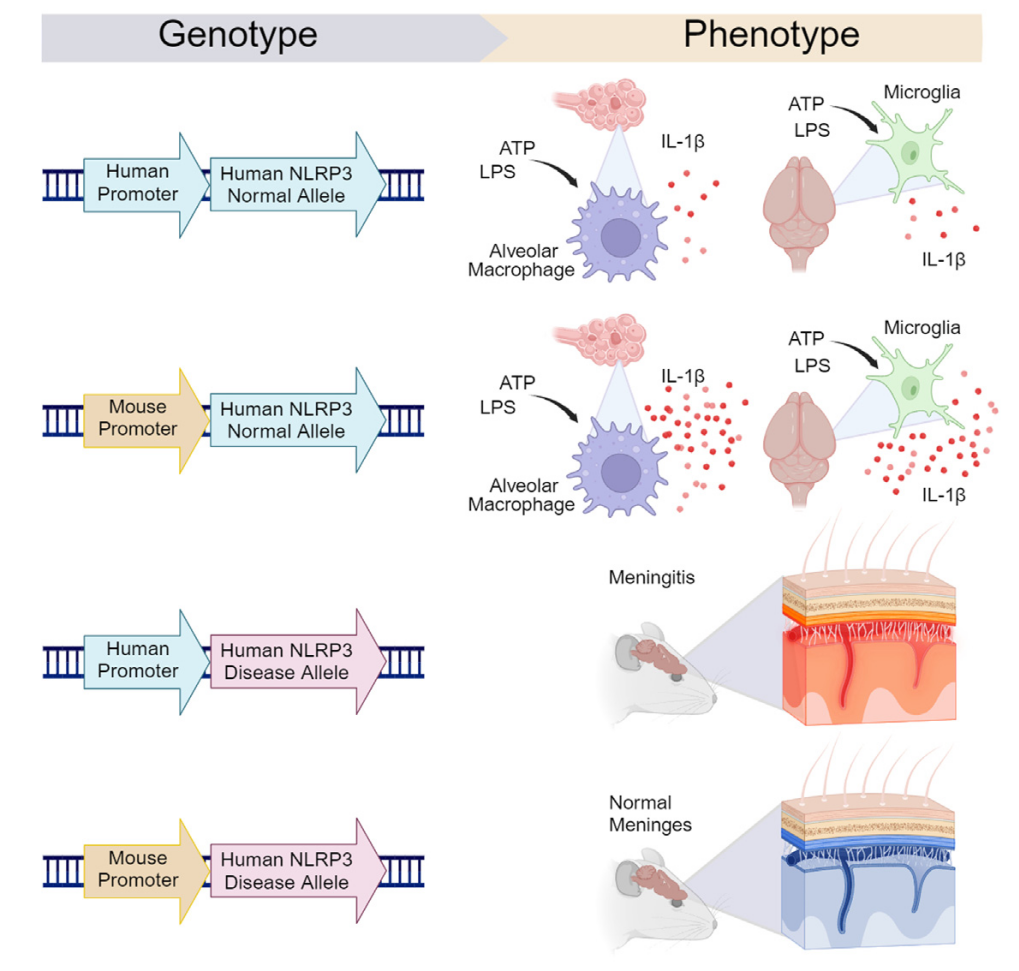
그림 6. 다양한 유형의 NLRP3 인간화 마우스 모델이 LPS 자극에 대한 반응. [15]
신약 개발을 위한 Cyagen의 NLRP3 인간화 마우스 모델
NLRP3 유전자 작용 기전의 in vivo 연구를 촉진하고 NLRP3 타겟 치료제의 개발을 가속하기 위해, Cyagen은 인간화 NLRP3 마우스 모델 – B6-hNLRP3 마우스(제품 번호: C001616)를 개발했습니다. 이 모델은 downstream 3' UTR 영역을 포함한 전체 인간 NLRP3 유전자 서열을 보유하고 있어, 약물 발굴 및 질환 모델링에 적용합니다.
아래는 B6-hNLRP3 마우스 모델의 검증 데이터입니다.
B6-hNLRP3 마우스 체내에서는 인간 NLRP3 유전자가 강하게 발현되며, 마우스 내인성 Nlrp3 유전자는 더 이상 발현되지 않습니다. 인간 유전자의 조직 특이적 발현 패턴은 원래의 유전자 발현 패턴과 매우 유사하며, 후속 연구에서 생리학적 연관성을 보장할 수 있습니다.
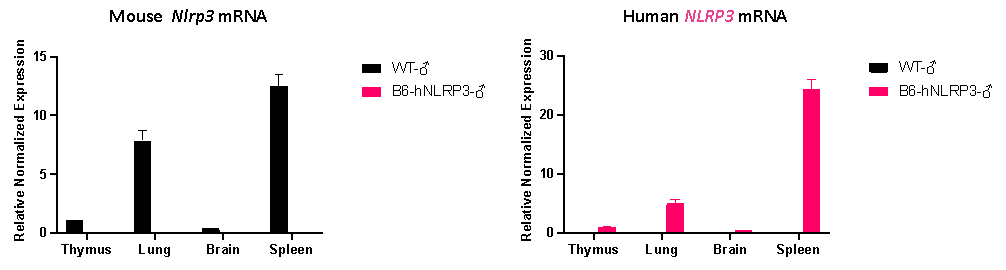
그림 7. B6-hNLRP3 마우스와 Wild-Type(WT) 마우스에서 조직별 인간 NLRP3 및 마우스 Nlrp3 유전자의 발현 분석 결과.
B6-hNLRP3 마우스는 인간 NLRP3 단백질을 성공적으로 발현합니다. 단백질 발현 수준은 흉선 조직보다 폐 조직에서 더 높게 나타났으며, 이는 RT-qPCR 분석을 통해 관찰된 mRNA 발현 프로파일과 일치합니다.
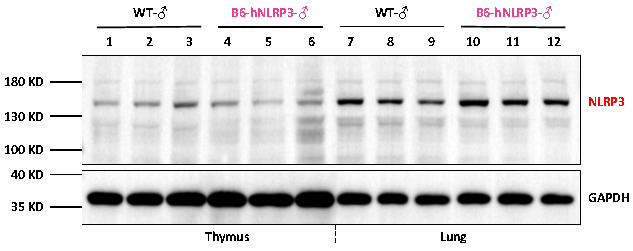
그림 8. Wild-Type(WT) 마우스 및 B6-hNLRP3 마우스의 흉선 및 폐 조직에서 인간 NLRP3 단백질의 발현 검출 결과.
참고: Wild-Type(WT) 마우스에서 관찰된 밴드는 항체의 교차 반응성에 의한 결과입니다. RT-qPCR 결과를 결합하여 인간 NLRP3 단백질이 B6-hNLRP3 마우스에 특이적으로 발현된다는 것을 확인합니다.
B6-hNLRP3 마우스 모델 (제품 번호: C001616)은 인간 NLRP3 유전자 및 단백질이 마우스 체내에서 안정적인 발현을 가능하게 합니다. 이 모델은 염증성 질환, 자가면역 질환, 신경퇴행성 질환, 대사성 질환 등 NLRP3 인플라마좀(inflammasome)과 관련된 질환 연구에 적합하며, NLRP3 타겟 치료제의 전임상 효능 평가에도 이상적인 연구 모델로 적용됩니다.
또한 Cyagen은 IL-1B, IL-1R1, IL-1RAP, IL-18, IL-18BP, IL-18R1 (IL-18RA), IL-18RAP (IL-18RB) 등 NLRP3 인플라마좀(inflammasome) 신호 경로의 주요 요소를 타겟으로 하는 인간화 마우스 모델도 개발하였습니다.
자세한 정보가 필요하시면 문의해 주시기 바랍니다.
Cyagen은 HUGO(Humanized Genomic Ortholog) 프로젝트를 시작했으며, 신약 개발을 지원하는 혁신적인 완전 인간화 모델을 개발하기 위해 협력할 글로벌 파트너를 모집하고 있습니다.
HUGO-GT™ 차세대 인간화 모델
HUGO-GT™(Genomic Ortholog for Gene Therapy) 마우스 모델은 기존의 연구 모델에 비해 보다 높은 수준의 인간화를 제공하며, 특히 안티센스 올리고뉴클레오티드(ASO), Targeted Gene Editing, siRNA(small interfering RNA)와 같은 유전자 서열 완전성을 요구하는 유전자 치료 약물을 평가하는 데 효과적인 모델로 적용됩니다.
Cyagen의 HUGO-GT™ 전체 게놈 인간화 마우스 모델은 IP Issue에 대한 걱정 없이 광범위한 intervention 타겟을 포함하고, 병원성 유전자 돌연변이 부위를 완전히 커버할 수 있는 독점적인 TurboKnockout-Pro 기술을 기반으로 개발되었습니다. HUGO-GT™ 모델 내의 완전 인간화된 타겟 유전자들은 인간이 가진 병원성 유전자와 일치하며, 대부분의 약물 타겟을 포괄하여 다양한 종류의 전임상 약물 실험에서 스크리닝 효율성을 크게 향상시킵니다.
HUGO-GT™ 차세대 인간화 모델
HUGO-Ab™(HUmanized Genomic Ortholog for Antibody Development) 마우스는 항체 발굴 모델에서 비약적인 발전을 이루었습니다. 이 마우스는 항체 가변 부위에 in vivo 완전 인간화 유전자가 있어 고친화도와 저면역원성을 가진 완전 인간 항체를 제작할 수 있습니다.
완전 인간 항체 발굴을 위한 HUGO-Ab™ 마우스
High-throughput 완전 인간화 항체 발굴 플랫폼
Cyagen의 HUGO-Ab™ 마우스와 Biointron의 AbDrop™을 결합하는 High-throughput 플랫폼을 통해 완전 인간화된 항체를 최대 3개월 이내에 발굴할 수 있습니다. 이 혁신적인 완전 인간 항체 발굴 플랫폼은 복잡한 유전자 편집이 없이 비용을 절감하고, 보다 안전하고 효과적인 항체 치료제 개발을 가속화합니다.
참고 문헌:
[1]Carpenter S, O'Neill LAJ. From periphery to center stage: 50 years of advancements in innate immunity. Cell. 2024 Apr 25;187(9):2030-2051.
[2]Pradeu T, Thomma BPHJ, Girardin SE, Lemaitre B. The conceptual foundations of innate immunity: Taking stock 30 years later. Immunity. 2024 Apr 9;57(4):613-631.
[3]Rathinam VA, Fitzgerald KA. inflammasome Complexes: Emerging Mechanisms and Effector Functions. Cell. 2016 May 5;165(4):792-800.
[4]Ke Q, Greenawalt AN, Manukonda V, Ji X, Tisch RM. The regulation of self-tolerance and the role of inflammasome molecules. Front Immunol. 2023 Apr 4;14:1154552.
[5]Swanson KV, Deng M, Ting JP. The NLRP3 inflammasome: molecular activation and regulation to therapeutics. Nat Rev Immunol. 2019 Aug;19(8):477-489.
[6]Andreeva L, David L, Rawson S, Shen C, Pasricha T, Pelegrin P, Wu H. NLRP3 cages revealed by full-length mouse NLRP3 structure control pathway activation. Cell. 2021 Dec 22;184(26):6299-6312.e22.
[7]Booshehri LM, Hoffman HM. CAPS and NLRP3. J Clin Immunol. 2019 Apr;39(3):277-286.
[8]Ma Q. Pharmacological Inhibition of the NLRP3 inflammasome: Structure, Molecular Activation, and Inhibitor-NLRP3 Interaction. Pharmacol Rev. 2023 May;75(3):487-520.
[9]Yao J, Sterling K, Wang Z, Zhang Y, Song W. The role of inflammasomes in human diseases and their potential as therapeutic targets. Signal Transduct Target Ther. 2024 Jan 5;9(1):10.
[10]Zhang X, Wang Z, Zheng Y, Yu Q, Zeng M, Bai L, Yang L, Guo M, Jiang X, Gan J. Inhibitors of the NLRP3 inflammasome pathway as promising therapeutic candidates for inflammatory diseases (Review). Int J Mol Med. 2023 Apr;51(4):35.
[11]Hoffman HM. Autoinflammatory disease: New mouse models and therapies. J Allergy Clin Immunol. 2020 Jan;145(1):116-118.
[12]Putnam CD, Broderick L, Hoffman HM. The discovery of NLRP3 and its function in cryopyrin-associated periodic syndromes and innate immunity. Immunol Rev. 2024 Mar;322(1):259-282.
[13]Snouwaert JN, Nguyen M, Repenning PW, Dye R, Livingston EW, Kovarova M, Moy SS, Brigman BE, Bateman TA, Ting JP, Koller BH. An NLRP3 Mutation Causes Arthropathy and Osteoporosis in Humanized Mice. Cell Rep. 2016 Dec 13;17(11):3077-3088.
[14]Wilhelmsen, K., Deshpande, A., Tronnes, S., et al. (2024, December 22). Discovery of a Potent and Selective Inhibitor of Human NLRP3 with a Novel Binding Modality and Mechanism of Action. bioRxiv. https://doi.org/10.1101/2024.12.21.629867
[15]Koller BH, Nguyen M, Snouwaert JN, Gabel CA, Ting JP. Species-specific NLRP3 regulation and its role in CNS autoinflammatory diseases. Cell Rep. 2024 Mar 26;43(3):113852.




영업일 기준 1-2일 내에 답변해 드리겠습니다.