

녹색형광단백질(green fluorescent protein, GFP)의 발견 이후, 형광 라벨링 기술은 유전학 연구에 큰 혁신을 가져왔습니다. tdTomato, EGFP와 같은 기존 형광 단백질이 여전히 실험실에서 중요한 위치를 차지하고 있지만, ChR2_H134R/EYFP, GCaMP6f, KikGR, Kaede, mNeonGreen 등 차세대 형광 단백질은 독특한 광학 특성과 다양한 기능으로 새롭게 주목받고 있습니다. 이러한 단백질을 통해 연구자들은 세포를 관찰할 수 있을 뿐만 아니라, 세포 조작, 질환 발병 기전 규명까지 할 수 있습니다.
신경과학, 발달 생물학, 신약 개발 분야의 연구자들에게 차세대 형광 리포터 마우스는 이제 단순한 세포 시각화를 넘어 정밀한 광유전학적(Optogenetics) 제어, 실시간 활동 모니터링, 복잡한 세포 Fate Mapping을 가능하게 하는 기능을 제공합니다. 이러한 첨단 마우스 모델은 여러 연구 분야에서 질환 발병 기전을 이해하고 치료법 발견을 가속하는 데 필수적인 연구 모델로 사용되고 있습니다.
본문에서는 상기 다섯 가지 차세대 형광 단백질의 고유한 기능을 살펴보고 유전자 변형 마우스 모델에 적용하여 신경과학 및 발달 생물학 연구를 어떻게 강화하고 있는지 살펴봅니다.
ChR2_H134R/EYFP: 광유전학적 신경 회로 제어의 ‘마스터 스위치’
ChR2_H134R/EYFP는 빛에 민감한 이온 채널(ChR2)과 강화된 황색 형광 단백질(EYFP)을 결합하여, 광유전학적 제어와 형광 기술의 정교한 융합을 나타냅니다. ChR2 단백질에 도입된 기능 강화 돌연변이(H134R)는 더 큰 전류, 더 높은 광감각성, 그리고 더 낮은 탈감각화 기능을 유발합니다. 황색 형광 단백질(EYFP)은 527nm의 파장으로 형광을 방출하며, 이는 청색광으로 활성화되는 ChR2_H134R (~470 nm)과 우수한 호환성을 보여 스펙트럼 중첩을 방지하고 신호 간섭을 최소화합니다.
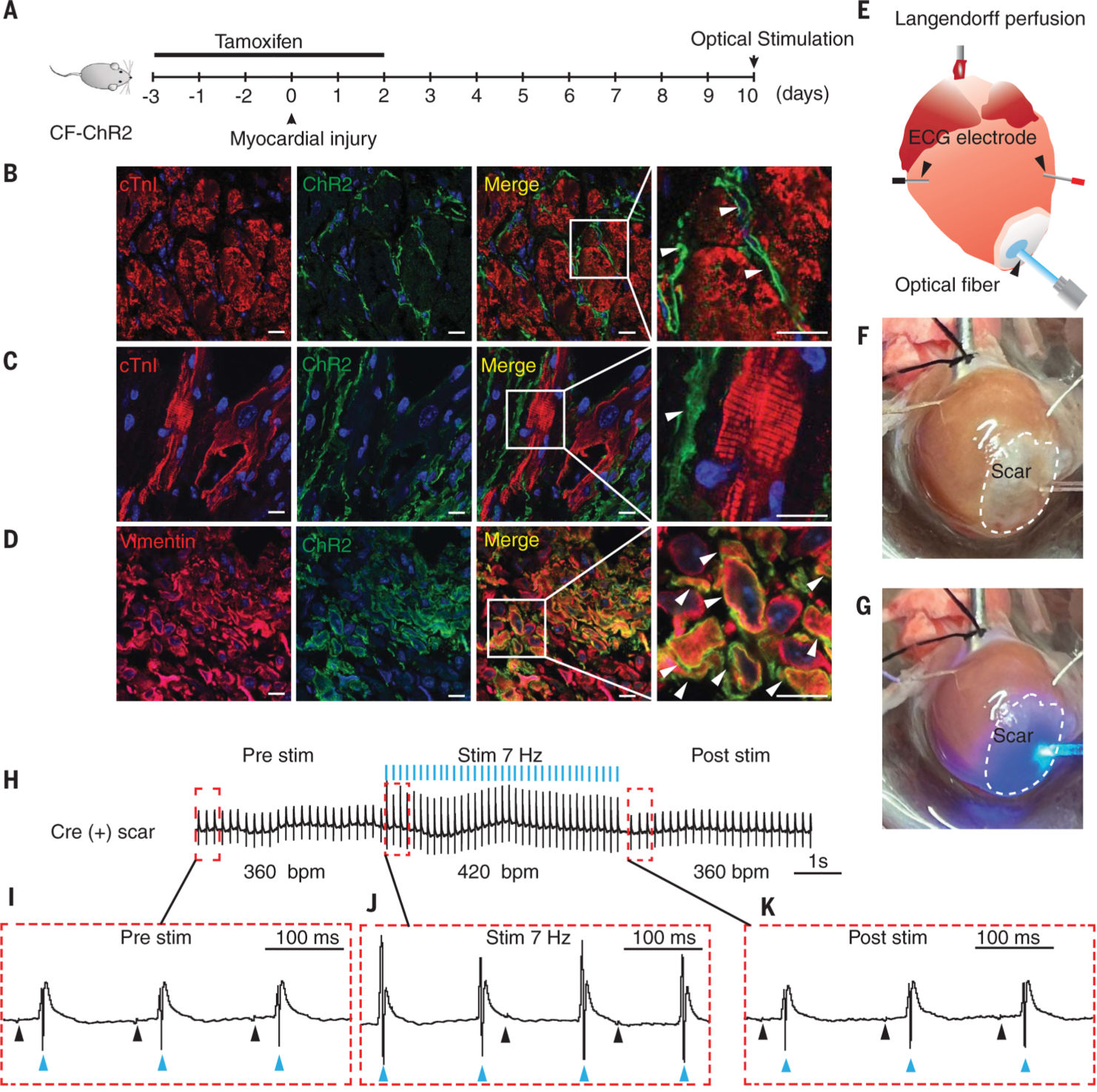
그림 1. 심장 섬유아세포 연구에 사용된 ChR2_H134R/EYFP 리포터 마우스 계통. [3]
RCL-ChR2_H134R/EYFP 마우스 모델 (제품 번호: I001027)은 Rosa26 locus에 조건부 발현되는 형광 리포터 모델로, loxP-Stop-loxP (LSL) 엘리먼트(element)에 의해 ChR2_H134R/EYFP의 발현이 조절됩니다. Cre 재조합 전, loxP-Stop-loxP (LSL) 엘리먼트에 의해 RCL-ChR2_H134R/EYFP의 발현이 차단되어 있으며, Cre-expressing 마우스와 교배하면, Cre 활성을 가지는 자손 마우스 조직에서 ChR2_H134R/EYFP 융합 단백질이 특이적으로 발현됩니다. RCL-ChR2_H134R/EYFP 마우스는 타겟 광유전학(Optogenetics) 연구에 이상적인 연구 모델입니다.
이 모델은 450~490nm 파장의 청색광 조사로 흥분성 세포를 정확하고 빠르게 활성화할 수 있어, in vivo 광유전학 연구에 적합합니다.
GCaMP6f: 고해상도의 Calcium Transients 및 신경 활성 시각화
칼슘 인디케이터(Calcium indicator)는 일반적으로 화학적 칼슘 인디케이터와 유전적으로 인코딩된 단백질 기반 칼슘 인디케이터(GECIs, Genetically Encoded Calcium Indicators)로 나누게 됩니다. 유전적으로 인코딩된 칼슘 인디케이터(GECIs)는 특정 타겟 세포 유형에 선택적으로 발현시킬 수 있어 뇌 기능 연구에 선호됩니다. GCaMP6는 뉴런 내의 Calcium Transients를 고감도로 검출할 수 있어, 신경 활성 측정을 위한 형광 기반 GECI로 널리 사용됩니다.
분자 기전
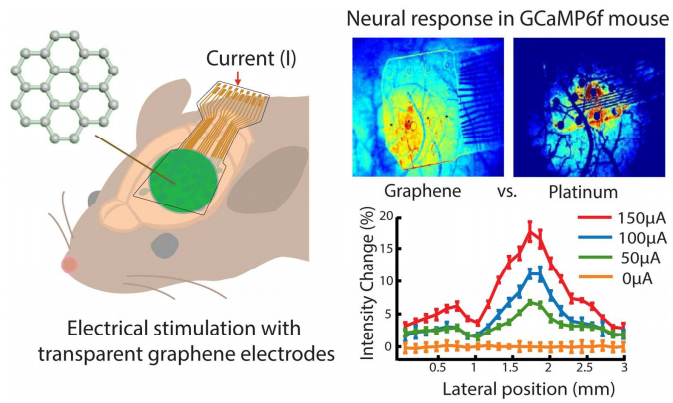
그림 2. 이식형 신경자극 치료에서 신경 신호 활성 모니터링을 위한 GCaMP6f 마우스의 활용 [5]
RCL-GCaMP6f 마우스 (제품 번호: I001028)은 Rosa26 locus에 조건부로 GCaMP6f 유전자를 발현하도록 설계된 형광 칼슘 인디케이터(Calcium indicator) 모델입니다. Cre 재조합 전, GCaMP6f의 발현은 upstream Stop 카세트에 의해 차단됩니다. Cre 마우스와 교배된 후, Cre 재조합 효소에 의해 매개되는 부위-특이적 재조합(Site-specific recombination)을 통해 Stop codon 서열이 제거되며, 칼슘 결합(예: 뉴런 활성화) 시 밝은 형광 신호가 관찰됩니다.
KikGR 및 Kaede: 역동적 세포 Fate Mapping을 위한 "시공간 기록기"
KikGR과 Kaede는 독특한 광전환 특성으로 형광 리포터 기술에 혁신을 가져온 광전환 형광 단백질(Photoconvertible fluorescent protein, PCFP)입니다. 기존의 형광 단백질과 달리, 이들은 자외선(UV)에 노출되면 녹색에서 적색 형광으로 비가역적으로 전환됩니다. 이 특성은 tdTomato와 같은 기존 형광 단백질의 시공간적 한계를 극복하며, 세포 추적 및 Fate Mapping 연구에 유용한 연구 도구로 활용됩니다. 포유류 세포에서 KikGR은 Kaede보다 더 높은 광전환 효율을 보이며, 녹색 및 적색 형광 상태에서 수 배 더 밝은 형광을 발현합니다. [6–7]
기존 형광 리포터와 대비한 KikGR 및 Kaede의 장점:
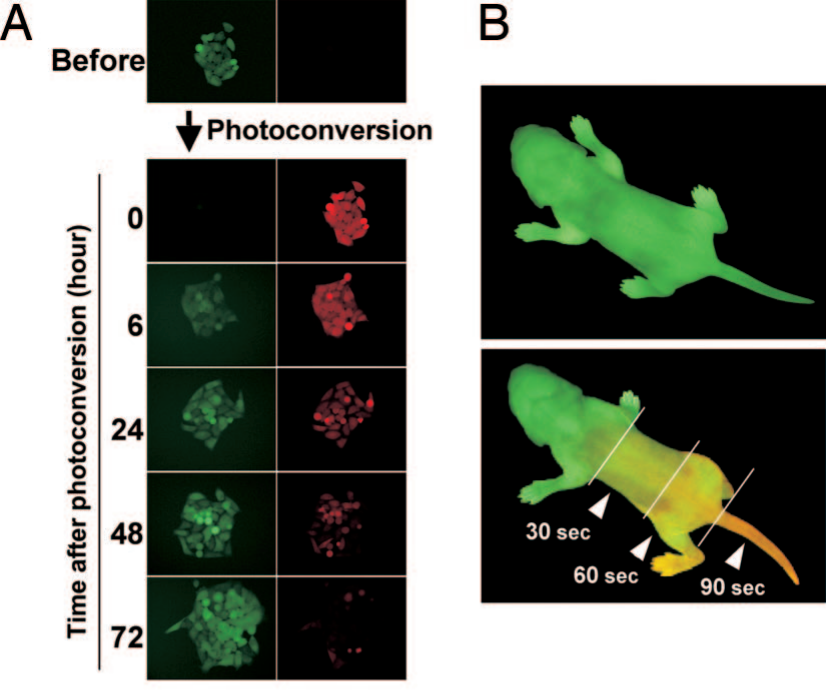
그림 3. 자외선 조사(UV illumination)는 Kaede 단백질을 발현하는 세포 및 Kaede Transgenic 마우스의 형광 특성을 변화시킵니다. [8]
Cyagen은 상기 2가지 광전환 단백질을 발현하는 마우스 모델을 제공합니다:
mNeonGreen: 초고해상도 이미징을 위한 "등대"
mNeonGreen은 녹색 형광 단백질(GFP)의 업그레이드 버전으로, 까다로운 이미징 응용에 적합하도록 성능이 크게 향상됩됩니다.
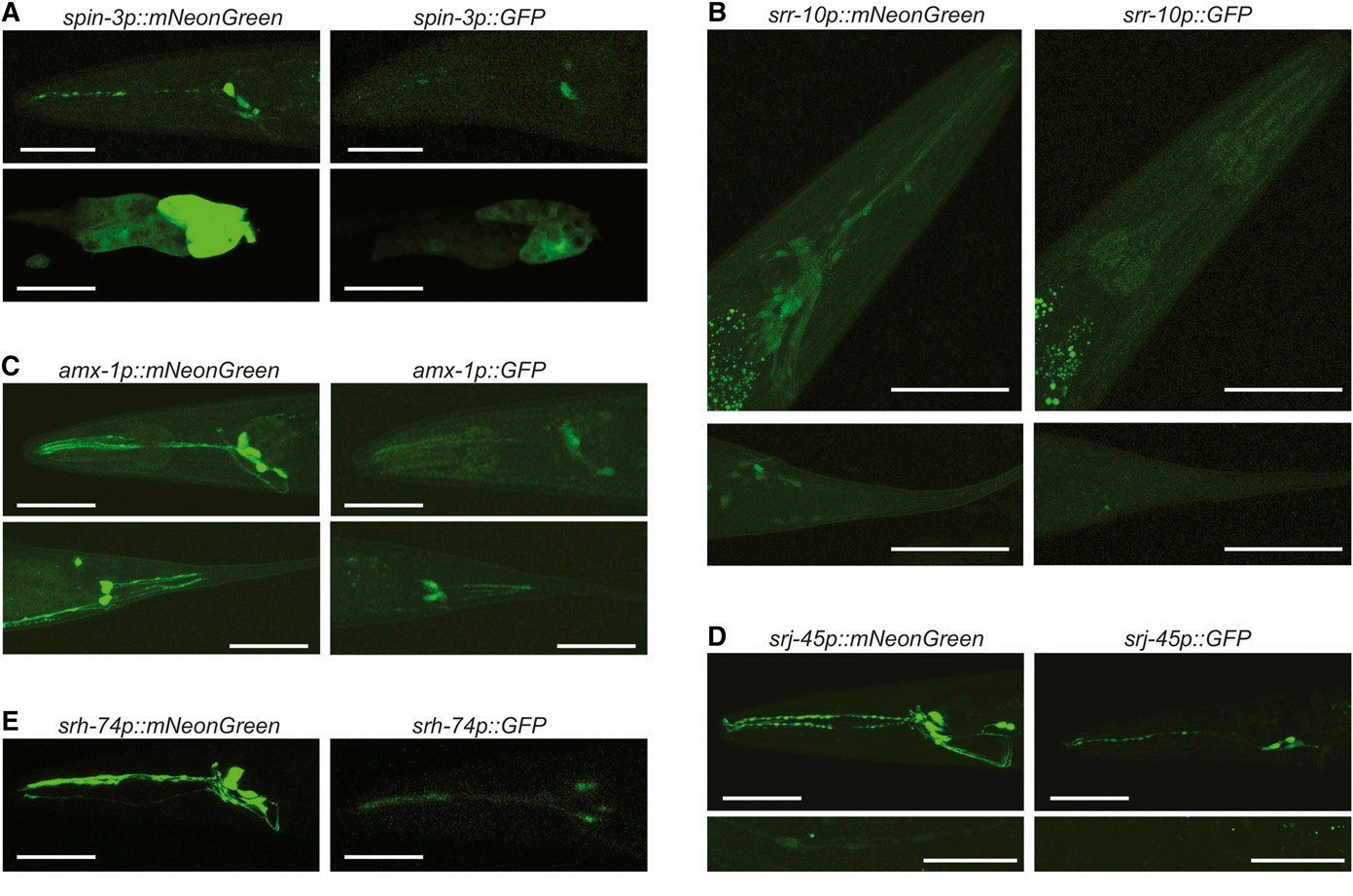
그림 4. mNeonGreen 단백질은 녹색 형광 단백질(GFP)에 비해 우수한 In Vivo Imaging 성능을 보여줍니다. [10]
TG-CAG-mito-mNeonGreen 마우스 (제품 번호: I001183)는 CAG-mito-mNeonGreen 유전자 발현 카세트를 마우스 게놈에 삽입하여 transgenic 기술로 제작되었습니다. 이 모델은 미토콘드리아의 기능, 위치 및 활동 특성을 연구하는 데 적합하며, 아세포 구조(subcellular structural)의 활동 특성 관찰을 위한 연구 모델입니다.
"저희는 더 밝은 형광뿐만 아니라 더 스마트한 빛이 필요합니다."
새로운 형광 단백질은 '세포의 시각화'에서 '생명 조작'으로 생명과학의 경계를 새롭게 정의하고 있습니다.
Cre 마우스: 조건부 발현을 위한 중요 연구 모델
Cre-loxP 부위-특이적 재조합 시스템은 마우스 및 Rats 모델에서 유전자 발현을 정밀하게 조절할 수 있는 유용한 연구 모델을 제공합니다. Cyagen은 약물 발견 및 신약 개발을 지원하기 위해 다양한 연구 목적에 맞춘 폭넓은 Cre 마우스 모델을 제공합니다. Cyagen의 Cre 마우스 라인에는 Cre 마우스, Cre 마우스 & 형광 리포터 마우스, Inducible Cre 마우스, Inducible Cre 마우스 & 형광 리포터 마우스, Dre 마우스 및 기타 특수화된 Cre 마우스 모델이 포함됩니다.
본문에서 소개한 실험에 사용된 Mrc1Cre 마우스는 Cyagen에서 제공됩니다.
Cre-loxP 부위-특이적 재조합 시스템은 마우스 및 Rats 모델에서 유전자 발현을 정밀하게 조절할 수 있는 유용한 연구 모델을 제공합니다. Cyagen은 약물 발견 및 신약 개발을 지원하기 위해 다양한 연구 목적에 맞춘 폭넓은 Cre 마우스 모델을 제공합니다. Cyagen의 Cre 마우스 라인에는 Cre 마우스, Cre 마우스 & 형광 리포터 마우스, Inducible Cre 마우스, Inducible Cre 마우스 & 형광 리포터 마우스, Dre 마우스 및 기타 특수화된 Cre 마우스 모델이 포함됩니다.
본문에서 소개한 실험에 사용된 Mrc1Cre 마우스는 Cyagen에서 제공됩니다.
|
제품 번호 |
모델명 |
응용 분야 |
|
C001552 |
Mb1-iCre |
Lymphoid B cells |
|
C001540 |
Cdh16-iCre |
Kidney, Ureter |
|
C001528 |
Col1a2-iCre |
Fibroblasts |
|
C001529 |
Adipoq-iCre |
Adipocytes |
|
C001536 |
Stra8-P2A-ZsGreen1-T2A-Cre |
Spermatogonia |
|
C001537 |
Pdx1-CreERT2 |
Islet cells (or Pancreatic islet cells) |
|
C001556 |
H11-CAG-MerCreMer |
Systemic |
|
C001558 |
Agrp-IRES-CreERT2-P2A-tdTomato |
Arcuate nucleus (ARC) region of the hypothalamus. |
|
CR002 |
SD-CAG-EGFP Rat |
Systemic |
|
CR003 |
SD-Rosa26-LSL-tdTomato Rat |
Systemic |
참고 문헌:
[1]Magown P, Shettar B, Zhang Y, Rafuse VF. Direct optical activation of skeletal muscle fibres efficiently controls muscle contraction and attenuates denervation atrophy. Nat Commun. 2015 Oct 13;6:8506.
[2]Ganji E, Chan CS, Ward CW, Killian ML. Optogenetic activation of muscle contraction in vivo. Connect Tissue Res. 2021 Jan;62(1):15-23.
[3]Wang Y, Li Q, Tao B, Angelini M, Ramadoss S, Sun B, Wang P, Krokhaleva Y, Ma F, Gu Y, Espinoza A, Yamauchi K, Pellegrini M, Novitch B, Olcese R, Qu Z, Song Z, Deb A. Fibroblasts in heart scar tissue directly regulate cardiac excitability and arrhythmogenesis. Science. 2023 Sep 29;381(6665):1480-1487.
[4]Park K, Liyanage AC, Koretsky AP, Pan Y, Du C. Optical imaging of stimulation-evoked cortical activity using GCaMP6f and jRGECO1a. Quant Imaging Med Surg. 2021 Mar;11(3):998-1009.
[5]Park DW, Ness JP, Brodnick SK, Esquibel C, Novello J, Atry F, Baek DH, Kim H, Bong J, Swanson KI, Suminski AJ, Otto KJ, Pashaie R, Williams JC, Ma Z. Electrical Neural Stimulation and Simultaneous in Vivo Monitoring with Transparent Graphene Electrode Arrays Implanted in GCaMP6f Mice. ACS Nano. 2018 Jan 23;12(1):148-157.
[6]Ando R, Hama H, Yamamoto-Hino M, Mizuno H, Miyawaki A. An optical marker based on the UV-induced green-to-red photoconversion of a fluorescent protein. Proc Natl Acad Sci U S A. 2002 Oct 1;99(20):12651-6.
[7]Tsutsui H, Karasawa S, Shimizu H, Nukina N, Miyawaki A. Semi-rational engineering of a coral fluorescent protein into an efficient highlighter. EMBO Rep. 2005 Mar;6(3):233-8.
[8]Tomura M, Yoshida N, Tanaka J, Karasawa S, Miwa Y, Miyawaki A, Kanagawa O. Monitoring cellular movement in vivo with photoconvertible fluorescence protein "Kaede" transgenic mice. Proc Natl Acad Sci U S A. 2008 Aug 5;105(31):10871-6.
[9]Hostettler L, Grundy L, Käser-Pébernard S, Wicky C, Schafer WR, Glauser DA. The Bright Fluorescent Protein mNeonGreen Facilitates Protein Expression Analysis In Vivo. G3 (Bethesda). 2017 Feb 9;7(2):607-615.
[10]Shaner NC, Lambert GG, Chammas A, Ni Y, Cranfill PJ, Baird MA, Sell BR, Allen JR, Day RN, Israelsson M, Davidson MW, Wang J. A bright monomeric green fluorescent protein derived from Branchiostoma lanceolatum. Nat Methods. 2013 May;10(5):407-9.




영업일 기준 1-2일 내에 답변해 드리겠습니다.