

상염색체 우성 다낭성 신종(Autosomal Dominant Polycystic Kidney Disease, ADPKD) 연구를 위한 유용한 신규 마우스 모델을 소개합니다.
상염색체 우성 다낭성 신종(ADPKD)은 전 세계에서 가장 흔한 유전성 신장 질환이며, 말기 신질환(End-Stage Renal Disease, ESRD)의 주요 원인 중 하나입니다. 이 질환의 주요 증상은 PKD1 유전자 돌연변이로 인한 양측 신장 낭종의 점진적인 형성입니다. 동물 모델 개발은 상염색체 우성 다낭성 신종(ADPKD)의 발병 기전을 밝히는 데 중요한 역할을 했지만, 기존 연구 모델은 높은 배아 치사율과 현저하지 않은 표현형 등 한계가 있었습니다.
Cyagen은 Tamoxifen-inducible, 신장 특이적(kidney-specific) Pkd1 Knockout 마우스 모델을 새롭게 개발하였으며, induction 후 3주 이내에 상염색체 우성 다낭성 신종(ADPKD)과 유사한 명확한 표현형을 관찰할 수 있습니다. 본문에서는 상염색체 우성 다낭성 신종(ADPKD)의 개요, 모델 구축 전략, 주요 표현형 데이터를 소개합니다.
>>Cyagen의 PKD(inducible) 마우스 모델 자세히 알아보기
상염색체 우성 다낭성 신종(ADPKD)의 전 세계 발생률 및 병리 기전
상염색체 우성 다낭성 신종(ADPKD)은 가장 흔한 유전성 신장 질환으로, 전 세계적으로 1,200만 명 이상의 환자가 있으며, 말기 신질환(ESRD)의 주요 원인 중 하나입니다.[3,4] 상염색체 우성 다낭성 신종(ADPKD)의 글로벌 유병률은 400~1,000명당 1명꼴로 추정되며, 중국에는 약 125만 명, 미국에는 약 50만 명의 환자가 있는 것으로 알려져 있습니다. 인종에 따라 유병률 차이가 있을 수 있습니다. [4,5]
환자 양측 신장에 점진적으로 낭종이 형성되며, 신장이 커지고 기능이 감소하는 것은 상염색체 우성 다낭성 신종(ADPKD)의 병리적 특징입니다. 다수의 환자가 투석 치료 또는 신장이식이 필요하게 됩니다. [1]
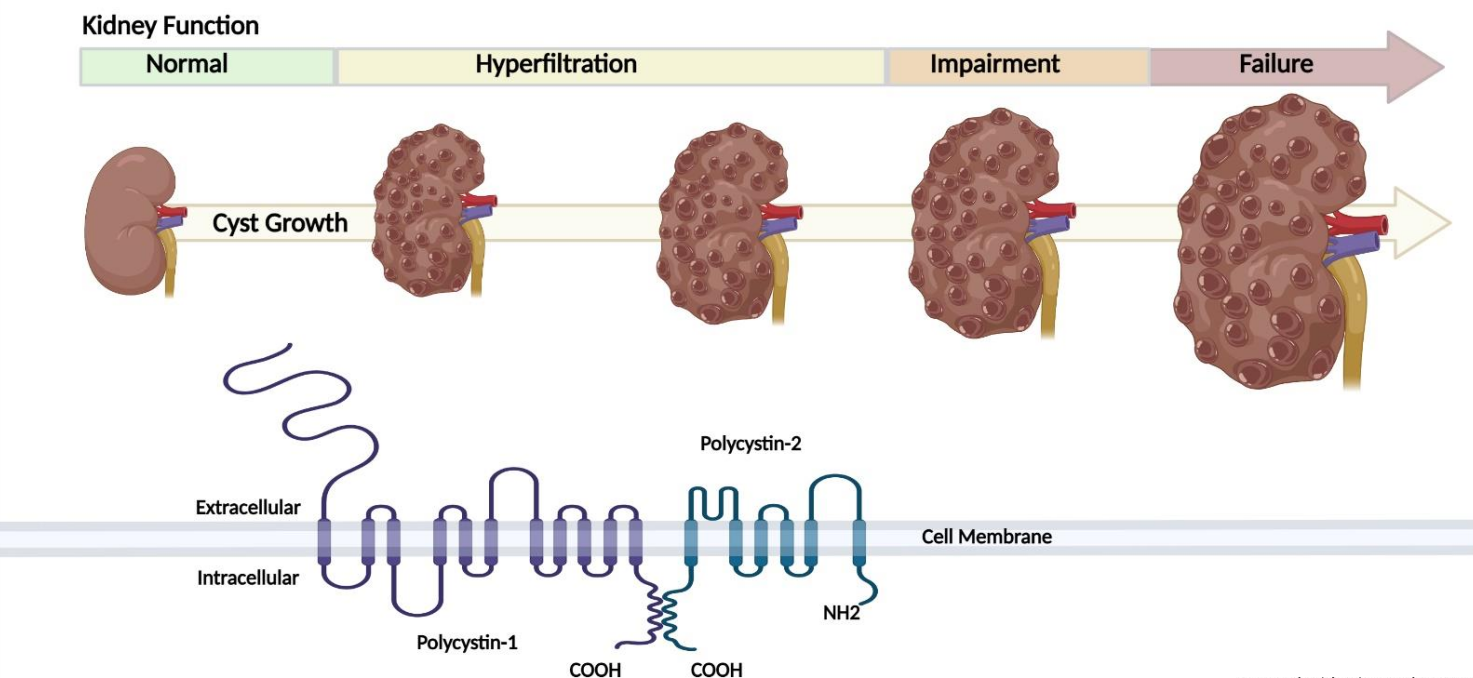
그림 1. 상염색체 우성 다낭성 신종(ADPKD)의 질환 진행 과정 [2]
상염색체 우성 다낭성 신종(ADPKD)의 주요 원인: PKD1 유전자 돌연변이
상염색체 우성 다낭성 신종(ADPKD)은 주로 PKD1 유전자의 상염색체 우성(Autosomal dominant) 돌연변이에 의해 발생합니다. 이는 유전체 중 하나의 copy만 손실되거나 돌연변이를 일으켜도 질환이 발현될 수 있다는 것을 의미합니다. 연구에 따르면 전체 상염색체 우성 다낭성 신종(ADPKD) 환자의 80% 이상이 PKD1 유전자 돌연변이와 관련이 있습니다. [6]
PKD1 유전자가 인코딩하는 Polycystin-1(PC1) 단백질과 PKD2 유전자가 인코딩하는 Polycystin-2(PC2) 단백질이 상호작용을 하여 단백질 복합체를 형성합니다. 이 복합체는 세포 내 칼슘 항상성(Calcium homeostasis) 및 세포 기계적 신호 전달을 조절하며, 신세뇨관의 구조와 기능을 유지하는 데 핵심적인 역할을 합니다. [7] PKD1 유전자에 돌연변이가 발생하면 PC1 단백질의 기능이 손상되어 세포 및 섬모의 신호 전달 이상을 일으켜, 결국 세포의 비정상적인 증식과 낭종 형성이 유발됩니다. [8]
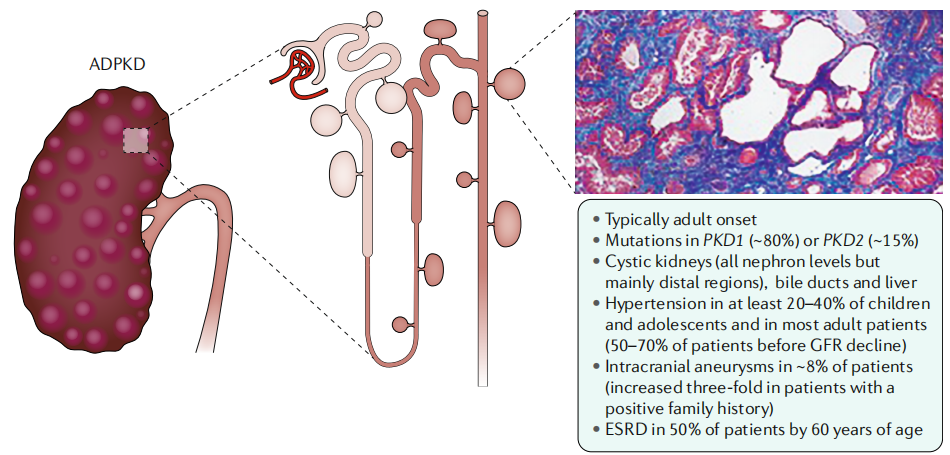
그림 2. PKD1 유전자 돌연변이는 상염색체 우성 다낭성 신종(ADPKD)의 주요한 유전적 요인입니다. [8]
PKD1 유전자의 돌연변이는 높은 이질성을 가지며, 다음과 같은 다양한 유형이 포함됩니다:
- Truncating Mutation. 예: Frameshift Mutation, Nonsense Mutation.
- Non-truncating Mutation. 예: Missense Mutation, Splice-site Mutation.
PKD1 유전자의 돌연변이 유형은 일반적으로 다음과 같이 질환의 중증도와 관련이 있습니다:
상염색체 우성 다낭성 신종(ADPKD) 연구의 최적 모델: Inducible 조건부 Pkd1 Knockout 마우스
상염색체 우성 다낭성 신종(ADPKD) 연구에서 마우스 모델은 필수적인 연구 모델이며, PKD1 관련 모델이 가장 많이 연구되고 있습니다. 초기 연구에서 사용한 전신성 Pkd1 Knockout 마우스는 PKD1 유전자의 역할을 이해하는 데 중요한 기여를 했지만, 다음과 같은 한계가 존재합니다:
이러한 한계를 극복하기 위해, 연구자들은 다양한 조건부 inducible Pkd1 Knockout 마우스 모델을 개발했습니다. 이 모델은 특정 발생 단계 또는 성체 이후 시점에 유전자 비활성화를 유도할 수 있어, 질환의 발병 시간과 위치를 조절할 수 있습니다. 예를 들어, Cre-LoxP 재조합 시스템을 통해 특정 조직 또는 특정 발달 단계에서 PKD1 유전자의 비활성을 유도하여, 기존 Pkd1 Knockout 마우스에서 발생하는 배아 치사 문제를 피할 수 있습니다.
Tamoxifen에 의해 유도되는 신장 특이적 Cre 재조합 효소를 사용하면, PKD1 유전자는 신장 조직에서 선택적으로 제거될 수 있으며, 전신적인 영향을 최소화하면서 상염색체 우성 다낭성 신종(ADPKD)의 기전을 연구하고 잠재적 치료법을 평가할 수 있는 정밀한 연구 방법을 제공합니다.[13,14] 이러한 첨단 모델은 상염색체 우성 다낭성 신종(ADPKD) 신약 개발을 위한 전임상 연구에 필수적인 역할을 합니다.
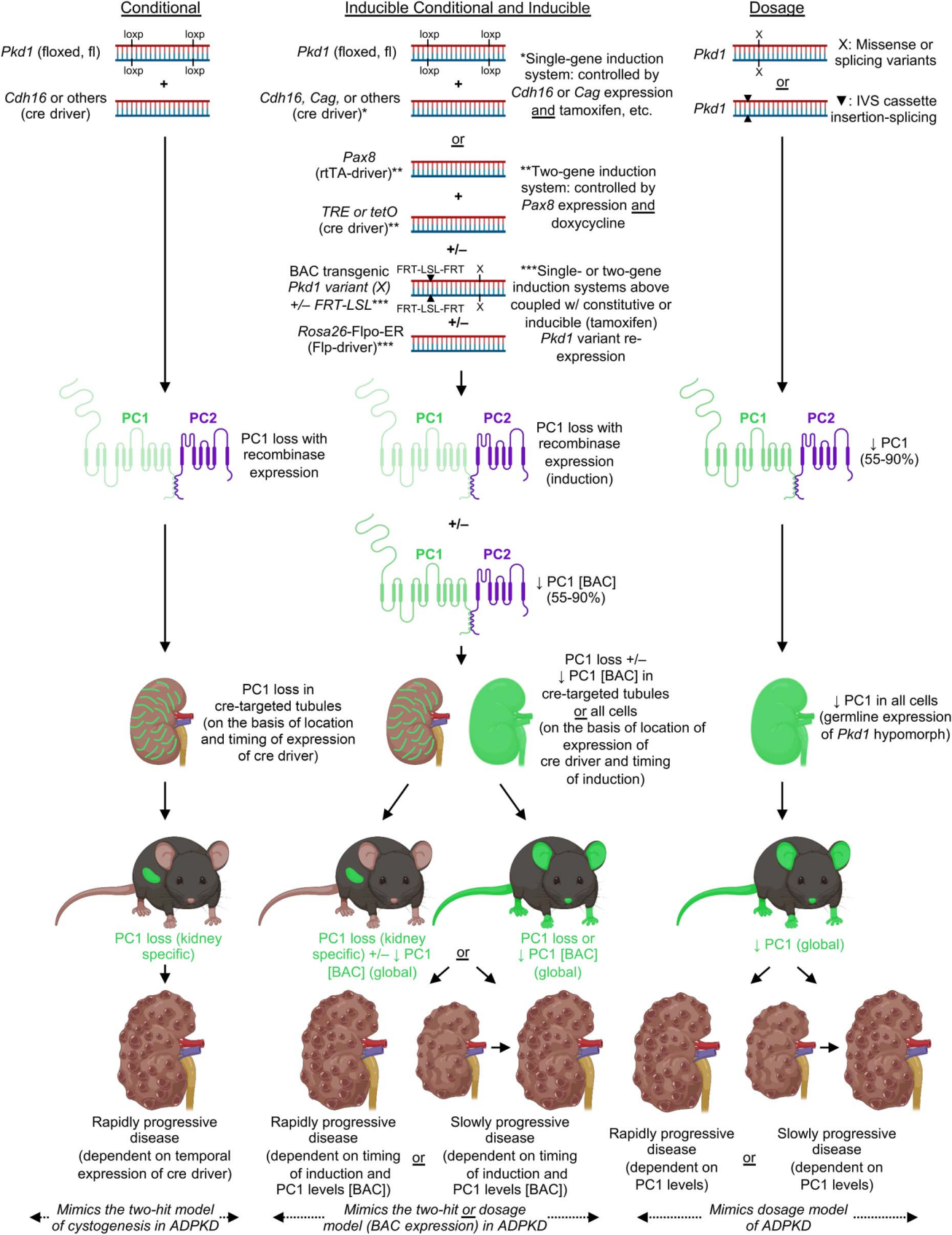
그림 3. Inducible 신장 특이적 Pkd1 Knockout 마우스는 상염색체 우성 다낭성 신종(ADPKD) 연구에 더 적합한 모델을 제공합니다. [14]
Cyagen Inducible PKD 마우스 모델의 주요 특성
모델명: PKD (inducible) mouse
제품 번호: I001225
Genotype: Pkd1-flox × Cdh16-MerCreMer (Product No.: C001432)
유도 방식: 수유기 중 Tamoxifen 투여
Cyagen에서 독자적으로 개발한 Inducible 조건부 Pkd1 Knockout 마우스 모델(제품 번호: I001225)은 Tamoxifen 유도 신장 특이적 Cre 발현 마우스(Cdh16-MerCreMer, 제품 번호: C001432)와 Pkd1-flox 마우스를 교배한 후, offspring 마우스에게 수유기 중 Tamoxifen을 투여하여 제작됩니다.
Cdh16-MerCreMer transgene은 Cre 재조합효소의 활성을 신장 조직에 제한하고, Tamoxifen을 통해 시기별 유전자 조절이 가능해집니다. 이를 통해 연구자는 특정 시간에 신장 특이적 Pkd1 유전자의 결손을 유도할 수 있으며, 생리학적으로 더욱 적합한 상염색체 우성 다낭성 신종(ADPKD) 모델을 확보할 수 있습니다.
선행 연구 결과에 따르면, Tamoxifen 유도 후 3주 이내에 일부 마우스에서 상염색체 우성 다낭성 신종(ADPKD) 표현형이 뚜렷하게 나타났으며, 구체적으로 다음과 같은 표현형이 포함됩니다:
다음은 Cyagen의 Inducible PKD 마우스 모델의 표현형 초기 데이터를 제시합니다.
1. 신장 낭종 형성 및 신장 비대
Tamoxifen 유도 후 3주 및 6주 시점에서 일부 마우스를 무작위로 선별하여 신장 절개 및 무게 측정을 실시했습니다. 그 결과, PKD (inducible) 마우스는 유도 후 3주 만에 명확한 상염색체 우성 다낭성 신종(ADPKD) 표현형을 나타냈으며, 성별 및 개체 간의 차이도 관찰되었습니다.
6주간의 관찰 기간, 무작위로 선별한 PKD (inducible) 마우스에서 수컷 마우스는 암컷보다 더 높은 빈도(71% vs. 33%)로 낭성 신장 질환(Cystic kidney disease)을 나타냈으며, 질환 진행이 더 심각할 가능성도 추정되었습니다.
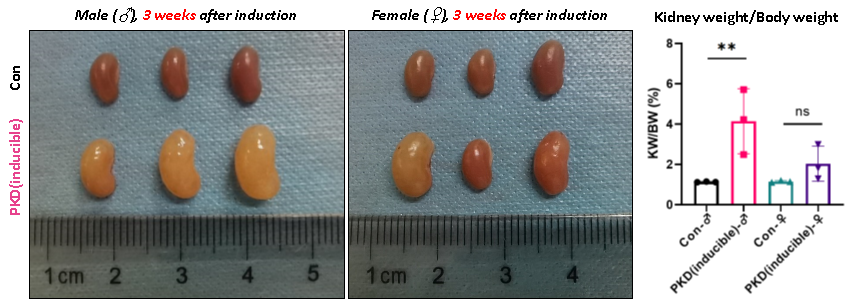
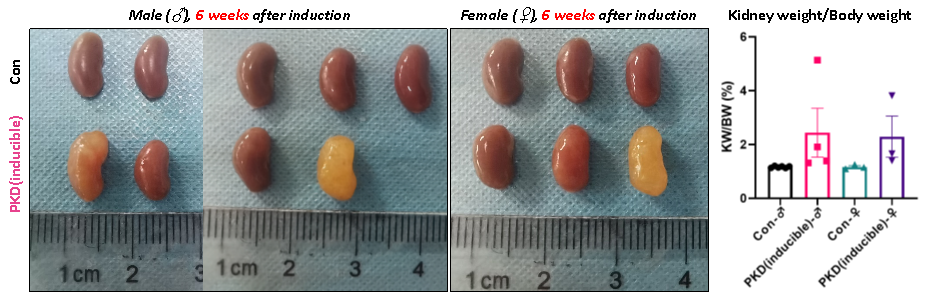
그림 4. PKD (Inducible) 마우스와 대조군 (Con) 마우스 간의 신장 형태 및 무게 비교.
2. 신장 기능 평가: 혈중 요소 질소(BUN) 및 Creatinine(CREA)
신장 기능을 평가하기 위해, Tamoxifen 유도된 3주 후 무작위로 선택한 일부 마우스에서 혈청 생화학 검사를 수행하였습니다.
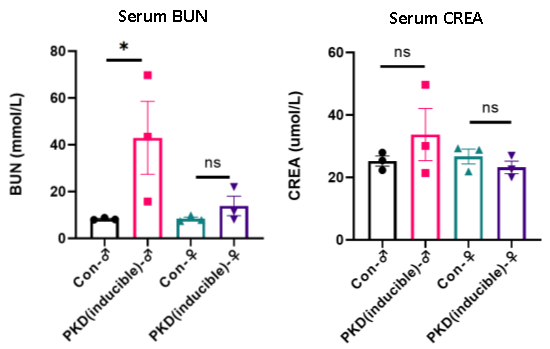
그림 5. PKD (Inducible) 마우스와 대조군 (Con) 마우스 간의 혈중 요소 질소(BUN) 및 Creatinine(CREA) 수치 비교
PKD (Inducible) 마우스 모델(제품 번호: I001225)은 Pkd1-flox 마우스와 Tamoxifen-inducible, 신장 특이적 Cre driver 마우스(Cdh16-MerCreMer, 제품번호: C001432)를 교배하여 제작된 조건부 inducible Pkd1 Knockout 모델입니다. 이 모델은 질환 진행 양상을 정밀하게 재현할 수 있는 높은 능력을 보여줍니다. 실험 데이터에 따르면 Tamoxifen 유도 후 3주 만에 일부 마우스에서 신장 낭종 형성, 현저한 신장 비대, 혈중 요소 질소(BUN) 수치 상승 등 심각한 다낭성 신장 질환(PKD) 증상이 관찰되었습니다.
이러한 초기 연구 결과는 PKD (Inducible) 마우스 모델이 조기 발현되는 중증 상염색체 우성 다낭성 신종(ADPKD) 유사 표현형을 효과적으로 재현하는 것을 시사하며, 질환 발병 기전 및 치료 전략 연구에 유용한 연구 모델입니다. Cyagen의 PKD (Inducible) 마우스 모델은 다음과 같은 연구에 적용됩니다:
향후 Cyagen은 PKD (Inducible) 모델을 장기적으로 추적 관찰하여 질환 후기 표현형 진행 및 질환 진행 전체 과정을 정밀히 기록할 계획이며, 추가적인 질환 병리 분석도 함께 진행하여 더욱 풍부한 연구 데이터를 제공할 예정입니다.
Cyagen의 광범위한 대사 질환 모델링 포트폴리오
Cyagen은 상염색체 우성 다낭성 신종(ADPKD) 외에도 신약 개발 및 중개 연구를 위한 다양한 대사 질환 및 심혈관 질환 마우스 모델을 제공합니다. Cyagen은 전 세계 바이오텍 기업, 제약사 및 학술 기관과의 협업을 통해 다양한 연구 프로젝트를 수행하고 있습니다.
Cyagen에서 다음과 같은 다양한 대사 질환 모델을 구축하여 질환 발병 기전 연구 및 신약 개발을 지원하고 있습니다:
자세한 정보는 아래 모델 리스트를 확인하시거나 웹페이지를 통해 Cyagen의 대사 질환 모델을 알아보세요.
|
제품 번호 |
모델명 |
품종 계통 |
응용 분야 |
|
C001507 |
C57BL/6JCya |
Atherosclerosis, Hypercholesterolemia, Metabolic Dysfunction-Associated Steatohepatitis (MASH) |
|
|
C001067 |
APOE |
C57BL/6NCya |
Atherosclerosis |
|
C001291 |
B6-db/db |
C57BL/6JCya |
High Blood Sugar and Obesity |
|
C001392 |
C57BL/6JCya |
Familial Hypercholesterolemia |
|
|
C001368 |
C57BL/6JCya |
Type 2 Diabetes and Obesity |
|
|
C001232 |
C57BL/6JCya |
Hyperuricemia |
|
|
C001267 |
C57BL/6NCya |
Copper Metabolism Disorder, Wilson's Disease |
|
|
C001265 |
C57BL/6NCya |
Primary Ciliary Dyskinesia |
|
|
C001266 |
C57BL/6NCya |
Klinefelter Syndrome |
|
|
C001273 |
C57BL/6NCya |
Phenylketonuria Type 1 |
|
|
C001383 |
Alb-Cre/LSL-hLPA |
C57BL/6NCya |
Cardiovascular Targets |
|
C001421 |
C57BL/6NCya |
Metabolic Targets |
|
|
C001400 |
C57BL/6JCya |
Metabolic Targets |
|
|
C001493 |
FVB |
Diseases Related to Blood-Brain Barrier Permeability |
|
|
C001532 |
C57BL/6JCya |
Hereditary Angioedema(HAE) |
|
|
C001549 |
C57BL/6NCya |
Research on diet-induced obesity, diabetes, inflammation, fatty liver, and other metabolic diseases; drug development, screening, and preclinical efficacy evaluation for obesity. |
|
|
C001553 |
C57BL/6NCya |
Familial hypercholesterolemia (FH); atherosclerotic cardiovascular disease (ASCVD); other cardiovascular diseases (CVD). |
|
|
C001560 |
C57BL/6JCya |
Phenylketonuria (PKU) |
|
|
I001220 |
C57BL/6Cya |
Research on PCSK9-targeted drug development; studies on metabolic diseases such as hyperlipidemia, stroke, coronary heart disease, and familial hypercholesterolemia (FH). |
|
|
I001223 |
C57BL/6NCya |
Fabry Disease (FD) |
|
|
C001583 |
FVB/NJCya |
Propionic Acidemia (PA) |
|
|
C001590 |
FVB/NJCya |
Progressive Familial Intrahepatic Cholestasis Type 3 (PFIC3) |
|
|
C001594 |
C57BL/6JCya |
Glutaric aciduria type I (GA1) |
|
|
C001600 |
C57BL/6NCya; C57BL/6JCya |
Type 2 Diabetes, Obesity, and Metabolic Disorders Associated with Improper Fat Distribution and Storage |
|
|
C001601 |
C57BL/6NCya; C57BL/6JCya |
Type 2 Diabetes and Obesity |
|
|
C001591 |
C57BL/6NCya; C57BL/6JCya |
Familial hypercholesterolemia (FH); atherosclerotic cardiovascular disease (ASCVD); other cardiovascular diseases (CVD) |
|
|
C001609 |
C57BL/6JCya |
Hypertrophic Cardiomyopathy (HCM) and Dilated Cardiomyopathy (DCM) |
|
|
I001121 |
C57BL/6JCya |
Research on emphysema and chronic obstructive pulmonary disease (COPD), cirrhosis, and hepatocellular carcinoma |
|
|
I001225 |
C57BL/6NCya; C57BL/6JCya |
Autosomal Dominant Polycystic Kidney Disease (ADPKD) and Renal Tubular Biology |
|
Diet-Induced Metabolic Dysfunction-Associated Steatotic Liver Disease (MASLD) Model |
|||
참고 문헌:
[1]Leslie SW, et al. Autosomal Dominant Polycystic Kidney Disease. [Updated 2024 Mar 20]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan.
[2]Steele C, Nowak K. Obesity, Weight Loss, Lifestyle Interventions, and Autosomal Dominant Polycystic Kidney Disease. Kidney Dial. 2022 Mar;2(1):106-122.
[3]Harris PC, Torres VE. Polycystic kidney disease. Annu Rev Med. 2009;60:321-37.Mahboob M, Rout P,
[4]Kidney Disease: Improving Global Outcomes (KDIGO) ADPKD Work Group. KDIGO 2025 Clinical Practice Guideline for the Evaluation, Management, and Treatment of Autosomal Dominant Polycystic Kidney Disease (ADPKD). Kidney Int. 2025 Feb;107(2S):S1-S239.
[5]Mei CL, Xue C, Yu SQ, Dai B, Chen JH, Li Y, Chen LM, Liu ZS, Wu YG, Hu Z, Zha Y, Liu H, Zhuang YZ, Zhang C, Xiao XC, Wang Y, Li GS, Ma YY, Li L. Executive Summary: Clinical Practice Guideline for Autosomal Dominant Polycystic Kidney Disease in China. Kidney Dis (Basel). 2020 May;6(3):144-149.
[6]Rossetti S, Hopp K, Sikkink RA, Sundsbak JL, Lee YK, Kubly V, Eckloff BW, Ward CJ, Winearls CG, Torres VE, Harris PC. Identification of gene mutations in autosomal dominant polycystic kidney disease through targeted resequencing. J Am Soc Nephrol. 2012 May;23(5):915-33.
[7]Su Q, Hu F, Ge X, Lei J, Yu S, Wang T, Zhou Q, Mei C, Shi Y. Structure of the human PKD1-PKD2 complex. Science. 2018 Sep 7;361(6406):eaat9819.
[8]Bergmann C, Guay-Woodford LM, Harris PC, Horie S, Peters DJM, Torres VE. Polycystic kidney disease. Nat Rev Dis Primers. 2018 Dec 6;4(1):50.
[9]Cornec-Le Gall E, Audrézet MP, Chen JM, Hourmant M, Morin MP, Perrichot R, Charasse C, Whebe B, Renaudineau E, Jousset P, Guillodo MP, Grall-Jezequel A, Saliou P, Férec C, Le Meur Y. Type of PKD1 mutation influences renal outcome in ADPKD. J Am Soc Nephrol. 2013 May;24(6):1006-13.
[10]Rossetti S, Burton S, Strmecki L, Pond GR, San Millán JL, Zerres K, Barratt TM, Ozen S, Torres VE, Bergstralh EJ, Winearls CG, Harris PC. The position of the polycystic kidney disease 1 (PKD1) gene mutation correlates with the severity of renal disease. J Am Soc Nephrol. 2002 May;13(5):1230-7.
[11]Leonhard WN, Happe H, Peters DJ. Variable Cyst Development in Autosomal Dominant Polycystic Kidney Disease: The Biologic Context. J Am Soc Nephrol. 2016 Dec;27(12):3530-3538.
[12]Takakura A, Contrino L, Beck AW, Zhou J. Pkd1 inactivation induced in adulthood produces focal cystic disease. J Am Soc Nephrol. 2008 Dec;19(12):2351-63.
[13]Happé H, Peters DJ. Translational research in ADPKD: lessons from animal models. Nat Rev Nephrol. 2014 Oct;10(10):587-601.
[14]Sieben CJ, Harris PC. Experimental Models of Polycystic Kidney Disease: Applications and Therapeutic Testing. Kidney360. 2023 Aug 1;4(8):1155-1173.




영업일 기준 1-2일 내에 답변해 드리겠습니다.