

발전적인 척수성 근위축증(SMA) 마우스 모델 연구
척수성 근위축증(Spinal Muscular Atrophy, SMA)은 전 세계적으로 영유아에게 영향을 미치는 가장 치명적인 유전 질환 중 하나입니다. 제약사들이 효과적인 치료제 개발을 서두르는 가운데, 연구자들은 실험실 환경에서 인간 척수성 근위축증(SMA) 유전학적 특성을 정확히 모델링하는 데 어려움을 겪고 있습니다. 연구의 핵심은 자연적인 질병 조절체(Disease modifier)인 SMN2 copy의 수량을 이해하고 조절하는 데 있습니다.
Cyagen은 다양한 인간 SMN2 copy를 도입한 인간화 마우스 모델을 개발하여 상기 연구 격차를 해소했습니다. 이 모델은 척수성 근위축증(SMA) I형, II형, III형의 질환 중증도를 반영한 전 범위의 질환 스펙트럼을 구현하며, SMN2를 타겟으로 하는 치료법을 연구하고 검증할 수 있는 유용한 연구 모델입니다. 이 정밀한 모델은 실험 발견에서 임상 적용으로의 전환을 가속할 수 있습니다.
본문에서는 이러한 혁신적인 마우스 모델이 인간 척수성 근위축증(SMA)의 병리 특성을 어떻게 재현하는지, 그리고 학계와 제약 산업에서 차세대 SMA 치료제 개발을 위해 SMA 마우스는 필수적인 연구 모델이 되는 이유를 살펴봅니다.
척수성 근위축증(SMA) 이해하기: 질환 발병 기전 및 치료 접근법
척수성 근위축증(SMA)은 SMN1 유전자의 돌연변이로 인해 발생하는 유전성 신경 근육 질환으로, SMN 단백질의 결핍을 초래합니다. 이로 인해 척수 전각 운동 신경세포가 퇴행하고, 근력 약화 및 근육 위축이 발생합니다. 척수성 근위축증(SMA)은 영유아 사망의 가장 흔한 유전적 원인으로, 발병 시기가 빠를수록 질환의 중증도가 높아지며, 2세 미만 환아의 평균 생존 기간은 약 10개월에 불과합니다. [1]
인간 게놈에는 SMN1과 높은 상동성을 가진 SMN2 유전자가 존재합니다. SMN2는 기능성 SMN 단백질을 적게 생성하지만, 유전자 copy 수가 많을수록 증상이 경미한 경향이 있습니다. 따라서 SMN2 발현을 조절하여 기능성 SMN 단백질 수준을 증가시키는 것이 척수성 근위축증(SMA) 치료의 주요 전략으로 자리 잡고 있습니다. [2]
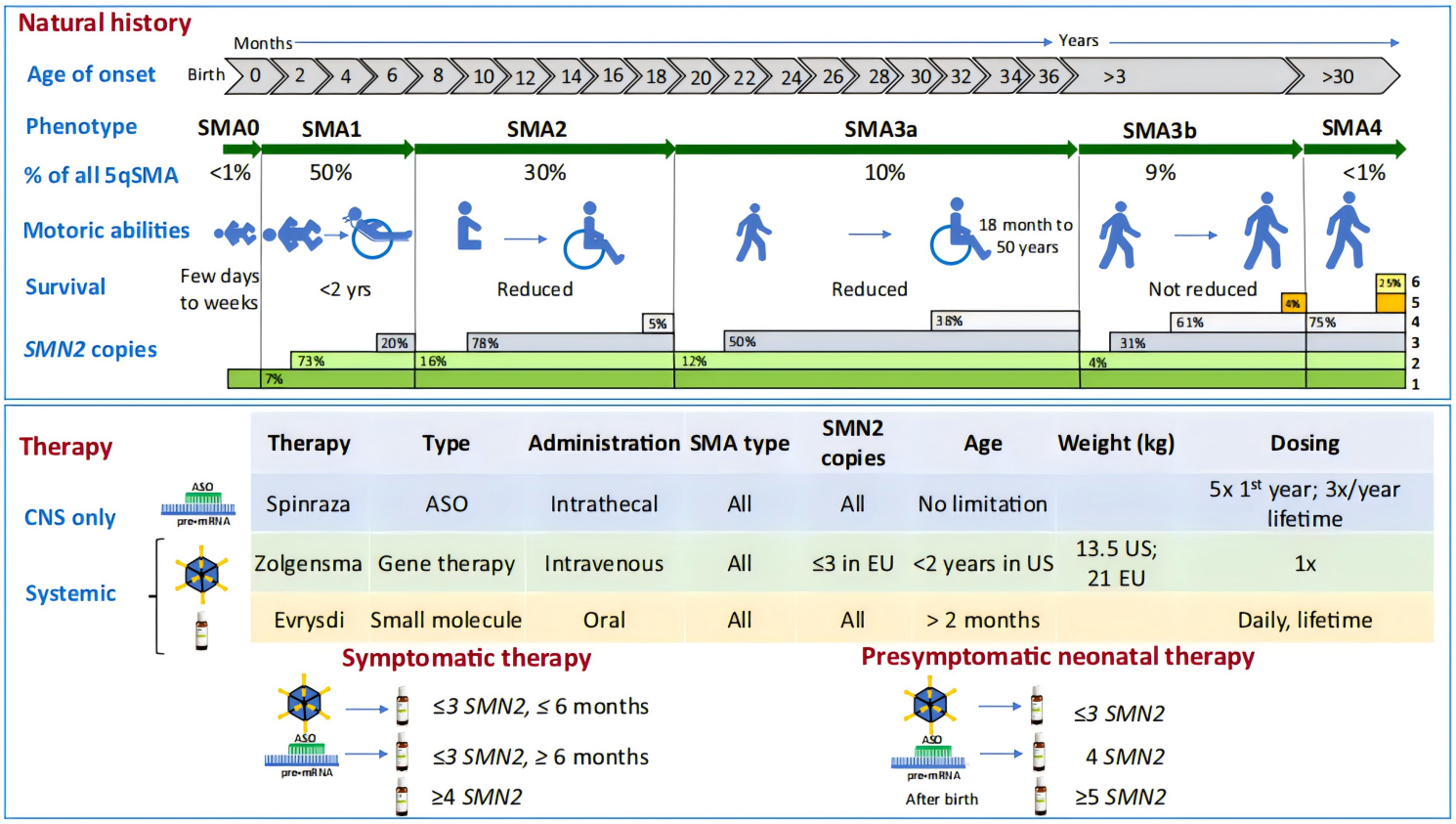
그림 1. 척수성 근위축증(SMA)의 자연사 및 치료 접근법. [2]
척수성 근위축증(SMA)의 근본 원인: SMN1의 이중 대립유전자 결실
SMN1(Survival Motor Neuron 1) 유전자는 인체 전반에 걸쳐 발현되며, 특히 척수에서 높은 발현 수준을 보입니다. SMN1 유전자가 인코딩하는 SMN 단백질은 세포 생존에 필수적인 "하우스키핑 단백질(Housekeeping Protein)"로 간주됩니다. SMN 단백질은 스플라이스좀 단백질 복합체(Spliceosomal protein complex)의 조립에 핵심적인 역할을 하며, 이는 운동 신경세포의 생존, 기능 유지, 축삭 발달에 직접적인 영향을 미칩니다. [3, 4]
SMN1의 이중 대립유전자가 결실되면, SMN 단백질이 중대한 수준으로 결핍되어 비정상적인 RNA 스플라이싱이 유발되고, 척수 운동 신경세포 기능이 손상됩니다. 그 결과, 운동 신경세포가 점진적으로 퇴행하고 골격근 탈신경화(Denervation)가 발생하며, 결국 근력 약화 및 근육 위축으로 이어집니다. 이러한 퇴행은 환자의 운동 능력을 심각하게 저하시키고 생명을 위협할 수 있습니다. [3, 4]
따라서, 조기 개입 치료가 매우 중요합니다. 회복 불가능한 운동 신경세포 손실이 발생하기 전에 치료를 시작하면, 생존을 유지하고 운동 기능 회복 가능성을 극대화할 수 있습니다.
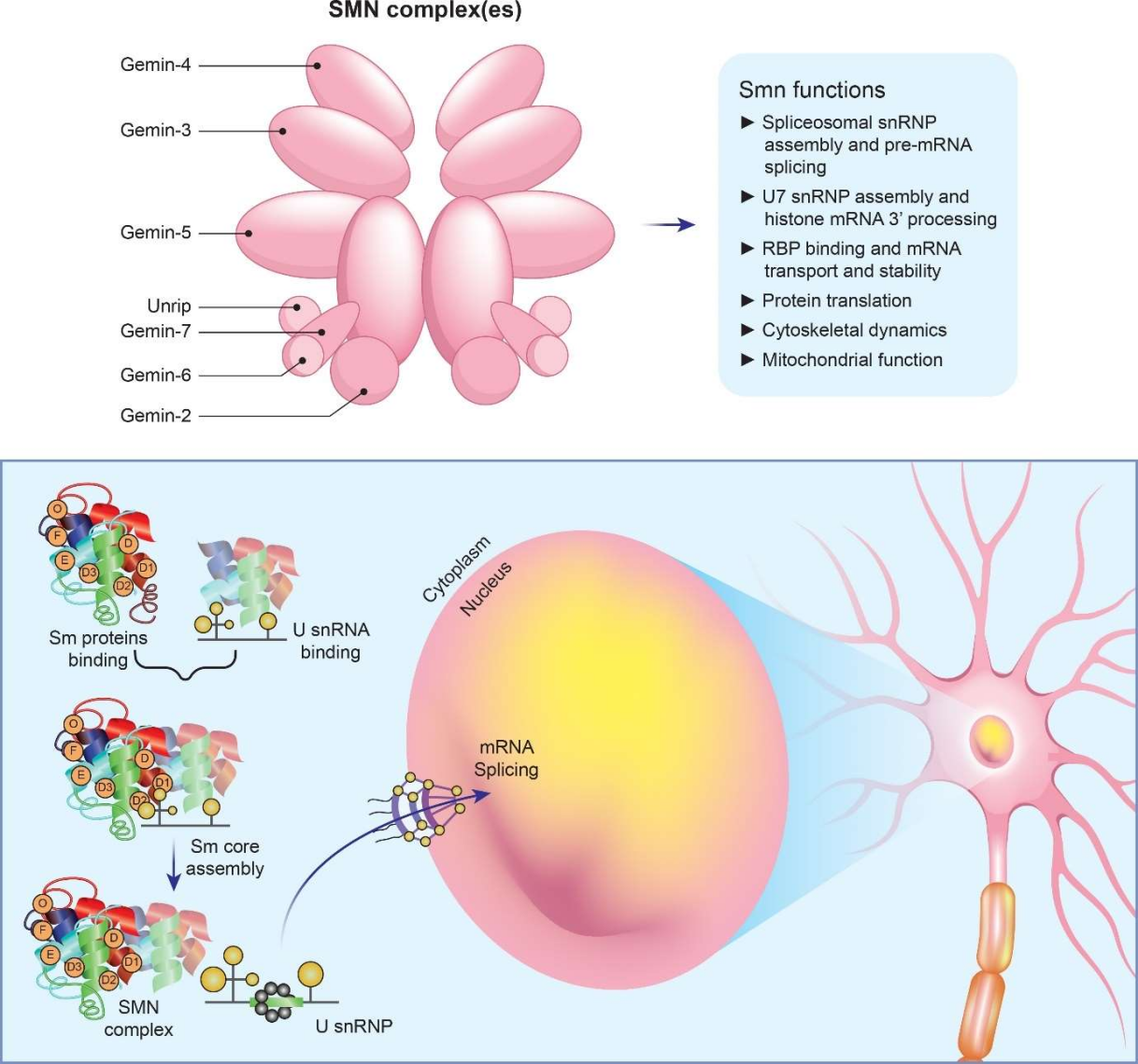
그림 2. SMN 단백질은 스플라이스좀 snRNP 조립에 핵심적인 역할을 하며, 그의 결핍이 mRNA 스플라이싱 및 발현에 영향을 미칩니다. [5]
질환 중증도의 “조절기”와 치료의 “핵심”: SMN2 유전자 copy 수량
인간 게놈에는 SMN1 외에도 상동성이 매우 높은 SMN2 유전자가 존재하며, 두 유전자는 몇 개의 뉴클레오타이드(nucleotide)만 다릅니다.[6] 그러나 SMN2 유전자는 exon 7의 splicing enhancer 부위에 c.840C>T point mutation을 가지고 있으며, 이는 splicing enhancer를 방해하거나 splicing silencer을 형성합니다.
그 결과, SMN2 전구체(precursor) mRNA의 스플라이싱을 통해 생성된 성숙 mRNA의 대부분은 exon 7이 결손되어 있으며, 이로 인해 생성된 단축된 SMN 단백질은 기능 상실을 보이고 빠르게 분해됩니다.[7] SMN2 전구체 중 약 10%만이 Full-length 기능성 SMN 단백질을 생성합니다.[8]
약 95%의 척수성 근위축증(SMA) 환자는 SMN1 이중 대립유전자성 결실(Biallelic deletion)을 가지고 있으며, 이로 인해 SMN2가 유일한 기능성 SMN 단백질의 공급원이 됩니다. 그러나 SMN2가 생성한 단백질의 양은 SMN1의 손실을 완전히 보상하기에 부족하여 결국 질환 발병이 발생합니다.[6, 8]
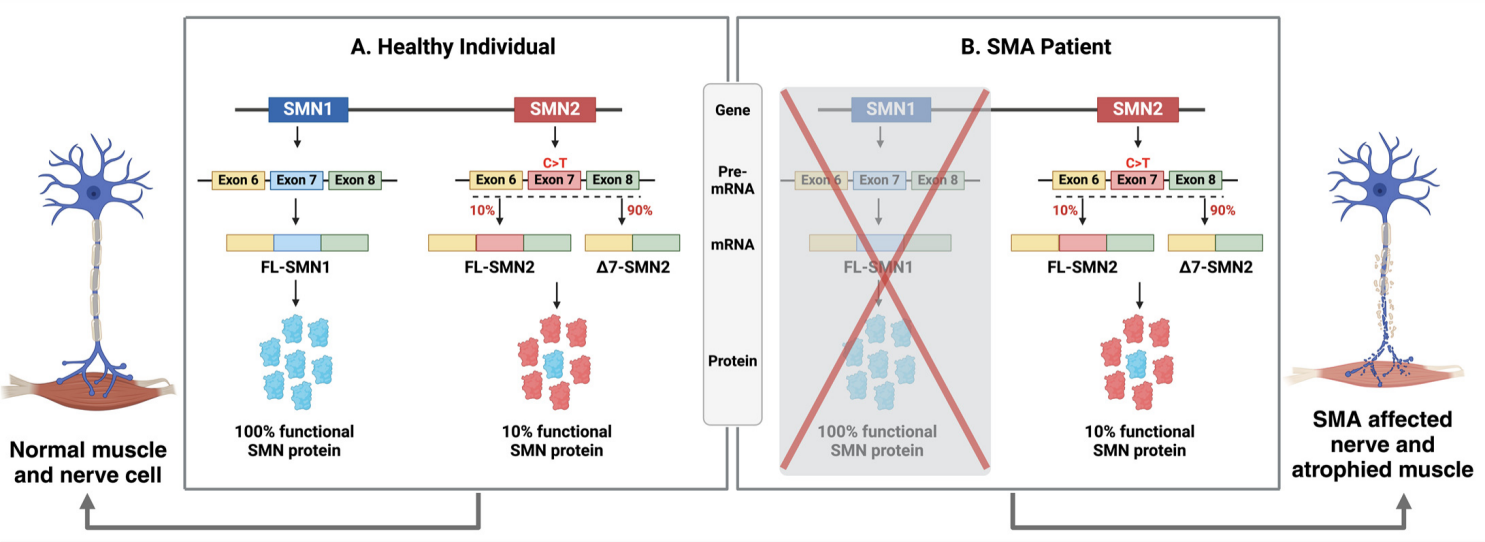
그림 3. Exon 7 Splicing Enhancer의 차이로 인해 SMN2가 SMN1보다 기능성 SMN 단백질을 현저히 적게 생성합니다. [9]
연구에 따르면 SMN2 유전자의 copy 수는 척수성 근위축증(SMA)의 중증도를 결정하는 핵심 “조절기”입니다. 일반적으로 환자 체내의 SMN2 copy 수는 1~6 copy 사이이며, copy 수가 많을수록 Full-length SMN 단백질이 많이 생성되고 임상 증상은 상대적으로 경미한 경향을 보입니다. [10, 11]
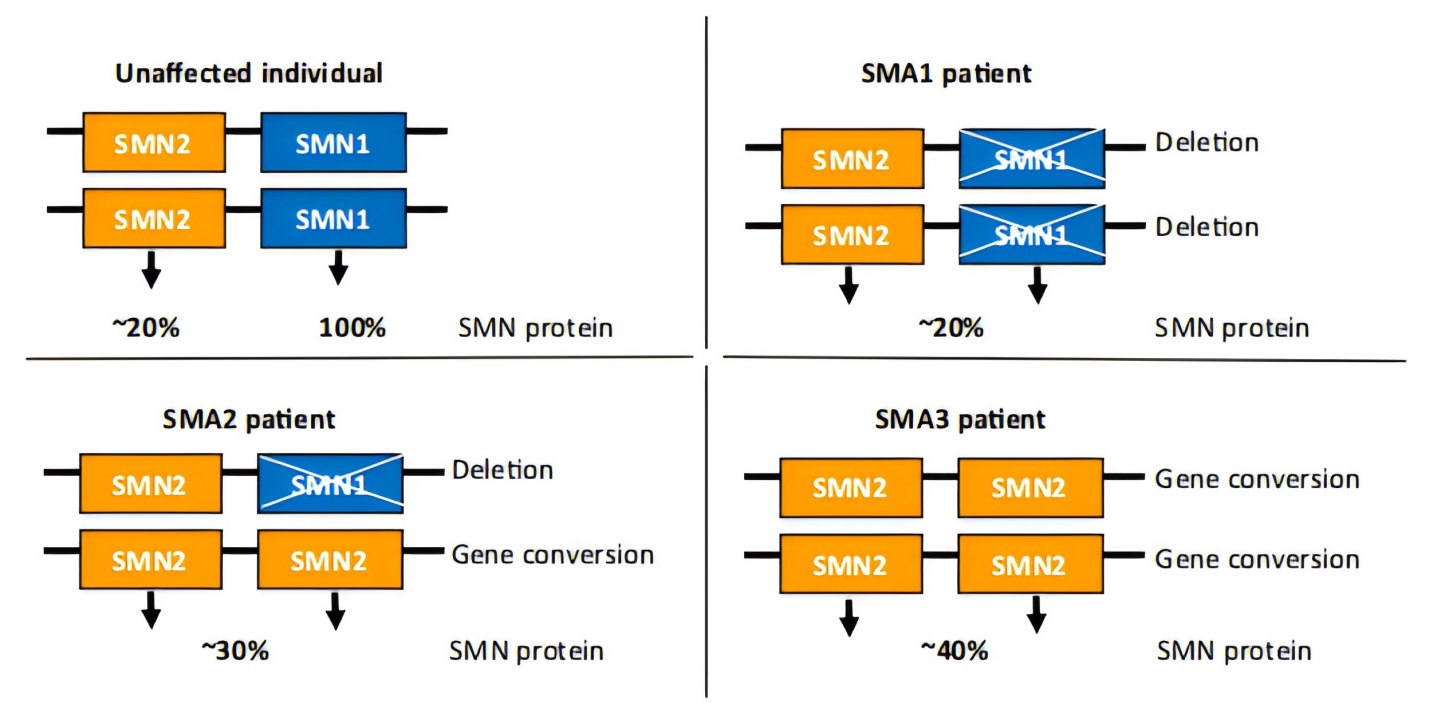
그림 4. SMN2 copy 수와 척수성 근위축증 중증도(SMA I형, II형, III형) 사이의 역 상관관계 [2]
SMN2의 잠재력을 바탕으로, 유전자의 스플라이싱 또는 발현을 조절하여 기능성 SMN 단백질 생성을 증가시키는 것이 척수성 근위축증(SMA) 치료에서 중요한 전략으로 떠올랐습니다. 현재 FDA 승인된 3종의 척수성 근위축증(SMA) 치료제 중 2종이 SMN2를 타겟으로 작용합니다: Biogen에서 개발한 안티센스 올리고뉴클레오타이드(ASO) 약물 Nusinersen과 Roche에서 개발한 경구용 스플라이싱 조절제 Risdiplam. 두 약물 모두 SMN2의 스플라이싱을 조절하여 기능성 단백질의 생성을 증가합니다. [12] 2024년, 상기 두 가지 약물의 매출은 각각 15.7억 달러와 17.8억 달러에 달하며, 이들이 지닌 임상적 가치 및 시장 잠재력을 잘 보여줍니다. [12]
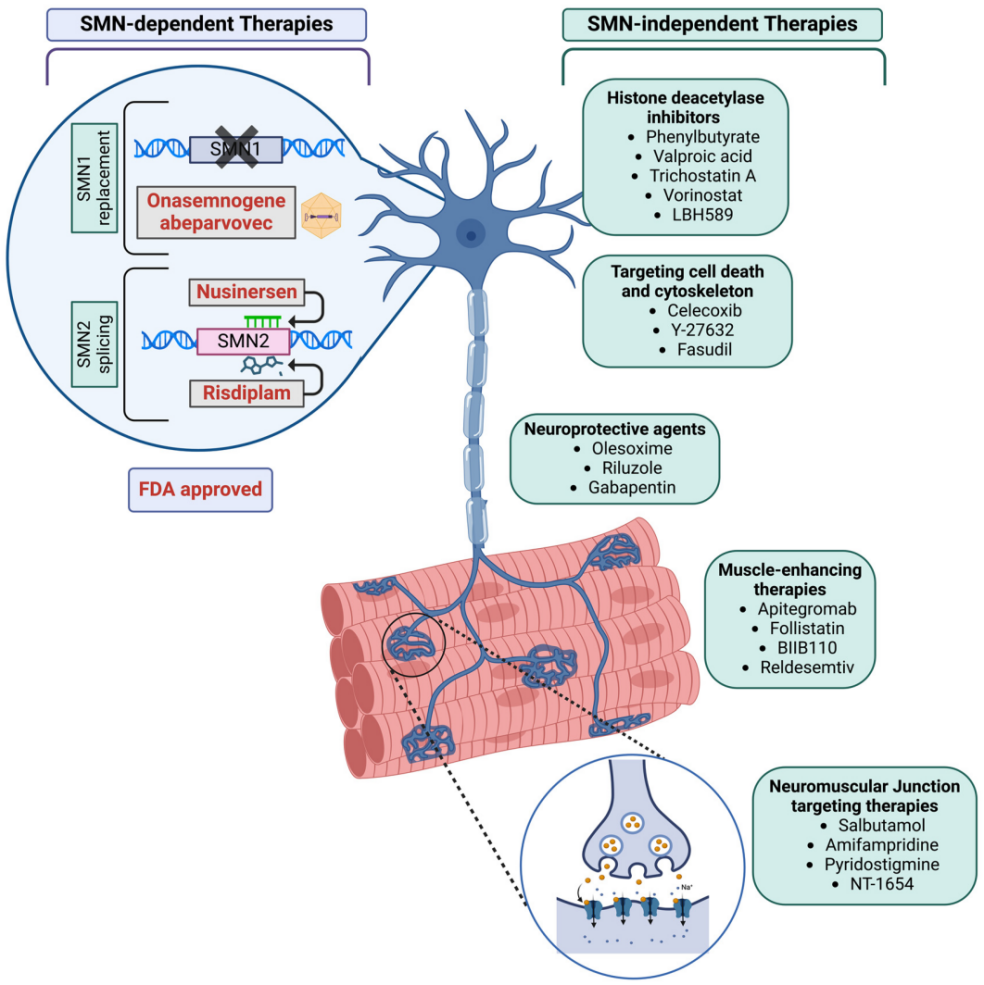
그림 5. SMN2 mRNA 스플라이싱 패턴을 타겟으로 조절하는 것은 SMN 의존성 치료법의 주요 방법입니다. [9]
Cyagen의 SMA 마우스 모델: 인간 질환을 재현하는 유용한 연구 모델
인간과 달리, 마우스는 단일 Smn1 유전자만 보유하고 있으며, 이 유전자의 완전 제거(Knockout)는 배아 치사(Embryonic lethality)를 유발하여, 척수성 근위축증(SMA)의 병리 기전과 SMN2의 보상 효과를 직접 모델링하기 어렵습니다.[13] 척수성 근위축증(SMA)의 병리 기전(특히 SMN2 copy 수의 영향)을 반영하고, 인간 질환의 진행 과정을 시뮬레이션하는 인간화 마우스 모델을 개발하는 것은 SMN2 타겟 치료제의 중요한 의미를 갖습니다.
Cyagen은 두 가지 전략을 활용하여 SMN2 인간화 기초 계통을 구축하였으며, 브리딩을 통해 서로 다른 SMN2 copy 수를 보유한 SMA 인간화 마우스 모델을 개발했습니다:
여러 세대의 교배를 통해, Smn1 Knockout 배경에 2, 3, 4개의 SMN2 copy를 가진 SMA 마우스 모델을 구축하였습니다:
|
Product Name |
Product Number |
Genotype |
Smn1 Gene |
SMN2 Copy Number |
Corresponding SMA Subtype |
|
B6-2*hSMN2 |
C001504 |
C57BL/6NCya-Smn1hSMN2/hSMN2 |
KO |
2 |
Type Ⅰ SMA |
|
B6-3*hSMN2 |
C001681 |
C57BL/6NCya-Smn1hSMN2/hSMN2ROSA26hSMN2/+ |
KO |
3 |
Type II SMA |
|
B6-4*hSMN2 |
C001682 |
C57BL/6NCya-Smn1hSMN2/hSMN2ROSA26hSMN2/hSMN2 |
KO |
4 |
Type Ⅲ SMA |
다음 소개하는 일부 검증 데이터는 해당 마우스 모델의 특성을 보여줍니다. 보다 상세한 정보는 각 마우스 품종의 데이터시트를 참조해 주세요.
B6-2hSMN2, B6-3hSMN2 및 B6-4*hSMN2 마우스에서 Full-length 인간 SMN2 전사체가 검출되었으며, 마우스 Smn1 유전자의 발현은 완전히 소실되었습니다. SMN2 copy 수가 증가함에 따라, Full-length SMN2 전사체의 발현 수준도 점진적으로 증가했습니다.
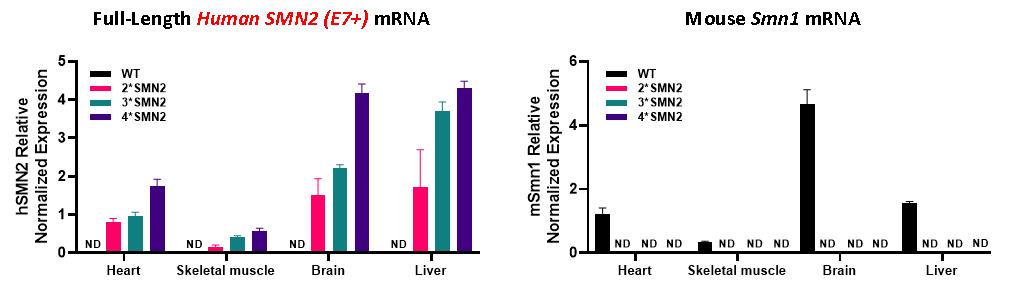
그림 6. Wild-Type(WT), B6-2hSMN2, B6-3hSMN2 및 B6-4*hSMN2 마우스의 다양한 조직에서의 유전자 발현 비교 결과
SMN 단백질 발현
SMN 단백질 수준은 Full-length SMN2 전사체 발현과 동일한 경향을 보였으며, SMN2 copy 수 증가에 따라 점진적으로 증가했습니다.
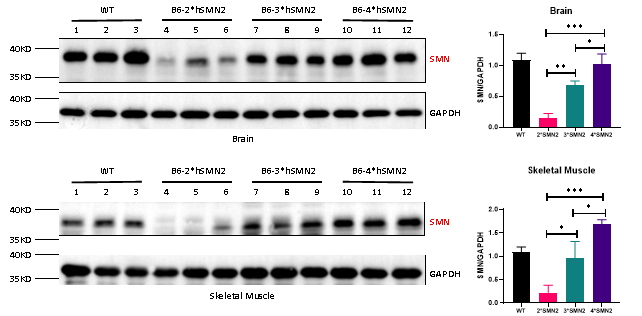
그림 7. Wild-Type(WT), B6-2*hSMN2, B6-3*hSMN2 및 B6-4*hSMN2 마우스에서의 인간 SMN 단백질 발현 결과
마우스 성장 곡선
아래의 성장 곡선(Growth Curve)은 SMN2 copy 수가 다른 SMA 모델 마우스들과 Wild-Type(WT) 대조군 마우스 간의 발달 차이를 보여줍니다.
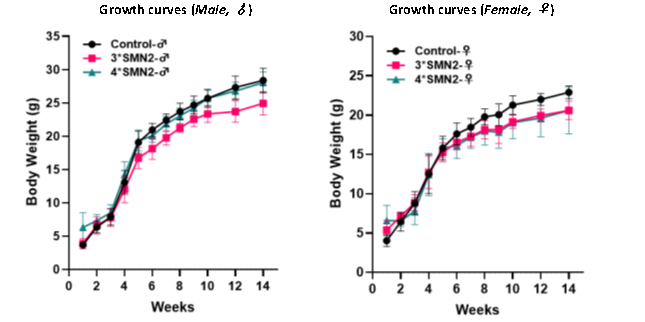
그림 8. Wild-Type 마우스 (Control), B6-3*hSMN2, B6-4*hSMN2 마우스 간의 성장 곡선 비교 결과
마우스 꼬리 길이
대부분의 B6-3*hSMN2 마우스는 생후 약 10주령 경에 꼬리를 완전히 잃습니다. B6-4*hSMN2 마우스도 꼬리 손실을 보이지만, 대략 8주령부터 꼬리 길이는 상대적으로 일정하게 유지됩니다.
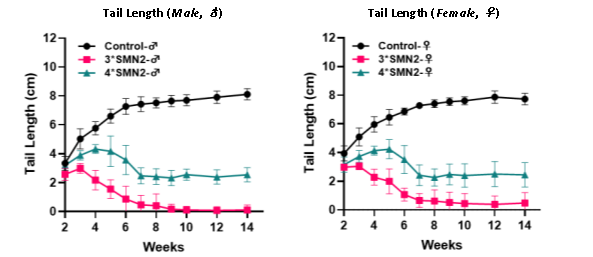
그림 9. Wild-Type 마우스 (Control), B6-3*hSMN2, B6-4*hSMN2 마우스 간의 꼬리 길이 비교 결과
일반적인 질환 증상의 발생
B6-3*hSMN2 마우스는 B6-4*hSMN2 마우스에 비해 더 심각한 질환 증상을 나타냅니다. 이는 SMN2 copy 수의 증가할수록 질환 진행이 완화될 수 있음을 시사합니다.
그림 10. Wild-Type 마우스 (Control), B6-3*hSMN2 및 B6-4*hSMN2 마우스 간의 질환 외부 증상 비교 결과
다양한 SMA 마우스 모델에서의 질환 표현형 진행 요약
B6-2*hSMN2(C001504), B6-3*hSMN2(C001681), B6-4*hSMN2(C001682) 마우스는 모두 마우스 Smn1 유전자 발현이 완전히 결여되어 있으며, 각각 2, 3, 4 copy의 인간 SMN2 유전자를 보유하고 있어 인간 척수성 근위축증(SMA) I형, II형, III형의 유전적 특징을 시뮬레이션합니다.
연구 데이터에 따르면, SMN2 전사체 및 기능성 SMN 단백질 발현, 성장 발달, 생존 기간 등의 지표에서 상기 마우스 모델은 각각 해당 SMN2 copy 수를 가진 인간 척수성 근위축증(SMA) 환자의 질환 진행과 유사한 경향을 보입니다. 이에 따라 이 인간화 마우스 모델은 척수성 근위축증(SMA) 병인, 특히 SMN2 copy 수에 따른 질환 진행 영향을 효과적으로 시뮬레이션하며, 척수성 근위축증(SMA)의 발병 기전 연구와 SMN2 기반 치료제 개발에 유용한 연구 모델로 활용될 수 있습니다.
Cyagen의 신경계 질환 CRO 서비스 플랫폼
Cyagen은 신경퇴행성 질환을 전문으로 하는 CRO 서비스 플랫폼을 구축하여, 신경질환 모델 구축, 행동 분석 및 약효 평가까지 연구자에게 종합적인 서비스를 제공합니다.
Cyagen에서 제공하는 다양한 신경계 질환 모델
Cyagen은 첨단 동물모델 개발 기술을 바탕으로, 2,000종 이상의 신경계 KO/cKO 마우스 모델 및 20종 이상의 유전자 편집 또는 약물 유도 신경질환 모델을 보유하고 있습니다. 주요 유전자 편집 방식은 다음과 같습니다:
Cyagen의 HUGO-GT™ 인간화 마우스 모델 플랫폼은 신경과학 연구를 위해 특별히 개발되었으며, 다양한 intervention 타겟을 포괄하고, 질환 기전 연구 및 타겟 치료제 개발을 위한 정밀한 마우스 모델을 제공합니다. 카탈로그 모델 외에도 연구자의 요구에 만족하는 맞춤형 유전자 마우스 제작 및 공동 연구 프로젝트도 지원하고 있어, 연구 진행 및 신약 개발을 효과적으로 뒷받침할 수 있습니다.
|
제품 번호 |
모델명 |
품종계통 |
응용 분야 |
|
C001427 |
C57BL/6NCya |
Parkinson's disease |
|
|
C001504 |
C57BL/6NCya |
Spinal muscular atrophy (SMA) |
|
|
C001518 |
C57BL/6JCya |
Duchenne muscular dystrophy (DMD) |
|
|
C001410 |
C57BL/6JCya |
Frontotemporal dementia, Alzheimer's disease, and other neurodegenerative diseases |
|
|
C001437 |
C57BL/6NCya |
Spinal muscular atrophy with respiratory distress type 1 and Charcot-Marie-Tooth disease type 2S |
|
|
C001418 |
C57BL/6JCya |
Amyotrophic lateral sclerosis, frontotemporal dementia, and other neurodegenerative diseases |
|
|
C001398 |
C57BL/6NCya |
Spinocerebellar ataxia type 3 |
|
|
C001568 |
C57BL/6NCya |
Rett syndrome |
|
|
C001569 |
C57BL/6NCya |
Rett syndrome |
|
|
I001124 |
C57BL/6NCya |
Progeria syndrome |
|
|
CG0015 |
- |
Parkinson's disease (PD) |
|
|
CG0016 |
C57BL/6JCya |
Depression |
|
|
C001210 |
C57BL/6JCya |
Research on Alzheimer's Disease (AD), Cerebral Amyloid Angiopathy (CAA) and Notch signaling pathway. |
|
|
C001541 |
C57BL/6JCya |
Research on Alzheimer's Disease (AD), Cerebral Amyloid Angiopathy (CAA), Notch signaling pathway and other neurodegenerative diseases. |
|
|
I001019 |
FVB/NJCya |
Development and screening of therapeutic drugs for Huntington's disease; Evaluation of therapeutic drug efficacy and safety for Huntington's disease; Research on the pathogenesis of Huntington's disease. |
|
|
- |
- |
Parkinson's disease (PD) |
|
|
- |
- |
- |
|
|
C001582 |
C57BL/6JCya |
Rett syndrome (RTT) |
|
|
C001611 |
C57BL/6NCya |
Angelman Syndrome (AS) |
참고 문헌:
[1]Mercuri E, Sumner CJ, Muntoni F, Darras BT, Finkel RS. Spinal muscular atrophy. Nat Rev Dis Primers. 2022 Aug 4;8(1):52.
[2]Wirth B. Spinal Muscular Atrophy: In the Challenge Lies a Solution. Trends Neurosci. 2021 Apr;44(4):306-322.
[3]Wirth B, Karakaya M, Kye MJ, Mendoza-Ferreira N. Twenty-Five Years of Spinal Muscular Atrophy Research: From Phenotype to Genotype to Therapy, and What Comes Next. Annu Rev Genomics Hum Genet. 2020 Aug 31;21:231-261.
[4]Nicolau S, Waldrop MA, Connolly AM, Mendell JR. Spinal Muscular Atrophy. Semin Pediatr Neurol. 2021 Apr;37:100878.
[5]Meneri M, Abati E, Gagliardi D, Faravelli I, Parente V, Ratti A, Verde F, Ticozzi N, Comi GP, Ottoboni L, Corti S. Identification of Novel Biomarkers of Spinal Muscular Atrophy and Therapeutic Response by Proteomic and Metabolomic Profiling of Human Biological Fluid Samples. Biomedicines. 2023 Apr 23;11(5):1254.
[6]Kolb SJ, Kissel JT. Spinal Muscular Atrophy. Neurol Clin. 2015 Nov;33(4):831-46.
[7]Day JW, Howell K, Place A, Long K, Rossello J, Kertesz N, Nomikos G. Advances and limitations for the treatment of spinal muscular atrophy. BMC Pediatr. 2022 Nov 3;22(1):632.
[8]Butchbach MER. Genomic Variability in the Survival Motor Neuron Genes (SMN1 and SMN2): Implications for Spinal Muscular Atrophy Phenotype and Therapeutics Development. Int J Mol Sci. 2021 Jul 23;22(15):7896.
[9]Haque US, Yokota T. Recent Progress in Gene-Targeting Therapies for Spinal Muscular Atrophy: Promises and Challenges. Genes (Basel). 2024 Jul 30;15(8):999.
[10]Cuscó I, Bernal S, Blasco-Pérez L, Calucho M, Alias L, Fuentes-Prior P, Tizzano EF. Practical guidelines to manage discordant situations of SMN2 copy number in patients with spinal muscular atrophy. Neurol Genet. 2020 Nov 18;6(6):e530.
[11]Calucho M, Bernal S, Alías L, March F, Venceslá A, Rodríguez-Álvarez FJ, Aller E, Fernández RM, Borrego S, Millán JM, Hernández-Chico C, Cuscó I, Fuentes-Prior P, Tizzano EF. Correlation between SMA type and SMN2 copy number revisited: An analysis of 625 unrelated Spanish patients and a compilation of 2834 reported cases. Neuromuscul Disord. 2018 Mar;28(3):208-215.
[12]FiercePharma. (2025, February 12). Roche nabs FDA nod: Evrysdi tablets gaining potential convenience edge over SMA meds Biogen. Retrieved March 20, 2025, from https://www.fiercepharma.com/pharma/roche-nabs-fda-nod-evrysdi-tablets-gaining-potential-convenience-edge-over-sma-meds-biogen
[13]Edens BM, Ajroud-Driss S, Ma L, Ma YC. Molecular mechanisms and animal models of spinal muscular atrophy. Biochim Biophys Acta. 2015 Apr;1852(4):685-92.




영업일 기준 1-2일 내에 답변해 드리겠습니다.