

색소성 망막염 GTP 효소조절인자(RPGR) 유전자의 돌연변이는 X연쇄 색소성 망막염(XLRP)과 연관돼 전체 색소성 망막염(RP)의 10~20%를 차지하는 가장 심각한 형태 중 하나다. 저자는 RPGR 돌연변이 마우스 모델을 구축해 표현형 분석을 통해 모델의 대표성을 확인한 뒤 rAAV를 이용해 CRISPR/Cas 복구시스템을 병변모델 쥐에 전달해 치료 효과가 좋은 것으로 나타났다. 이 연구는 RPGR 유전자 돌연변이에 의한 XLRP에 대한 유전자 치료 방식을 밝혀내 이 같은 환자들에게 치유 희망을 주고 있다.
연구의 사고방식
❖RPGR-KO 마우스 모델을 구축하여 시각세포(photoreceptor cells)의 퇴화와 광감지 단백질(Light-sensing protein)의 발현 이상을 발견하였다.
❖CRISPR/Cas이 매개하는 유전자 편집 치료 방안을 채택하여 시각세포(photoreceptor cells) 퇴화 등의 증상을 효과적으로 치료할 수 있다.
RPGR-KO 마우스 모델 구축
저자는 두 개의 표적 RPGR 유전자 엑손8의 sgRNA를 설계했다(그림1A). 그리고 체외전사된 Cas의 mRNA와 sgRNA를 C57BL/6J 마우스의 수정란에 주사하여 RPGR-KO 마우스 모델을 구축하였다. 그리고 Sanger 시퀀싱 분석을 통해 모델 구축이 성공했음을 확인한다(그림 1B).
저자는 엑손8(그림1C)에서 5bp 결실한 마우스를 선택해 다음 연구를 진행했다.(c.974_978delAAATT;p.K325Nfs*1). WT 마우스에서 RPGR 발현과 위치를 분석하면 막대기 모양의 면역반응성을 나타내며 섬모가 연결된 부분에 더 밝은 작은 반점이 있다. RPGR-KO 망막에서는 RPGR 염색이 검출되지 않았다(그림 1D).이로 인해 5-bp 결실은 RPGR 불활성화를 초래한다.
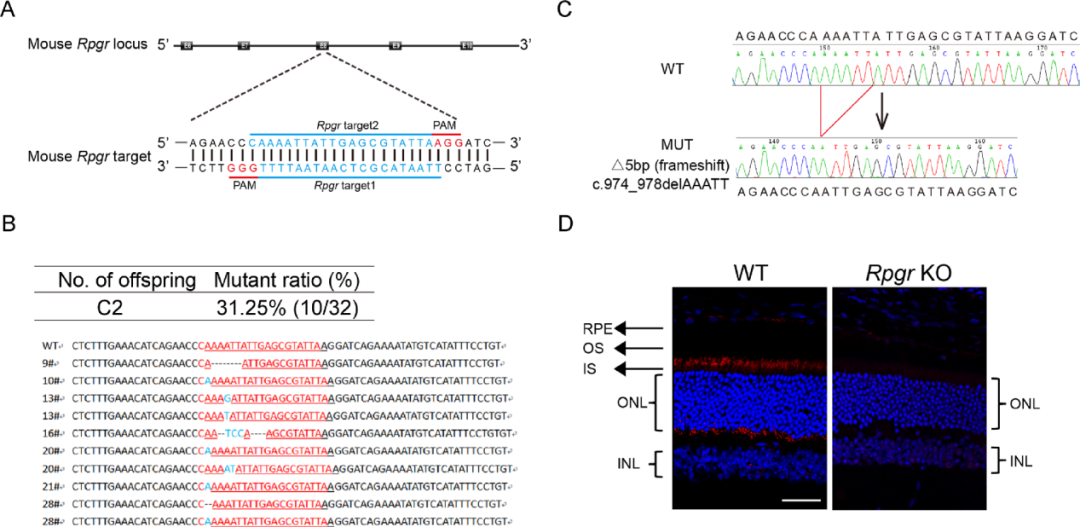
그림 1 RPGR-KO 마우스 모델 구축 및 감정
RPGR-KO 마우스 모델의 병변표현형
저자는 이어 5bp 결손 마우스 모델에 대해 상세한 표현형 분석을 진행했다. WT와 RPGR-KO 마우스에 망막안저 이미징(그림2A)을 실시하여RPGR-KO 마우스는 생후 3개월 때 망막 안저 모든 사분면(Quadrant)에 고르게 분포된 작은 황백색 반점이 여러 개 나타나는 것을 발견했다. 또 감광기가 퇴화하면서 이 점들이 더 커지고 합쳐진다.생후 12개월이 되면 이 얼룩들은 듬성듬성해지지만 색소 침착이 뚜렷해진다.
조직학적으로 WT 와 RPGR-KO 쥐의 망막 슬라이스를 평가한 결과, 6 개월이 되었을 때, 외핵층 (outer nuclear layer, ONL) 의 감광 세포는 경미한 노화 관련 손실이 있었다. 생후 12개월이 되면 RPGR-KO 생쥐의 감광세포(Photoreceptor cells) 손실이 뚜렷해진다(그림 2B).
저자는 ONL 두께를 측정해 WT와 돌연변이 생쥐 간 ONL 두께에 큰 차이가 있음을 발견했다(그림 2C). 형태학적 변성과 함께 망막전기전도(Electronogram, ERG) 측정의 망막 기능에도 이상이 나타났다.
ERG를 통해 3개월간 RPGR-KO 생쥐에서 암적응한 ERG는 WT 생쥐와 큰 차이가 없었지만 b파 진폭이 감소했음을 확인했다(그림 2D). 6개월 때는 ERG 폭(a파와 b파 폭 포함)이 더 낮아져 12개월이면 기록 가능한 ERGa파와 b파 반응이 거의 없다(그림 2E).
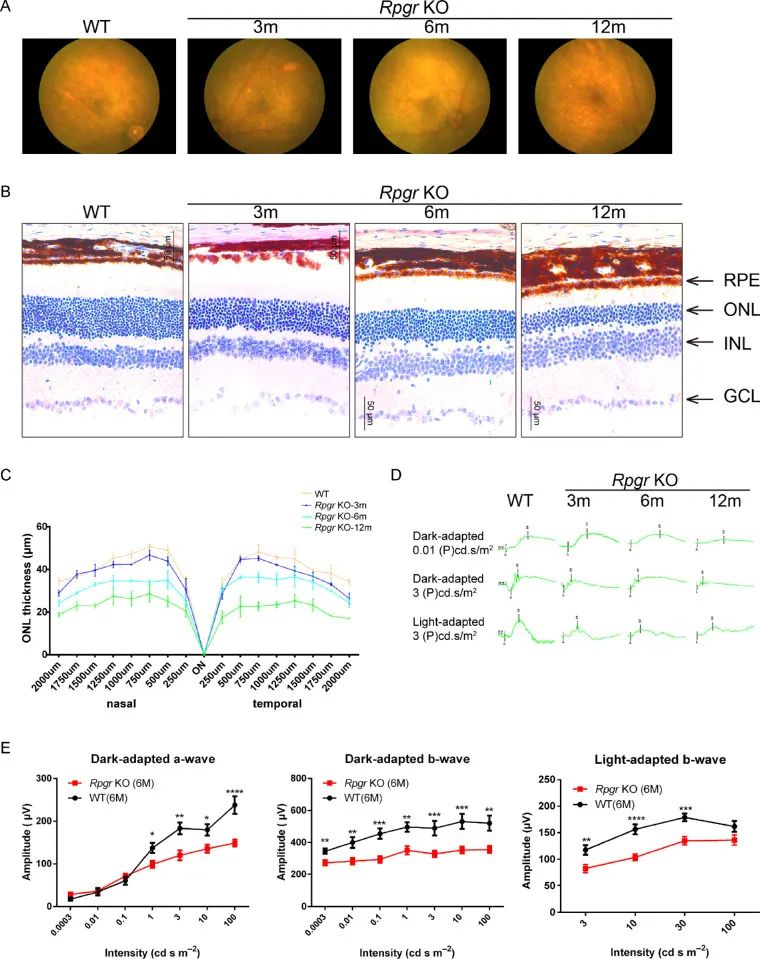
그림 2. RPGR-KO 마우스 망막의 형태 변화
생후 6개월 된 RPGR-KO 마우스에서는 로돕신(rhodopsin), M-옵신, S-옵신 발현이 현저히 감소하였고, 드문드문 PNA염색만 관찰되었으며, 이는 외단 완전성과 단백질의 안정성 저하와 일치하였다. 생후 12개월 된 RPGR-KO 마우스에서는 PNA와 S-옵신 염색이 더 감소했고 간혹 로돕신(rhodopsin)과 M-옵신 발현만 관찰됐다(그림 3).
RPGR-KO 생쥐는 망막 형태와 기능이 느리지만 점진적인 연령 상관성 망막변성을 보였다. 현저한 퇴행성 변화는 6개월에서 시작되는데, 이는 이 모델이 인간에게 발생하는 진행성 망막 퇴행성 병변을 시뮬레이션할 수 있음을 시사한다. 따라서 이 RPGR-KO 마우스 모델은 유전자 편집 치료 연구에 탁월한 동물 모델 시스템을 제공한다.
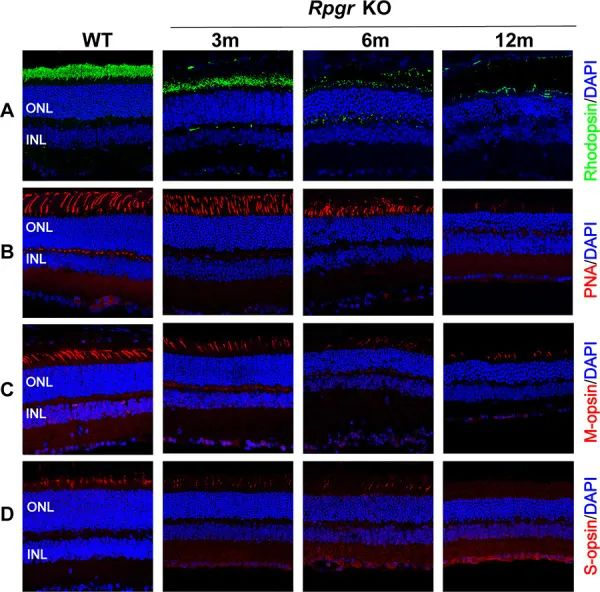
그림 3. RPGR-KO 생쥐의 감광세포(Photoreceptor cells) 퇴화
AAV-CRISPR/Cas를 통해 RPGR 돌연변이로 인한 망막 퇴행성 질환을 효과적으로 치료
두 개의 개별 AAV2/8 벡터를 통해 표적 돌연변이 RPGR 유전자좌의 sgRNA 발현 박스와 복구 공여체 템플릿을 6개월 된 RPGR-/yCas+/WT 마우스에 전달하였다(그림 4A-D).
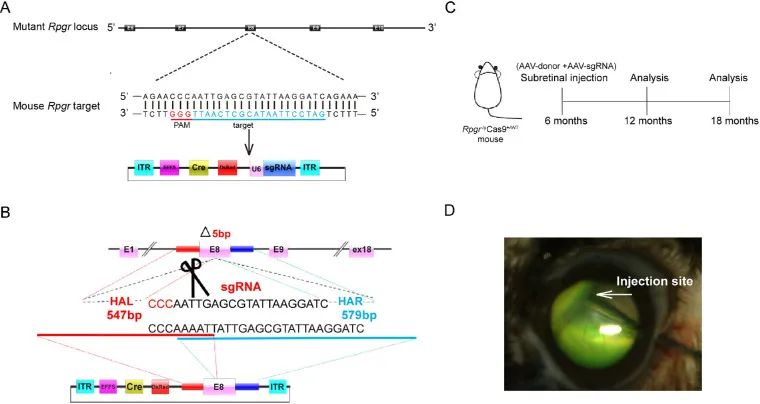
그림 4. 치료 전략
치료 후 6개월 후, 같은 눈의 망막 미치료 영역에 비해 치료 영역에서 망막감광세포를 관찰하는 층수가 눈에 띄게 증가하였다. (미치료 영역 감광세포 층수: 4층으로 느슨하게 배열되어 있고, 치료 영역 감광세포 층수: 9층) (그림 5A, 5B). 치료 구역의 ONL은 미치료 구역보다 현저히 두껍다.치료 영역 중 감광세포의 밀도는 100㎛/316개로 치료되지 않은 영역(128개/100㎛;그림 5C)보다 1.5배 높았다. 면역형광 분석을 통해 RPGR, PNA, M-옵신의 발현이 회복됨을 확인하였다(그림 5D).
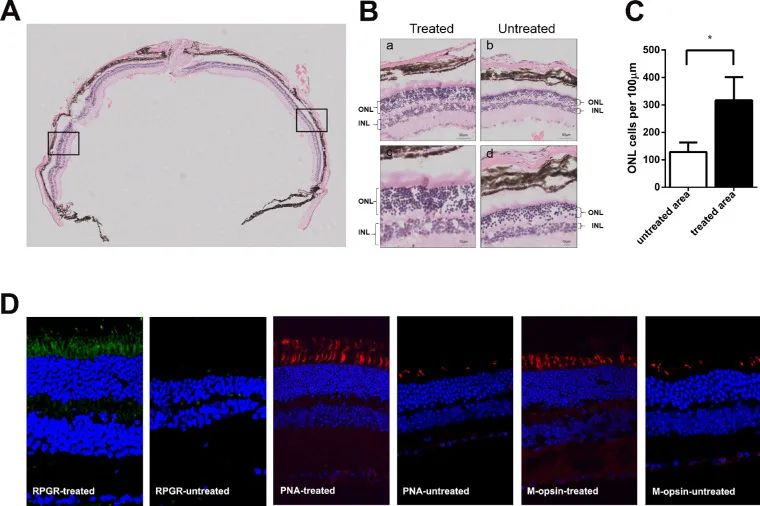
그림 5. 치료 6개월 만에 병변 생쥐 망막구조 회복
치료 후 12개월 만에 망막 형태를 평가했는데 RPGR과 PNA 염색이 단면적(cross-section)의 약 4분의 3을 넘었다(그림 6A, 6B). 치료 영역의 감광 세포의 밀도는 261개의 핵/100㎛로 치료되지 않은 영역(87개의 핵/100㎛;그림 6C)의 3배이다. 이 수치들은 CRISPR/Cas이 매개하는 RPGR 유전자 편집 요법이 광수용기 퇴화를 방지하고 오랜 기간 지속된다는 것을 보여준다.
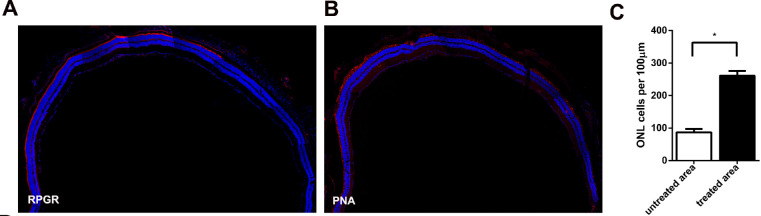
그림 6. 12개월 후 병변 생쥐의 망막구조가 보다 효과적인 치료효과를 얻었다
결론
이 문헌연구는 사고의 방향이 뚜렷하여, 우선 대표적인 진행성 망막 퇴행성 병변 마우스 모델을 구축한 후 AAV를 이용하여 CRISPR/Cas 복구 시스템을 안부에 전달하여 효과적인 치료를 시행하였다. 안과 질환 치료 표적의 발견에는 효과적인 질병 모델이 필요하다는 것을 알 수 있다. 오늘날 일반적으로 쥐를 질병 모델을 구축하는 대상으로 사용하는 것은 비용이 낮고 시스템 성숙과 같은 요인에 의해 결정된다. 치료방식 개발은 일반적으로 AAV 전달 유전자 단편으로 치료한다. 현재 유효 유전자 단편을 보충하는 전략이 자주 사용되고 있지만, 유전자 SNP 돌연변이 등에 대한 CRISPR/Cas 복구 전략도 계속 연구 개발되고 있다.
Cyagen 안과 유전자 치료 솔루션
Cyagen는 안과 유전자 치료가 장기적으로 직면한 다방면의 곤경을 해결하기 위해 안과 유전자 치료 플랫폼을 적극적으로 배치하고, 고급 미세화 소동물 안과 계측 설비와 베테랑 전문 인력을 배치한다. 동물 안과 유전자 편집 모델, 눈 주사 약, 취재, 검사 분석 등 일련의 임상 전 표준화 연구 서비스를 제공하여 안과 유전자 치료 연구의 여러 가지 문제점을 해결해 드립니다.
더 많은 유전자 치료법이 임상시험에 들어가 선천적으로 실명된 사람들이 하루빨리 빛을 볼 수 있도록 도와주기 바란다. 문의 사항이 있으시면 86 20-31601779 로 전화하거나 이메일 service-apac@cyagen.com 을 통해 문의해 주십시오.
Cyagen 유전자 치료 원스톱 솔루션
Cyagen 유전자치료 원스톱 솔루션은 유전자 치료에 종사하는 연구자에게 보다 효율적인 유전자 기능 해석과 유전자 치료 원스톱 전체 솔루션을 제공할 수 있으며, 표적점 선별과 기능 연구, 동물 모델 구축과 AAV, LV, ADV 등의 바이러스 벡터 설계와 포장, 그리고 표현형 분석 등의 전 프로세스 서비스를 포함한다.
참고 문헌:
Hu S, Du J, Chen N, et al. In Vivo CRISPR/Cas-Mediated Genome Editing Mitigates Photoreceptor Degeneration in a Mouse Model of X-Linked Retinitis Pigmentosa. Invest Ophthalmol Vis Sci. 2020;61(4):31.




영업일 기준 1-2일 내에 답변해 드리겠습니다.