

Cyagen 바이오는 여러분이 다양한 마우스 모델을 이해하는 데 도움 되도록 매주 금요일에 업데이트 하는 "이번 주 마우스"칼럼을 통해 마우스 모델 관련 콘텐츠를 설명해 드리고자 합니다.
오늘 여러분을 위해 Igf1r 유전자 녹아웃 마우스를 소개해 드리겠습니다.
Igf1r유전자
인슐린 유사 성장 인자 1 수용체는 높은 친화력으로 인슐린 유사 성장 인자와 결합합니다. 티로신 키나아제 활성을 나타냅니다. 인슐린 유사 성장 인자 1 수용체는 전환 이벤트에서 핵심 역할을 합니다. 유전자 암호화 단백질 전구체의 용해를 통해 알파 및 베타 서브유닛을 생성합니다. 대부분의 악성 조직에서 과발현되며 세포 생존율을 향상시켜 항-세포사멸 역할을 합니다. 2개의 알파 서브유닛과 2개의 베타 서브유닛을 통해 IGF-1 수용체를 구성하며, 알파 체인은 세포 외부에 위치하고, 베타 서브유닛은 세포막을 통과하여 형성되며 리간드 자극이 발생하면 세포 내 신호 전달을 담당합니다.
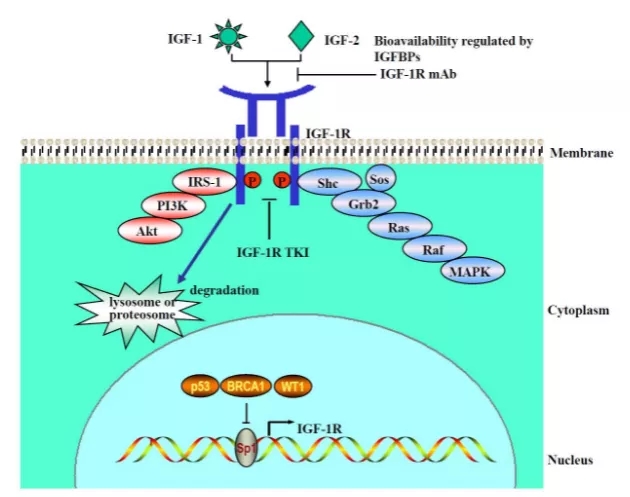
그림 1. IGF-1R 활성화 및 조절: IGF 리간드, IGF-1 또는 IGF-2를 통한 IGF-1R 및 다운스트림 신호의 활성화[1]
Igf1r 녹아웃 마우스 모델
1 KO 마우스(전신성 유전자 녹아웃 마우스)
Liu et al은 상동 재조합을 통해 Igf1r 유전자 녹아웃 마우스 모델을 구축했습니다. 동형접합 KO 마우스는 출생 시 호흡부전으로 사망했고 심각한 성장 결함(정상 크기의 약 45%)을 나타냈습니다. Igf1r-/- 배아(근육 포함) 전신 기관 형성부전 및 골화 발육 지연 외에도 중추 신경계 및 표피가 정상 상태에 비해 편차가 존재하는 것으로 관찰되었습니다. [2]
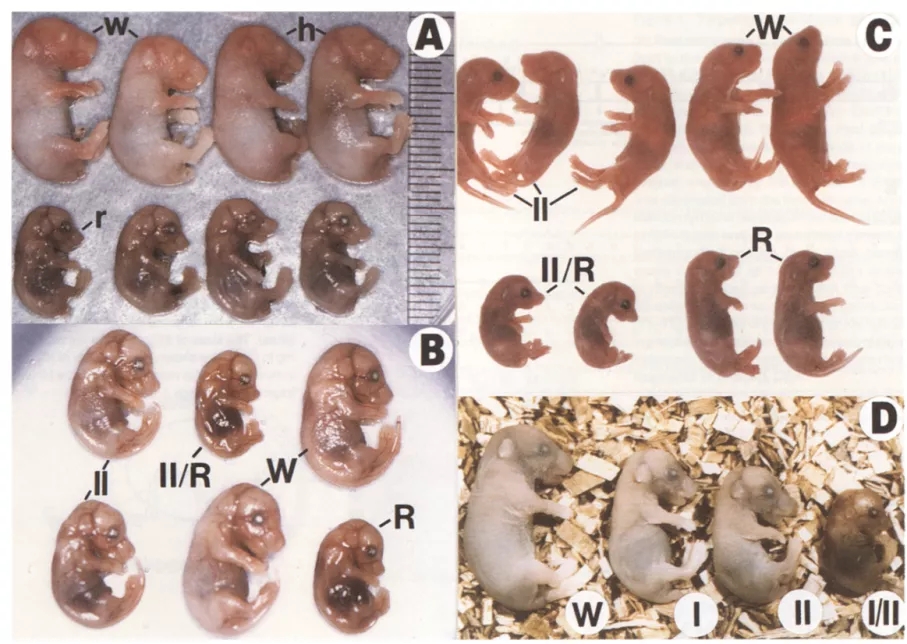
그림 2. Igf1r KO 마우스의 표현형: (A) 야생형(w), 이형 접합체(h) 및 동형 접합체(r). 동형 접합체는 크기, 피부 외관적인 상이성을 나타냅니다. [2]
Holzenberger et al은 이형접합 녹아웃 마우스를 사용하여 수명 관련 연구를 통해 Igf1r+/- 마우스의 평균 수명은 야생형 마우스의 평균 수명보다 26% 길었고, 암컷 Igf1r+/- 마우스의 수명은 야생형 마우스보다 33% 길었고, 수컷 Igf1+/- 마우스의 수명은 야생형 수컷에 비해 16% 증가한 것으로 나타났습니다. 수명이 긴 Igf1r+/- 마우스는 왜소증이 발생하지 않았고, 에너지 대사가 정상이었으며, 영양 섭취, 신체 활동, 생육력 및 번식력에 영향이 미치지 않은 것으로 나타났습니다. Igf1r+/- 마우스는 산화 스트레스에 대해 보다 강한 저항성을 나타냈습니다(산화 스트레스는 노화의 결정 요인으로 알려지고 있음). 이러한 결과를 통해 IGF1R 유전자는 포유동물 수명의 중심 조절인자일 수 있음을 알 수 있습니다. [3]
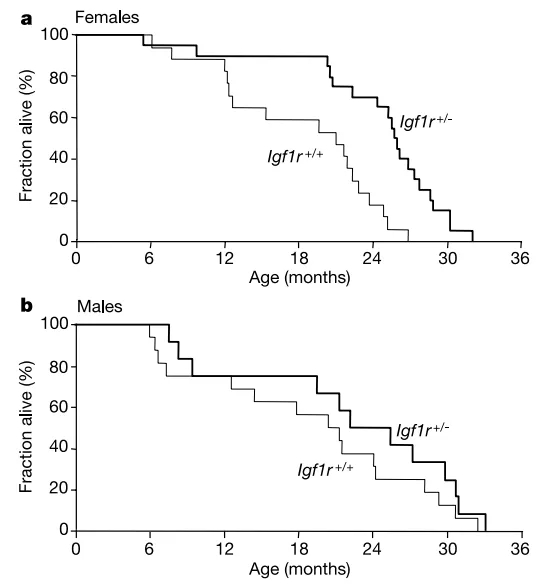
그림 3. WT 마우스보다 수명이 연장된 Igf1r 이형 접합 마우스. [3]
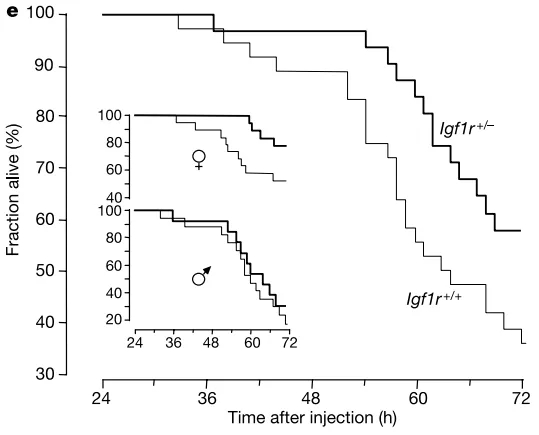
그림 4. WT보다 산화 스트레스에 더 큰 내성을 나타낸 Igf1r 이형 접합 마우스: 파라콰트의 복강내 주사를 통해 산화 스트레스 유발 가능. 암컷 돌연변이체는 높은 스트레스 저항성을 보인 반면, 수컷 돌연변이체는 아주 작은 증폭을 나타냈습니다. [3]
2 CKO 마우스(조건부 녹아웃 마우스)
Kulkarni et al은 Igf1rflox/flox를 Ins2-Cre(베타 세포 특이성 툴 마우스)와 교배하여 베타 세포에서 Igf1r 유전자를 특이적으로 녹아웃 한 마우스 모델 생성하며, 동형접합 마우스는 정상 출생했고, 성숙 후 활착상황도 WT와 같은 것으로 나타났습니다 : 이와 같은 베타-세포의 특이적 동형접합 녹아웃 마우스는 베타 세포의 정상적인 성장과 발육을 보였으나 베타 세포 상의 Slc2a2(Glut2라고도 함)와 Gck(글루코키나제를 암호화 함)의 발현이 감소되어 포도당 자극에 따른 인슐린 분비 결함 및 내당능 장애를 유발했습니다. 따라서, Igf1r은 비록 췌장 베타 세포의 발달에 중요하지 않지만 분화기능의 조절에 관여합니다.
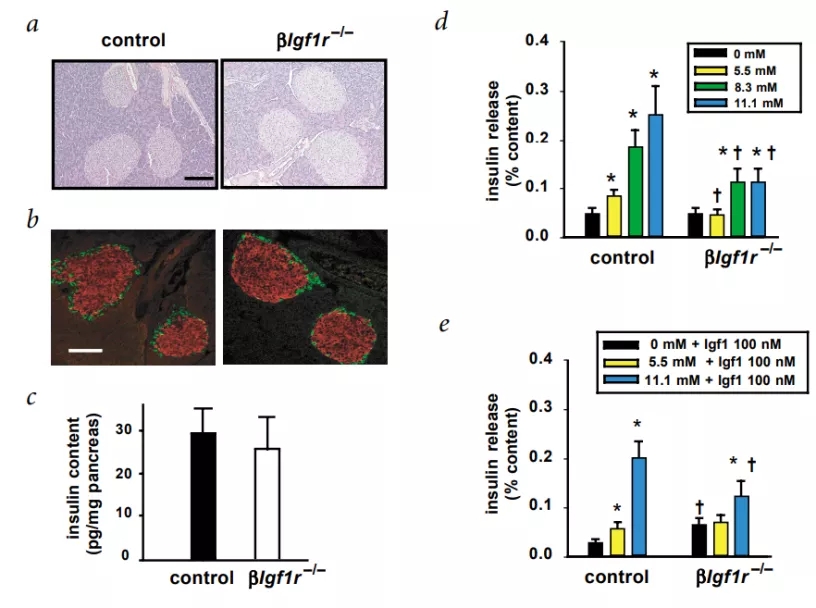
그림 5. 베타세포 특이적 Igf1r 동형접합 녹아웃 마우스는 정상적인 췌도 형태와 인슐린 함량을 보였으나, 포도당 자극에 따른 인슐린 분비 감소 및 Igf1 매질이 인슐린 분비에 대한 억제력도 상실. βIgf1r-/- 및 대조군 마우스로부터 분리된 췌도를 밤새 배양한 후 포도당 자극에 사용하였습니다. 대조군 췌도는 인슐린 분비의 농도 의존적 자극을 보여주었습니다. 인슐린 분비는 11.1mM의 포도당 농도에서 약 3배 증가한 것으로 나타났습니다. βIgf1r-/- 췌도에서: 5.5mM의 포도당 농도에서는 자극이 감지되지 않았고 더 높은 포도당 농도에서는 소량의 증가를 나타냈습니다.100nM Igf1 여건에서 배양된 췌도에 대하여 다음과 같은 유사한 실험을 수행했습니다. 기초 상태(5.5mM)와 포도당이 없는 상태에서 βIgf1r-/-췌도는 대조군보다 더 많은 인슐린을 분비하여 βIgf1r-/-췌도에서 Igf1의 정상적인 억제 역할의 감소를 나타냈습니다. 기초 분비는 높게 나타났지만 포도당 자극이 유발된 후, βIgf1r-/-췌도의 인슐린 분비는 대조군보다 현저히 낮은 것으로 나타나, 이를 통해 포도당 자극 결함이 생체 내에서 관찰되는 결함과 유사함을 알 수 있습니다. [4]
요약
인슐린 유사 성장 인자 1형 수용체(IGF1R)는 암의 발달과 유지에서 중요한 역할을 합니다. 30여년 전에 성장인자 수용체와 종양유전자 사이의 첫 번째 연결이 발견되면서, IGF-1R을 향한 표적은 업계의 큰 관심을 모았습니다. 중요한 암 촉진 단백질로서의 IGFIR이 확인되면서, IGFIR 단클론항체 및 소분자 억제제를 포함하는 다수 IGFIR 표적 약물에 대한 개발을 추진하였습니다. 단, 현재 보도된 바에 따르면 획득성 약물 내성과 독성 부작용을 포함하는 일부 단점이 존재합니다. 항-IGFIR 약물에 대한 내재적 또는 적응적 내성은 번거로운 장애가 이유로, 임상 시험을 통해 교훈을 섭취하고, 전략을 조절하여 복잡한 IGF/IGF-IR 신호에 대응해야 합니다. [5]
참고문헌
(1) Yin M, Guan X, Liao Z, Wei Q. Insulin-like growth factor-1 receptor-targeted therapy for non-small cell lung cancer: a mini review. Am J Transl Res. 2009 Jan 30;1(2):101-14. PMID: 19956424; PMCID: PMC2776317.
(2) Liu JP, Baker J, Perkins AS, Robertson EJ, Efstratiadis A. Mice carrying null mutations of the genes encoding insulin-like growth factor I (Igf-1) and type 1 IGF receptor (Igf1r). Cell. 1993 Oct 8;75(1):59-72. PMID: 8402901.
(3) Holzenberger M, Dupont J, Ducos B, Leneuve P, Géloën A, Even PC, Cervera P, Le Bouc Y. IGF-1 receptor regulates lifespan and resistance to oxidative stress in mice. Nature. 2003 Jan 9;421(6919):182-7. doi: 10.1038/nature01298. Epub 2002 Dec 4. PMID: 12483226.
(4) Kulkarni RN, Holzenberger M, Shih DQ, Ozcan U, Stoffel M, Magnuson MA, Kahn CR. beta-cell-specific deletion of the Igf1 receptor leads to hyperinsulinemia and glucose intolerance but does not alter beta-cell mass. Nat Genet. 2002 May;31(1):111-5. doi: 10.1038/ng872. Epub 2002 Apr 1. PMID: 11923875.
(5) Hua H, Kong Q, Yin J, Zhang J, Jiang Y. Insulin-like growth factor receptor signaling in tumorigenesis and drug resistance: a challenge for cancer therapy. J Hematol Oncol. 2020 Jun 3;13(1):64. doi: 10.1186/s13045-020-00904-3. PMID: 32493414; PMCID: PMC7268628.
Cyagen 개요
Cyagen 바이오는 15년의 성장과정을 경력하면서 글로벌 수만 명의 과학자들을 위해 서비스를 제공했으며, 관련 제품과 기술은 CNS(Cell, Nature, and Science) 3대 저널을 포함한 5,200여 편의 학술논문에 직접 활용되었습니다. Cyagen 바이오는 유전자 녹아웃,유전자 녹인 및 조건부 유전자 녹아웃 모델 맞춤형 서비스를 제공하는 외에도 수술 질환 모델전문팀을 보유하고 있어, 복잡한 정밀 소동물 수술 질환 모델을 다양하게 제공할 수 있으며; 약물 선별 및 평가용 마우스 플랫폼을 통해, 유럽과 미국의 업계 주도 업체로부터 도입한 면역결핍 마우스,심혈관 및 알츠하이머 등 질병의 연구에 필요한 인간화 마우스를 제공할 수 있으며; 국제 표준화 무균 마우스기술 플랫폼을 통해 무균 마우스 및 무균 동물 맞춤형 서비스, 미생물균군 이식 서비스 등과 같은 무균 동물모델에 기반한 다양한 제품 및 서비스를 제공할 수 있습니다. Cyagen 바이오는 성숙되고 안정적인 유전자 편집 마우스 플랫폼과 결합하여 균군과 유전자간의 상호 작용 메커니즘 연구를 지원해 드립니다.




영업일 기준 1-2일 내에 답변해 드리겠습니다.