

연구 방향을 조정하여 학술 연구에서 돌파구를 찾고 싶습니까? 논문 주제 선정에 대한 아이디어를 얻고 적중률을 높이고 싶습니까? 당신은 학문 분야의 발전 경향과 앞으로의 방향성을 이해 할 필요가 있습니다! Cyagen 칼럼 <Gene of the Week>는 매주 인기 연구 분야에 따라 유전자 하나를 소개해 드리며, 유전자 기본 정보, 연구 개황과 응용 배경 등을 자세히 소개하며 과학 연구의 효율성 향상에 도움을 드립니다. 각계의 지속적인 관심을 부탁 드립니다. 오늘에 이야기할 주인공은 신경계 발달장애 병원성 유전자인 MeCP2입니다.
MeCP2는 포유동물의 학습 및 기억 능력에 중요한 영향을 미치며, 레트 증후군 및 MeCP2 중복 증후군의 병원성 유전자이기도 합니다. MeCP2는 다양한 메커니즘을 통해 유전자 전사에 중요한 영향을 미치고 명확한 표현형을 가진 학습 및 기억 동물 모델을 통해 MeCP2를 학습 및 기억에서의 유전자 전사 연구의 이상적인 표적으로 만듭니다. MECP 유전자의 주요 기능은 전사를 조절하는 것입니다. 인간과 마우스에서 이 유전자는 X 염색체에 위치하며 궁극적으로 약 500개 아미노산 잔기의 단백질을 암호화합니다. 이 단백질은 DNA 메틸화 위치에 결합하여 전사 억제를 해제합니다. 레트 증후군은 MeCP2의 돌연변이로 비활성화로 인해 발생하는 X염색체 열성 질환이며, MeCP2중복은 MeCP2의 과발현으로 인해 발생하는 X염색체 우성 질환입니다.
MeCP2는 전사 억제 및 전사 활성화 기능을 모두 가지고 있습니다. 한편, MeCP2는 메틸화 위치에 결합한 후 mSin3A/HDAC 공동 억제 인자에 결합하여 메틸화 구조를 더욱 안정화시켜 유전자 전사를 억제하고, 다른 한편으로는 이 단백질은 인산화후에도 CREB 등을 모집하고 활성단백질을 전사하여 유전자 전사를 촉진합니다.
그림 1. MeCP2 기능의 분자 메커니즘.
정보 출처: 10.1101/lm.048876.118.
MeCP2 유전자는 X염색체에 위치하며, 좌우 인접 유전자는 각각 RCP와 IRAK 유전자입니다.인간, 쥐 및 생쥐에서 엑손 1-4와 그중 3개 인트론은 이 유전자의 기능에 현저한 영향을 미칩니다. MeCP2 단백질은 크게 5개의 부분으로 구성되는데, 첫 번째는 양단의 말단 서열 NTD(N-terminal Domain) 및 CTD(C-terminal Domain) ,중간은 순서에 따라 메틸화 위치 결합 도메인, 중간 영역(interdomian) 및 전사 억제 도메인이 있습니다. 이 단백질의 크기는 이론적으로 53kd이지만 번역 후 일련의 변형을 거쳤기 때문에 분자량은 대부분 웨스턴 블롯에서 75kd입니다. MeCP2는 대부분의 조직에서 많든 적든 어느 정도 발현됩니다. 그중 높은 발현을 나타내는 조직에는 뇌, 폐 및 비장이 포함되고 간, 심장, 신장 및 소장에서는 상대적으로 낮은 발현을 나타냅니다.생쥐의 뇌에서 MeCP2의 발현은 후구, 선조체, 피질, 해마, 시상, 소뇌, 뇌간에서 가장 높게 나타납니다. MeCP2의 주요 발현 형태는 첫 번째 엑손의 번역 여부에 따라 E1과 E2로 구분됩니다.
그림 2. MeCP2 유전자 및 단백질.
정보 출처: 10.1007/s12017-014-8295-9.
MeCP2는 초기 배아 발달, 뉴런 성숙 및 회로 형성 중의 뉴런 분화를 조절하고, 분화 및 성숙 과정에서 염색질 중심의 응집을 촉진하며, 성숙한 뉴런의 염색질 구조 확립에 참여합니다(그림에서 검은색 원으로 표시된 바와 같이 성숙한 뉴런의 염색질 중심은 더 작고 조밀함). 성인기에 MeCP2는 뉴런 기능을 유지하는 핵심 요소입니다. 그는 염색질 구조를 유지하고 뉴런 전사체를 조절합니다. 또한, MeCP2는 항상 자극 의존성 유전자 전사를 대기하고 있습니다. 즉, 자극의 도착은 MeCP2의 해리를 촉진하고 관련 유전자의 전사를 개시하며 이러한 방식으로 인지 기능을 조절합니다.
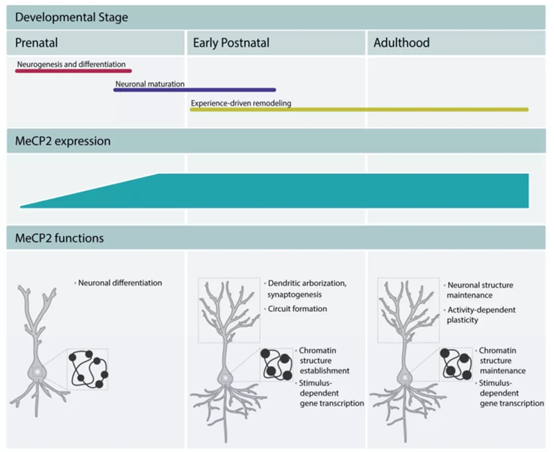
그림 3. MeCP2는 뇌 발달을 조절하고 성숙한 뉴런의 기능을 유지합니다.
정보 출처: 10.3390/ijms20184577.
MeCP2로 인한 레트 증후군의 경우 유전자 요법이 의심할바 없이 이상적인 치료법입니다. 하지만 여전히 많은 문제가 남아있습니다.만약 정맥 주사를 통해 MeCP2를 포함하는 벡터가 체내에서 발현된다면 바이러스 벡터의 독성을 고려하지 않으면 안되며, 특히 간에 독성이 축적되면 치명적인 영향을 미치게 됩니다. 한편,중추신경계에서 MeCP2를 발현시키려면 혈뇌장벽을 어떻게 넘느냐가 가장 큰 문제입니다. 직접 두개내 주사 및 척수관주사와 같은 방법은 혈뇌장벽을 우회할 수 있지만 단일 뉴런에서 MeCP2의 과발현도 불리하기 때문에 표적은 정상 MeCP2 발현이 없는 뉴런이어야 합니다.
MECP2는 레트 증후군의 주요 병원성 유전자로, 초기에 억제하면 지적 발달에 미치는 영향을 부분적으로 완화시키는 데 도움이 되지만 제때에 제어하기 어렵습니다. 한편, 바이러스 벡터에 MECP2를 로딩하면 마우스 모델에 상당한 치료 효과가 있지만 Rett 의 치료에 실제로 적용하려면 아직 갈 길이 멉니다.
지난 수십 년 동안 유전자 치료는 유전성 질환 치료에서 상당한 진전을 이루었습니다. 유전체학 또는 단백질 체학으로 질병을 유발하는 유전자를 찾아내고, 세포 수준 또는 동물 수준 검증과 결합하는 패턴으로 발표되는 좋은 논문들이 많이 있습니다.
지난 10 년 동안 Cyagen은 유전자 치료 요법을 검증하기 위해 수백 개의 연구팀에 많은 유전자 변형 동물 모델 및 바이러스 패키징 서비스를 제공했습니다. 2020년 말까지, Nature, Cell, Science 등 유명한 저널을 비롯하여 Cyagen의 제품 및 서비스를 인용한 논문은 총 4,750건이고 IF(impact factor) 합계는 20,854이며 인용 횟수는 25,043 회가 누적되었습니다. Cyagen은 유전자 치료의 임상전환에 도움을 주는 것을 목표로 하고 있으며, 유전자 치료 연구 분야에 깊이 연구해 왔습니다. 또한 Cyagen은 실험 검증을 위한 유전자 변형 동물 모델과 바이러스 패키징 서비스를 제공할 수 있어 연구자들이 점수가 높은 논문을 발표할 수 있도록 도와주고, 유전자 치료연구 및 임상전환에 도움을 줍니다. 관심이 있으시거나 문의 사항이 있으시면 +86 20-31601779 또는 service-apac@cyagen.com으로 연락 부탁드립니다.
참고 문헌:
1. Robinson HA, Pozzo-Miller L. The role of MeCP2 in learning and memory. Learn Mem. 2019 Aug 15;26(9):343-350. doi: 10.1101/lm.048876.118. PMID: 31416907; PMCID: PMC6699413.
2. Liyanage VR, Rastegar M. Rett syndrome and MeCP2. Neuromolecular Med. 2014 Jun;16(2):231-64. doi: 10.1007/s12017-014-8295-9. Epub 2014 Mar 11. PMID: 24615633; PMCID: PMC5798978.
3. Gulmez Karaca K, Brito DVC, Oliveira AMM. MeCP2: A Critical Regulator of Chromatin in Neurodevelopment and Adult Brain Function. Int J Mol Sci. 2019 Sep 16;20(18):4577. doi: 10.3390/ijms20184577. PMID: 31527487; PMCID: PMC6769791.




영업일 기준 1-2일 내에 답변해 드리겠습니다.