

오늘 이야기의 주인공은 특발성 폐 섬유증에 있어 중요한 역할을 하는 CAV-1 유전자입니다.
CAV-1 유전자 소개
Cav1 유전자는 카베올린-1(Caveolin-1)이라고도 하는 Caveolin-1(CAV-1) 단백질을 코드화하는 기능을 하며, 내장 단백질 Caveolin 계열의 하나로, 해당 계열에는 각각 Caveolin-1,Caveolin-2, Caveolin-3이 있습니다. CAV-1 단백질은 178개의 아미노산으로 구성되어 있으며 CAV-1α와 CAV-1β의 두 가지 이성질체를 가지고 있습니다. 유전자의 위치는, 인간 게놈에서 CAV-1 유전자는 마우스 염색체의 6E1 영역에 대응하는 7번 염색체 자리입니다. CAV-1 단백질의 상대 분자량은 약 21000~24000입니다[1].
또한, CAV-1 단백질은 다중 기능을 갖는 막 신호 단백질이며, 현재 CAV-1은 G 단백질 및 타이로신 키나아제를 비롯한 다양한 신호 전달 과정에 관여하는 것으로 밝혀졌습니다. 최근 연구 결과에 따르면, CAV-1은 TGF-β 신호 전달 경로를 조절하여 세포외 기질(ECM) 생성을 촉진하고 염증을 억제함으로써 궁극적으로 섬유증 발생을 촉진할 수 있습니다.
|
성질 및 형상
|
Caveolin-1
|
Caveolin-2
|
Caveolin-3
|
|
분자량
|
2I-24kD |
20 kD |
17. 2 kD |
|
아미노산
|
178 |
162 |
151 |
|
염색체 위치
|
7q31.1 |
7 q 31.1 |
3 q 25 |
|
Cav-1와의 근사성
|
100( 100) |
58(38) |
85(65) |
|
Cav-2와의 근사성
|
59( 40) |
100(100) |
60( 39) |
|
소중합체화
|
+ |
+ /— |
+ |
|
파밀토일화
|
+ |
? |
+ |
|
Caveolae형성에 관여
|
+ |
— |
+ |
|
분포 상황 |
상피세포, 내피세포, 평활근세포, 섬유아세포, 지방세포, 폐포세포 |
Cav_1과 유사함 |
골격근, 평활근, 심근세포, 성상세포, 연골세포 |
표1. Caveolin 계열 구성 요소 간의 비교[1]
특발성 폐 섬유증(IPF)
특발성 폐 섬유증(IPF)는 원인불명의 질병으로, 염증성 손상과 관련되어 있는 진행성 폐 섬유화 증상 질환입니다. 임상에서의 주요 증상은 호흡 곤란, 기침 및 폐 기능 저하였습니다. 발병 원인은 주로 폐포 상피 세포의 손상, 비정상적인 섬유 아세포 침착 및 비정상적인 폐 복구와 관련이 있으며, 주로 비정상적인 폐 간질 증식, 폐포 단순화 및 폐포 벽 비후와 같은 병리학적 특징으로 나타나 환자의 폐의 수축 능력 저하와 폐 순응도 저하를 유발하며, 섬유화 과정은 거의 돌이킬 수 없습니다[4]. 환자 생존율은 낮고, 특발성 폐 섬유증으로 진단되면 대개 3~5년 후에 사망합니다[5].
현재 많은 연구에서 CAV-1과 IPF 사이에 밀접한 상관 관계가 있는 것으로 보고했으며, 특히 CAV-1의 부재는 IPF의 발생에 있어 중요한 원인이 되고 CAV-1의 상향 조절은 IPF의 발생을 예방하는 데 도움이 됩니다. 따라서 CAV-1은 이후에 IPF의 잠재적인 치료 표적이 될 수 있습니다.
IPF 관련 마우스 모델
현재 가장 고전적인 동시에 일반적으로 사용되는 IPF 모델은 블레오마이신 유발 손상 모델입니다. 블레오마이신은 다양한 종양에서 사멸 효과가 있는 항종양 약물이며, 다양한 섬유증 모델을 유도하는 데 자주 사용됩니다[6]. 폐 섬유증의 마우스 모델에서 블레오마이신은 다양한 섬유증 관련 유전자의 발현을 효과적으로 상향 조절하고 관련 경로를 활성화하며 섬유증 과정을 시뮬레이션할 수 있습니다.
이미 많은 연구에서 마우스의 블레오마이신으로 인한 폐 손상 후 다양한 시점에서 CAV-1 발현의 변화 감지를 시도했습니다. 그 결과, 해당 모델은 손상 후 7일째부터 10일째까지 섬유증를 보였고 손상 후 14일째에 섬유증 진행이 최고조에 달했다. 연구에서는 손상 후 5일(염증이 비교적 더 활성화된 경우), 7일재(섬유증이 진행되는 경우), 12일째(섬유증이 최고조에 가까움) 및 28일째(섬유증 퇴행 단계)에 CAV-1 발현이 검출되었습니다. 결과는 전체 폐 용해물에서 CAV-1 단백질 발현이 5일째, 7일째 및 12일째에 현저히 감소하고 폐 손상 후 28일째에 회복되는 것을 보여줬습니다[7]. CAV-1의 하향 조절 발현이 어떤 세포 집단에 의해 유발되는지 보다 세밀히 연구하기 위해, Lin 등은 폐포에서 다른 세포 집단의 마커에 대해 면역형광 특이적 염색을 수행했습니다. 연구 결과에 따르면, 블레오마이신 손상 유도 마우스 모델에서 CAV -1 발현의 하향 조절은 주로 폐포 유형 I 상피 세포에 집중되어 있습니다[8].
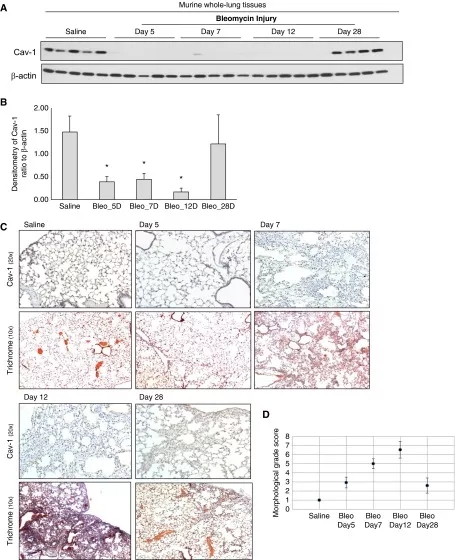
그림1. CAV-1의 하향 조절 발현은 마우스에서 블레오마이신 유발 폐 손상에 대한 반응임[7]
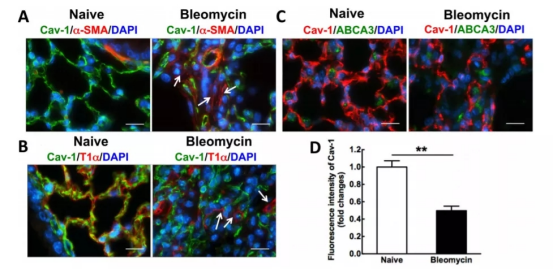
그림2. 블레오마이신 손상 후, CAV-1은 주로 I형 폐포 상피 세포 내에서 발현량이 하향 조절됨[8]
실제로, CAV-1의 항섬유증 효과가 대부분의 연구에서 발견되기는 했지만, 여전히 CAV-1-/- 마우스가 블레오마이신에 의한 손상 후 섬유증 감소을 보인다는 보고가 있습니다[9]. 따라서 CAV-1과 IPF 사이의 관계는 아직 명확한 결과가 파악되어 있지 않습니다. 그 외에, 기존 연구에 따르면 CAV-1 결핍 마우스는 정상적으로 조절되지 않는 내피 세포 증식, 섬유증으로 인한 폐포 간격 증가 및 면역 결핍을 보이는 것으로 보고되었습니다[10]. 이들 연구는 CAV-1과 IPF 사이의 관계가 밀접한 동시에 복잡함을 나타냅니다.
특발성 폐 섬유증의 치료
미국 식품의약국(FDA)은 2014년에 두 가지 약물의 IPF에 대한 사용을 승인했으나, 해당 두 가지 약물의 미국에서의 사용에 대한 분석에 따르면 IPF를 역전시키는 효과가 여전히 만족스럽지 않았습니다. 따라서, IPF에 대한 효과적인 중재 치료는 아직 존재하지 않으며, 효과적인 것으로 간주되는 유일한 치료법은 폐 이식입니다. 따라서, IPF의 질병 치료 표적 및 잠재적인 약물 개발은 언제나 과학계에서 해결하기 어려운 연구 과제이자 뜨거운 쟁점이었습니다.
최근 연구에 따르면, 전기천공법으로 CAV-1 과발현 플라스미드를 폐포 세포에 형질감염시키면 블레오마이신에 의한 폐섬유증 정도를 효과적으로 감소시킬 수 있는 동시에 손상으로 인한 호중구 및 대식세포의 수집도 약화될 수 있습니다[ 8]. 이 치료 방법은 표적 형질감염을 통해 CAV-1 과발현 플라스미드를 폐에 정확하게 전달할 수 있으므로, 외과적 외상 및 다른 조직 및 기관에 대한 영향을 피할 수 있습니다.
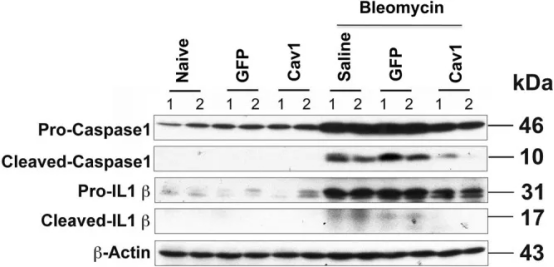
그림3. Cav-1 과발현 플라스미드를 전기천공법으로 폐에 전달하면, 블레오마이신을 21일 동안 투여한 후에 마우스의 폐에서 인플라마좀의 활성화를 효과적으로 억제할 수 있음[8]
요약
CAV-1이 마우스 또는 인간 특발성 섬유증에서 필수 불가결하고 핵심적인 기능을 한다는 것을 입증하는 점점 더 많은 증거가 발견되고 있습니다. 특히 CAV-1의 상향 조절은 향후 IPF의 예방 및 치료를 위해 섬유증 과정을 억제할 수 있는 완전히 새로운 치료 방법론입니다. 이미 CAV-1 유래 펩타이드(Caveolin-1–derived peptide)가 쥐에서 블레오마이신에 의해 유발된 폐섬유증을 효과적으로 억제한다는 연구 보고도 있습니다다[11]. 이러한 연구 결과는 의심할 여지 없이 CAV-1를 IPF의 치료 표적으로 삼게 하는 데 있어 한층 발전을 이끌어 냈고, CAV-1을 표적으로 하는 치료는 가까운 장래에 폭넓게 사용될 수 있을 것입니다.
If you need to read articles in English, please visit our US websites.




영업일 기준 1-2일 내에 답변해 드리겠습니다.