

일반적으로 유전자 편집을 위한 두 가지 주요 방법은 ES(embryonic steam) Cell Targeting 기술과 CRISPR 기술입니다. ES Cell Targeting 기술은 정확하고 off-target 효과가 최소화되어 복잡한 유전자 편집을 수행할 수 있지만, 비효율적이고 시간이 오래 걸리며 노동 집약적이고 비용이 많이 듭니다. 반면에 CRISPR 기술은 효율적이고 빠르지만, off-target 효과의 위험이 있습니다.
비교해 보면, ES Cell Targeting 기술은 정확하고 off-target 효과가 없으며 복잡한 유전자 편집을 수행할 수 있지만 비효율적이고 시간이 오래 걸리며, 노동 집약적이고 비용이 많이 듭니다. CRISPR 기술은 효율적이고 빠르지만, 통제할 수 없는 off-target 위험이 존재합니다.
그렇다면 비용을 절감하면서도 정확한 타겟팅을 보장할 수 있는 기술이 있을까요?
Cyagen은 성숙도, 정확한 유전자 편집 및 안정적인 결과 등 기존 ES 타겟팅의 장점을 유지하면서 업그레이드된 버전의 ES 타겟팅 역할을 하는 TurboKnockout® 유전자 편집 기술을 개발했습니다. TurboKnockout®은 breeding 시간을 두 세대 줄여 주기를 최소 4개월로 단축시킵니다. 이에 따라 TurboKnockout® 기술은 대형 유전자 편집이 필요한 복잡한 모델을 구축하는 데 선호되는 방법이 됩니다. 최적화된 homozygous ES 클론 스크리닝 시스템과 포배(blastocyst) 주입 또는 사배체(tetraploid) 보완 기술을 결합하여 단 5개월 만에 homozygous 유전자 편집 마우스를 대량으로 제작할 수 있습니다.
TurboKnockout® Gene Knockout
100% ESC-derived founder 마우스와 Neo의 self-deletion을 달성함으로 두 세대의 breeding 시간 단축
TurboKnockout® 기술은 ES 타겟팅을 기반으로 독특한 lineage development 및 유전자 편집 기술을 사용하여 TurboKnockout® ES 세포주를 고효율 유전적 이점을 가진 상태로 구축합니다. 특정 배아 발달 단계에서 microinjection을 적용함으로써, TurboKnockout® ES 세포는 내인성 ES 세포를 완전히 대체하여 "chimeric" 단계를 우회하고 ES 타겟팅 제작 주기를 최대 4개월로 단축합니다. 또한, TurboKnockout®은 독특한 self-deleting Neo 카세트를 사용하여 어떤 TurboKnockout® 마우스도 어떤 마우스 계통과 교배를 통해 100% Neo deletion을 달성할 수 있습니다. 즉, TurboKnockout®은 "chimeric" 단계를 우회할 뿐만 아니라 교배 시 Neo가 self-delete하여 Neo-free heterozygous 마우스를 신속하게 제작할 수 있습니다.
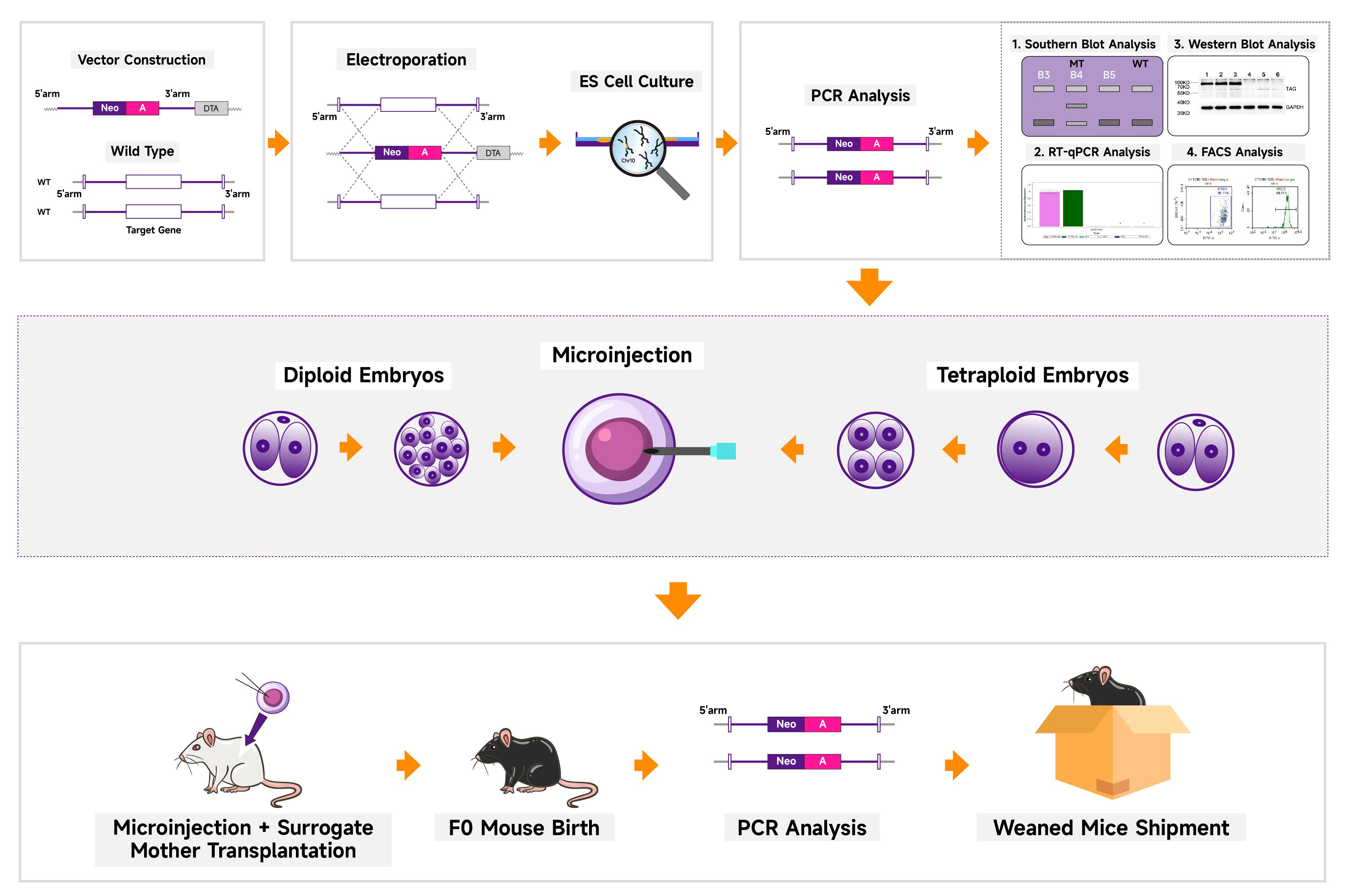
TurboKnockout® 기술의 장점
1. IP issue 없음
TurboKnockout® 기술은 IP issue의 걱정 없고, 신약 개발 프로젝트에서 널리 사용되는 기술입니다.
2. Large fragment 유전자 편집 가능
복잡한 유전자 편집에 적합하며, megabase-sized 서열의 knock-in 및 knockout을 실현할 수 있습니다. 한 번의 이벤트에서 최대 350kb의 서열을 삽입할 수 있으며, ES 세포는 최대 7회 타겟팅을 진행하며 germline transmission을 유지하고 전체 게놈 인간화 마우스 및 인간화 항체 마우스 모델의 제작이 가능합니다.
3. Off-target 효과 없음
TurboKnockout® 기술은 기존의 ES 타겟팅 기술을 기반으로 하며, off-target 효과가 없습니다. PCR, 염색체 핵형 분석, Southern blot 분석, flow cytometry, RT-qPCR, WB 등의 방법을 통해 세포 단계에서 프로젝트 발현을 확인할 수 있습니다. 이에 따른 유전자 편집은 정확하고 안정적입니다.
4. 보다 짧은 주기
"chimeric" 단계를 건너뛰고 self-deleting Neo를 통해 breeding 시간을 두 세대 단축하여, 모델 구축 기간을 4개월로 단축할 수 있습니다. 또한, TurboKnockout® 기술은 ES 세포 단계에서 다단계 BAC 재조합을 수행할 수 있어 서비스 주기를 더욱 단축합니다.
5. Homozygous 모델의 대량 제작
최적화된 homozygous ES 클론 스크리닝 시스템과 배아 pre-injection 또는 사배체(tetraploid) 보완 기술을 결합하여, 5개월 내에 대량의 homozygous 유전자 편집 마우스를 얻을 수 있습니다.
6. 유연한 strain 선택
Cyagen은 C57BL/6NCya, C57BL/6JCya, BALB/cAnCya, 129S2/SvPasCya 등 다양한 strain 옵션을 제공합니다.
TurboKnockout® 기술로 유전자 편집된 마우스 모델
발병 기전에 대해 더 깊이 이해하려면, long-fragment 또는 전체 게놈의 인간화 마우스를 사용하는 것이 필수적입니다. Cyagen은 독자적으로 개발한 TurboKnockout® 기술을 바탕으로, 마우스 유전자를 인간 유전자로 in situ 대체하는 HUGO-GT™(Humanized Genomic Ortholog for Gene Therapy) 프로그램을 출시했습니다. 이를 통해 더 다양한 개입 타겟을 다루는 전체 게놈 인간화 마우스 모델이 성공적으로 제작되었습니다. 이러한 HUGO-GT™ 마우스 모델은 더욱 효율적인 large fragment 벡터 융합 기술을 특징으로 하며, 맞춤형 돌연변이 유도 서비스의 범용 템플릿으로 사용될 수 있습니다. 이 모델들은 신약 개발을 위한 실제 생물학적 메커니즘에 더 가까운 차세대 전임상 연구 모델입니다.
|
제품 번호 |
모델명 |
품종 계통 |
응용 분야 |
|
C001396 |
C57BL/6JCya |
Retinitis Pigmentosa (RP), Congenital Stationary Night Blindness (CSNB), and other retinal diseases. |
|
|
C001410 |
C57BL/6JCya |
Frontotemporal Dementia (FTD), Alzheimer's Disease (AD), and other neurodegenerative diseases. |
|
|
C001418 |
C57BL/6JCya |
Amyotrophic Lateral Sclerosis (ALS), Frontotemporal Dementia (FTD), and other neurodegenerative diseases. |
|
|
C001427 |
C57BL/6NCya |
Parkinson's Disease (PD). |
|
|
C001437 |
C57BL/6NCya |
Spinal Muscular Atrophy with Respiratory Distress Type 1 (SMARD1) and Charcot-Marie-Tooth Disease Type 2S (CMT2S). |
|
|
C001495 |
C57BL/6JCya |
Retinitis pigmentosa (RP), congenital stationary night blindness (CSNB), and other retinal diseases research |
|
|
C001504 |
C57BL/6NCya |
Spinal muscular atrophy (SMA) |
|
|
I001128 |
C57BL/6NCya |
Rett Syndrome (RTT) |
|
|
I001124 |
C57BL/6NCya |
Hutchinson-Gilford Progeria Syndrome (HGPS) |
|
|
C001398 |
C57BL/6NCya |
Spinocerebellar Ataxia Type 3 (SCA3) |
|
|
C001512 |
C57BL/6NCya |
Transthyretin Amyloidosis (ATTR) |
|
|
I001131 |
C57BL/6NCya |
Epilepsy |
|
|
I001132 |
C57BL/6NCya |
Cystic Fibrosis (CF) |
|
|
C001525 |
C57BL/6NCya |
Transthyretin Amyloidosis (ATTR) |
|
|
I001130 |
C57BL/6NCya |
Hepatolenticular Degeneration (HLD) |
|
|
IR1019 |
Sprague-Dawley |
Alexander disease (AxD), traumatic brain injury |
|
|
C001533 |
C57BL/6NCya |
Obesity, metabolic disorders associated with improper fat distribution and storage |
HUGO-GT™ 차세대 인간화 모델 예시
Cyagen은 마우스의 Smn1 유전자를 인간 SMN2 유전자로 대체하여 SMN1 결핍과 인간 SMN2(hSMN2)를 발현하는 I형 척수성 근위축증(SMA) 모델을 개발했습니다. 이는 B6-hSMN2 (SMA) 마우스(제품 번호: C001504)로 알려져 있습니다.
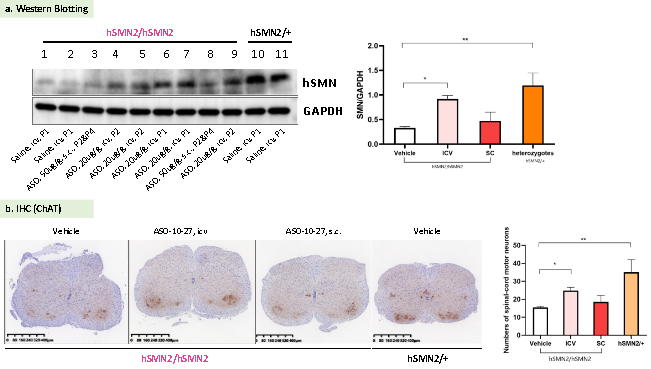
SMN2 splicing 패턴의 변조를 타겟으로 하는 ASO(Antisense oligonucleotide) 분자가 homozygous B6-hSMN2 (SMA) 마우스(hSMN2/hSMN2)에 미치는 영향.
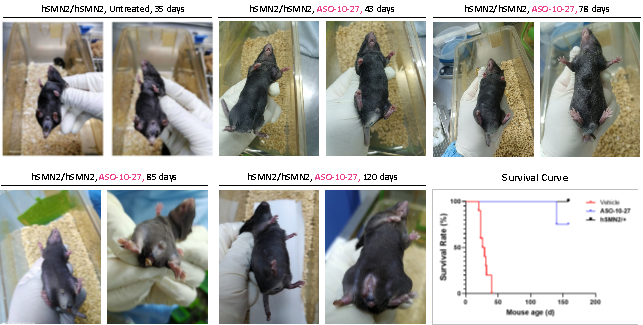
ASO 분자는 homozygous B6-hSMN2 (SMA) 마우스(hSMN2/hSMN2)의 생존율을 높이고 조직 병변을 지연시킵니다.
완전 인간화 항체 약물은 고친화도, 높은 특이성, 저독성 및 작은 부작용을 가지고 있으므로 동물 유래 항체 및 chimeric 항체의 여러 단점을 극복하여 치료용 항체 약물 개발에서 피할 수 없는 트렌드로 자리 잡고 있습니다. 완전 인간화 마우스에서 생성된 완전 인간 항체는 낮은 저면역원성과 고친화도와 같은 특징을 가지고 있습니다. 또한 마우스 모델이 유연한 제작 과정 및 완전한 in vivo 항체 성숙 과정을 가지는 장점도 있습니다.
혁신적인 완전 인간화 항체 약물 연구 개발의 수요에 의해 Cyagen은 TurboKnockout® 기술을 바탕으로 HUGO-Ab® 완전 인간화 항체 마우스 모델을 독자적으로 개발하였습니다. 이 마우스 모델은 고친화도와 저면역원성을 가진 완전 인간화 항체의 in vivo 생성을 실현하여, 항체 발굴 및 신약 개발 프로세스를 크게 가속시킵니다. 이 성과는 수많은 다국적 제약사, 바이오 제약 회사 및 학술 연구 기관에서 입증되었습니다.
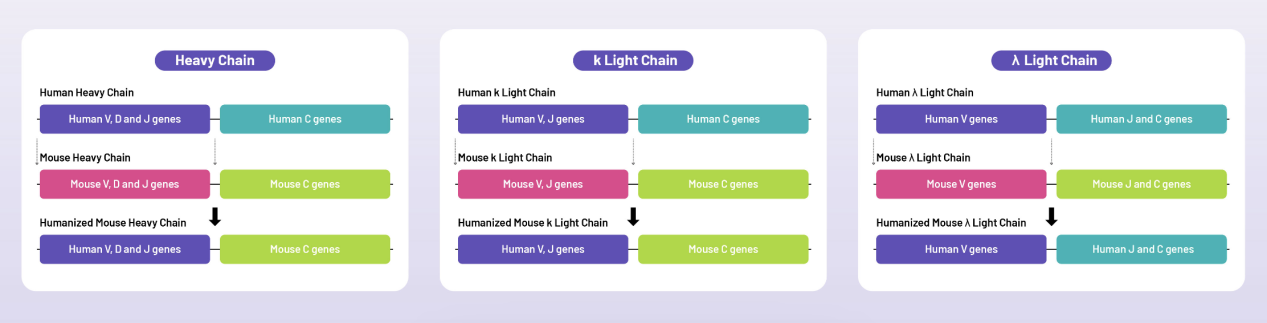
HUGO-Ab™ 완전 인간화 마우스 모델 구축 전략에 대한 다이어그램
유전자 완전 제거(knockout)는 유전자 knockout 기술을 사용하여 타겟 유전자의 모든 exon 또는 여러 개의 중요한 exon 혹은 functional region을 제거하는 방법입니다. 이 방법을 통해 유전자가 신체의 모든 조직이나 세포에서 발현되지 않는 마우스 모델을 제작할 수 있습니다. 이러한 마우스 모델은 주로 어느 유전자(배아 치사 유전자가 아님)의 생리적 및 병리적 전신 기능을 연구하는 데 사용됩니다.
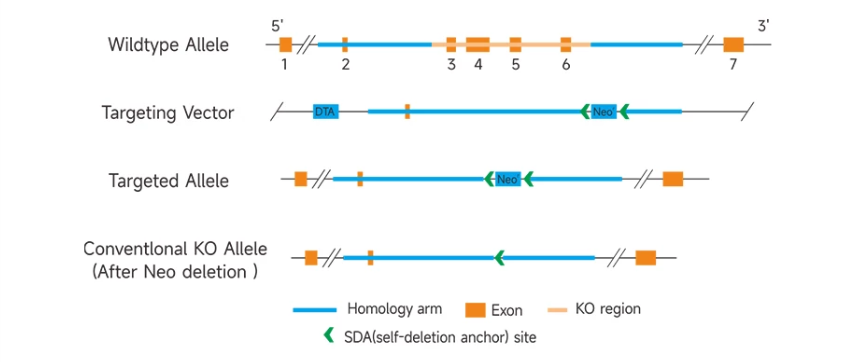
유전자 완전 제거(knockout) 마우스 서비스 예시
Reducing Hypothalamic Stem Cell Senescence Protects against Aging-Associated Physiological Decline.
Cell Metabolism (2020)
Gm31629 gene knockout mice
Legumain promotes tubular ferroptosis by facilitating chaperone-mediated autophagy of GPX4 in AKI.
Cell Death & Disease (2021)
lgmn gene knockout mice
조건부 녹아웃(Conditional Knockout, cKO)은 타겟 유전자의 중요한 exon 양측에 두 개의 LoxP site를 삽입하여 TurboKnockout®-flox 마우스 모델을 제작하는 방법입니다. 이러한 마우스는 Cre 재조합효소를 발현하는 마우스와 교배하기 전까지 타겟 유전자가 정상적으로 발현됩니다. TurboKnockout®-flox 마우스와 조직 특이적 Cre 재조합효소를 발현하는 마우스와 교배하면, 타겟 유전자는 특정 조직이나 세포에서 결핍되지만, 다른 조직이나 세포에서는 정상적으로 발현될 수 있습니다.
조건부 녹아웃(Conditional Knockout, cKO)은 주로 다음과 같은 연구에 사용됩니다:
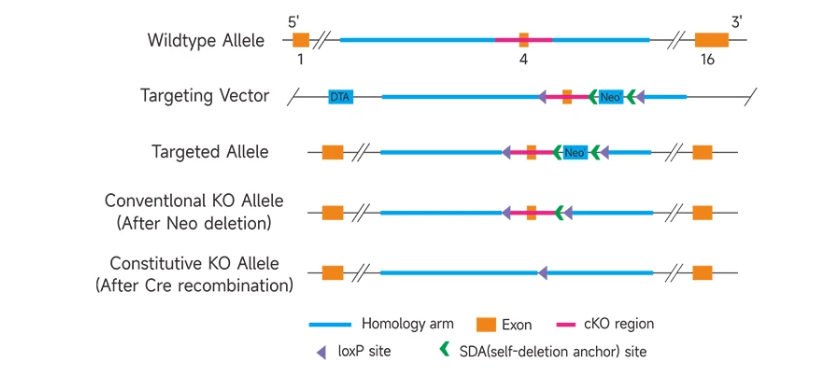
cKO(Conditional Gene Knockout) 마우스 서비스 예시
Transcriptional Repression of Aerobic Glycolysis by OVOL2 in Breast Cancer.
Advanced Science (2022)
OVOL2 conditional gene knockout mice
Hepatocyte TMEM16A Deletion Retards NAFLD Progression by Ameliorating Hepatic Glucose Metabolic Disorder.
Advanced Science (2020)
TMEM16A conditional gene knockout mice
유전자 knock-in(KI)은 특정 돌연변이나 외인성(exogenous) 유전자를 타겟 유전자 자리(gene locus)에 도입하는 것을 말합니다. 예를 들어, 인간의 유전병 모델을 시뮬레이션하기 위해 타겟 유전자에 point mutation을 도입할 수 있습니다. 또는 EGFP, mRFP, mCherry, mYFP, LacZ와 같은 리포터 유전자(reporter gene)를 상동 재조합(homologous recombination)을 통해 타겟 유전자의 특정 부위에 삽입하여 리포터 유전자를 사용해 타겟 유전자의 발현을 추적할 수 있습니다. 또한 리포터 유전자는 마우스 고유의 유전자를 대체할 수 있어 동시에 유전자 knockout (KO)과 knock-in (KI)을 동시에 수행할 수 있습니다. 유전자 Knock-in(KI) 기술은 주로 약물 스크리닝, 신호 경로 연구 및 추적 관련 연구에 사용됩니다.
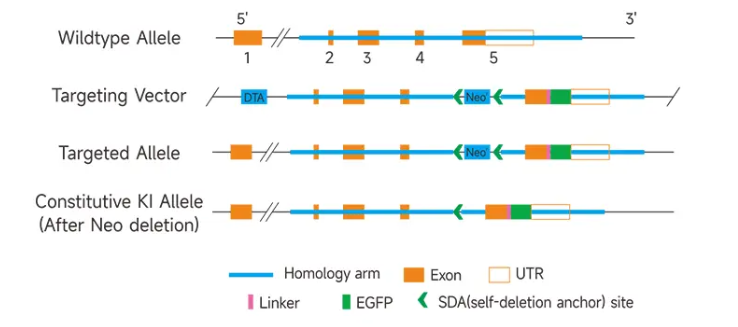
유전자 Knock-in(KI) 마우스 서비스 예시
Leptin receptor-expressing neuron Sh2b1 supports sympathetic nervous system and protects against obesity and metabolic disease.
Nature Communications (2020)
Sh2b1-Cre gene knock-in mice
An Orally Active Galectin-3 Antagonist Inhibits Lung Adenocarcinoma Growth and Augments Response to PD-L1 Blockade.
Cancer Research (2020)
LGALS3 conditional gene knock-in mice
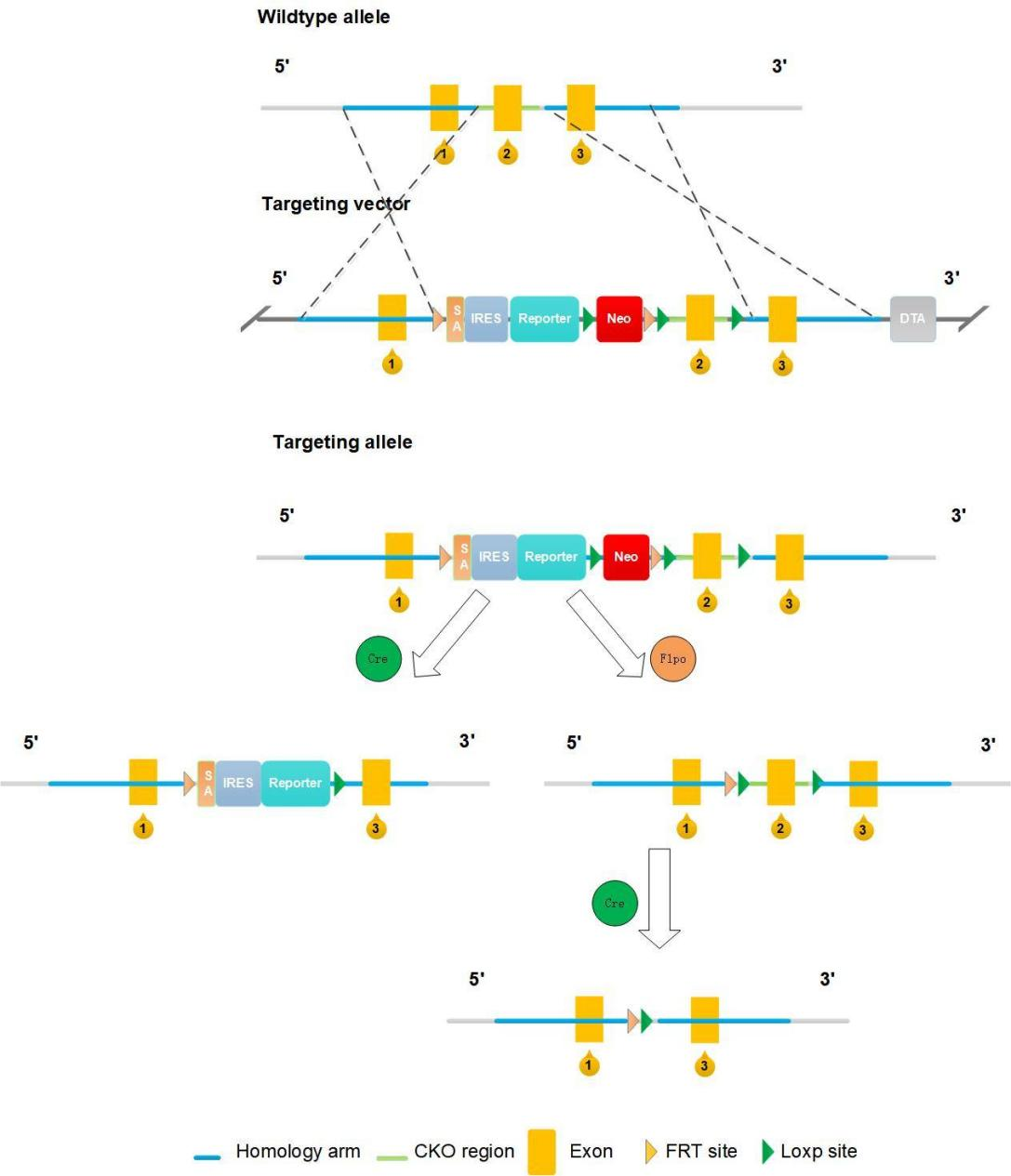
KO-First 기술은 intron의 양쪽에 FRT site가 있는 유전자 교란 카세트를 삽입하여 유전자 knockout을 달성합니다. 이 유전자 교란 카세트에는 splice acceptor, 리포터 유전자, 그리고 Neo가 포함됩니다. 또한, 타겟 유전자의 knockout을 진행한 exon 양쪽에 loxP site를 삽입합니다. 따라서, 결과적으로 제작된 마우스 모델은 타겟 유전자가 knockout을 진행하고, 리포터 유전자 및 저항성 유전자가 knock-in을 수행할 상태가 됩니다. Flp/FRT 및 Cre/LoxP 재조합 시스템을 이용하여 완전한 knockout(KO)과 조건부 녹아웃(cKO) 모두를 달성할 수 있습니다. 즉, KO-First 기술을 사용한 KO 마우스를 Flp 마우스와 교배하면 knockout된 유전자의 발현이 복원되어 조건부 녹아웃(cKO) 마우스를 얻을 수 있습니다. 이를 바탕으로 조건부 녹아웃(cKO) 마우스를 Cre 마우스와 교배하면 타겟 유전자가 knockout된 마우스를 제작할 수 있습니다.




영업일 기준 1-2일 내에 답변해 드리겠습니다.