

Cre-Lox 시스템은 특정 세포/조직에서 유전자 knock-out(KO)/knock-in(KI)을 가능하게 하며, 그 발현 시기는 promoter에 의해 결정됩니다. 시간과 공간 모두에서 유전자 발현의 이중 제어를 달성하기 위해 ligand-dependent CreER 재조합 효소(recombinase)를 개발하였습니다. CreER은 에스트로겐 수용체(estrogen receptor)의 호르몬 결합 도메인(hormone-binding domain)과 융합된 Cre 재조합 효소로 구성됩니다. 에스트로겐 유사체 타목시펜(tamoxifen)이 없는 경우 재조합 효소는 주로 세포질에 존재합니다. 타목시펜(tamoxifen)의 작용 하에서만 재조합 효소가 세포핵으로 들어가 재조합 기능을 발휘할 수 있습니다.
CreERT2는 에스트로겐 결합 도메인에 세 가지 point mutation(G400V/M543A/L544A)을 포함한 CreER 재조합 효소의 업그레이드 버전으로, 유도되지 않았을 때의 background 활성을 줄이고 타목시펜(tamoxifen) 감수성과 유도 효율을 높였습니다. 이번에 개선된 췌장 특이적 Cre-driver 마우스 라인인 Pdx1-CreERT2 마우스 모델(제품 번호: C001537)을 소개하겠습니다.
PDX1 유전자: 췌장의 기관형성과 β-세포 기능의 핵심
PDX1 유전자는 췌장의 기관형성, β-세포의 성숙 및 유지, 그리고 정상적인 인슐린(insulin) 기능의 주요 regulator 역할을 하는 단백질을 암호화합니다. PDX1 유전자의 활성화는 인슐린(insulin) 분비 및 β-세포의 중요한 유전자 발현을 촉진하여 췌장 줄기세포가 췌장 β-세포로 분화하는 데 필수적입니다. 따라서 PDX1은 당뇨병을 위한 유전자 치료 또는 대체 요법의 중요한 타겟입니다.[1]
연구에 따르면 PDX1 단백질은 α-세포의 분화를 억제함으로써 β-세포의 특성과 기능을 유지하며, PDX1이 없는 경우에도 췌장 β-세포는 생존하여 α-세포까지의 reprogramming 과정을 진행할 수 있습니다.[2] PDX1은 초기 췌장 상피에서 특이적으로 발현되며 발달 과정에서 증식과 분화에 중요한 역할을 합니다.
성체 단계(adult stage)에 PDX1은 β-세포에서 호르몬 생산에 필수적입니다. PDX1은 췌장 발달하는 동안 가장 먼저 발현되는 전사 인자(transcription factor) 중 하나이며, β-세포 성숙 과정에도 계속해서 발현됩니다.[1,3] PDX1은 β-세포와 일부 δ-세포 외에도, 발달 과정에 위장관(예: 십이지장) 및 중추 신경계에서도 발현됩니다.[4-5]
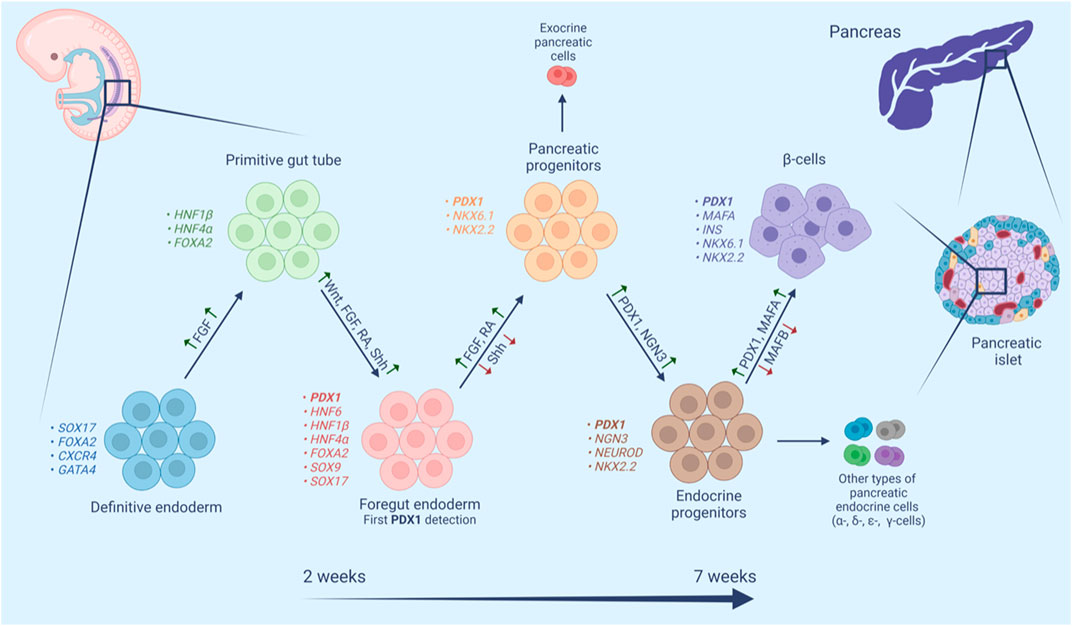
Figure 1. PDX1의 췌장의 기관 및 β-세포 성숙에서의 역할 [1]
Cyagen은 유전자 편집 기술을 사용하여 Pdx1-CreERT2 마우스 모델(제품 번호: C001537)을 독자적으로 개발하였습니다. 이 모델은 탁월한 시간적 제어 기능을 제공하는 간특이적(liver-specific) Cre-driver 마우스 라인이고 유전자 연구 및 전임상 연구에 적용할 수 있습니다. Pdx1-CreERT2 마우스 모델은 마우스 Pdx1 유전자 조절요소의 제어하에 CreERT2 재조합효소를 발현합니다. Pdx1-CreERT2 마우스는 loxP 부위를 포함한 마우스와 교배하면 후대의 췌장에서 타목시펜(tamoxifen) 유도에 의해 loxP 부위 사이의 Cre 재조합효소 - 매개 재조합을 유도할 수 있습니다.
타목시펜(tamoxifen) 유도를 통한 췌장 조직 특이적 유전자 재조합
타목시펜(tamoxifen) 치료가 없는 경우, CreERT2 재조합효소는 주로 세포질에 존재합니다. 타목시펜(tamoxifen)이 투여되었을 때에만 CreERT2 재조합효소가 세포핵으로 진입하여 재조합 활성을 발휘합니다. Pdx1-CreERT2 마우스가 loxP 부위를 포함한 마우스와 교배하면, 타목시펜(tamoxifen) 유도는 후대의 췌장 세포에서 Cre 재조합효소에 의해 loxP 부위 간의 서열 재조합을 유도할 수 있습니다. 타목시펜(tamoxifen) 치료를 하지 않으면 유도 전에 CreERT2 재조합효소의 발현이 일부 누출될 수 있다는 점에 주의해야 합니다. 이 Cre strain에서 Cre 재조합효소 유전자 발현 카세트(cassette)의 삽입 부위는 5번 염색체에 위치하므로, 교배 시 Cre 마우스와 동일한 염색체를 타겟팅하는 유전자 편집 마우스 모델과의 교배는 피해야 합니다.
Pdx1-CreERT2 마우스는 Pdx1-Cre 마우스보다 췌장 특이적 재조합 효율이 더 높습니다
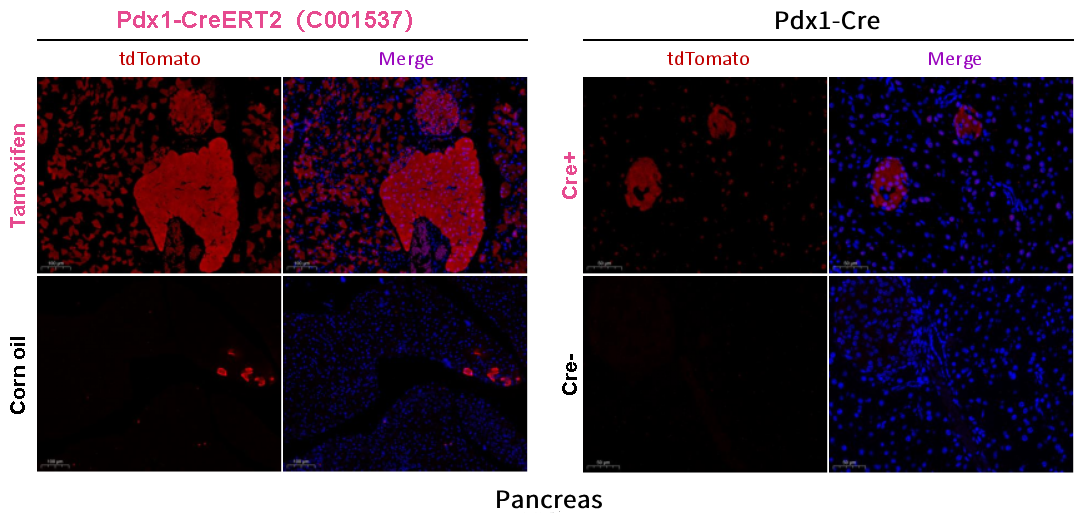
그림 2. 형광 현미경으로 관찰된 췌장 내 Cre 재조합효소의 발현
Pdx1-CreERT2 마우스를 조건부로 tdTomato 형광 단백질을 발현하는 ROSA26-LSL-tdTomato 마우스와 교배한 후, 타목시펜(tamoxifen) 또는 corn oil 처리를 통해 double transgenic 마우스 후대에서 CreERT2 재조합효소의 발현을 유도합니다. 형광 현미경 검사 결과는 타목시펜(tamoxifen) 처리를 받은 그룹의 췌장에서 상당한 양의 tdTomato 형광 신호를 보여주며, 높은 재조합효소 활성을 나타냅니다. 또한, non-inducible Pdx1-Cre 마우스에 비해 Pdx1-CreERT2 마우스는 췌장에서 훨씬 높은 재조합 효율을 나타냅니다.
십이지장과 흉선에서 제한된 발현을 보이는 Cre 재조합효소
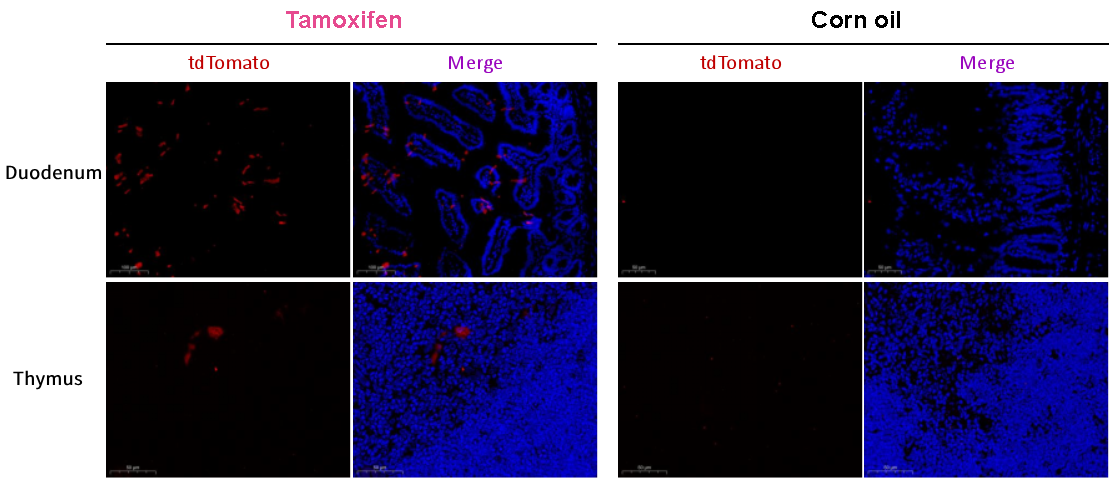
그림 3. 십이지장(duodenum)과 흉선(thymus)에서 Cre 재조합 효소의 발현을 보여주는 형광 현미경 이미지
이전 방법에 따라 Pdx1-CreERT2 마우스를 ROSA26-LSL-tdTomato 마우스와 교배한 후, 후대에서 타목시펜(tamoxifen) 또는 corn oil로 처리하여 CreERT2 재조합효소의 발현을 유도합니다. 형광 현미경 검사 결과는 타목시펜(tamoxifen)으로 처리한 그룹의 십이지장 융모(villi)와 흉선에서 부분적으로 붉은 형광 신호를 보여주며, 유전자 변형 유도에 영향을 받을 수 있는 추가 조직이 있다는 것을 보여줍니다.
우수한 조직 특이성을 보이는 Pdx1-CreERT2 마우스 모델
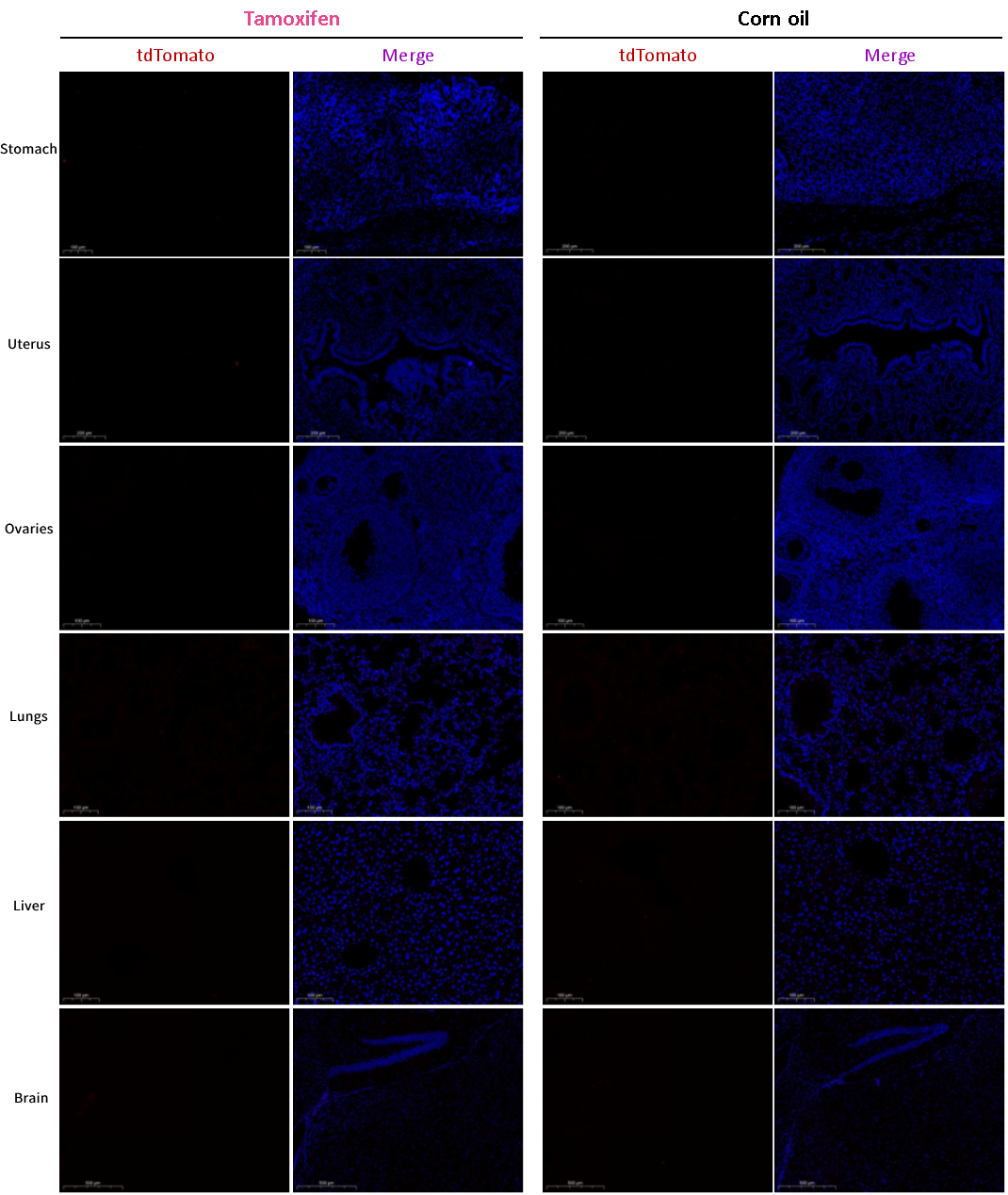
그림 4. 면역형광(Immunofluorescence, IF) 검출을 통해 위, 자궁, 난소, 폐, 간, 뇌를
포함한 다른 조직에서 Cre 재조합효소를 발현하지 않습니다.
Pdx1-CreERT2 마우스와 ROSA26-LSL-tdTomato 마우스를 교배한 후, 그 후대에게 타목시펜(tamoxifen) 또는 corn oil로 처리한 결과, 타목시펜(tamoxifen) 처리 그룹과 corn oil 처리 그룹의 위, 자궁, 난소, 폐, 간, 뇌 등 조직에서 유의미한 재조합 신호가 검출되지 않았습니다. 이는 Pdx1-CreERT2 마우스가 췌장에 대한 높은 타겟팅 특성와 다른 주요 조직에 대한 detargeting 특성을 나타내는 좋은 조직 특이성을 보인다는 것을 의미합니다.
요약
Pdx1-CreERT2 마우스 모델(제품 번호: C001537)은 췌장에서 Cre 재조합효소의 높은 발현을 보였으며, 십이지장과 흉선에서 미미한 형광 신호가 관찰되어 소량의 재조합을 나타냅니다. 위, 자궁, 난소, 폐, 간, 뇌에서는 형광 현미경으로 재조합 신호가 검출되지 않아 다른 주요 조직에 대한 detargeting 특성을 보여줍니다. 따라서 Pdx1-CreERT2 마우스 모델은 췌장 섬세포(islet cell) 조직에 대한 타겟 유전자 연구에 있어 우수한 특이성을 보여줍니다.
참고문헌:
[1]Ebrahim N, Shakirova K, Dashinimaev E. PDX1 is the cornerstone of pancreatic β-cell functions and identity. Front Mol Biosci. 2022 Dec 15;9:1091757.
[2]Gao T, McKenna B, Li C, Reichert M, Nguyen J, Singh T, Yang C, Pannikar A, Doliba N, Zhang T, Stoffers DA, Edlund H, Matschinsky F, Stein R, Stanger BZ. Pdx1 maintains β cell identity and function by repressing an α cell program. Cell Metab. 2014 Feb 4;19(2):259-71.
[3]Jennings RE, Berry AA, Kirkwood-Wilson R, Roberts NA, Hearn T, Salisbury RJ, Blaylock J, Piper Hanley K, Hanley NA. Development of the human pancreas from foregut to endocrine commitment. Diabetes. 2013 Oct;62(10):3514-22.
[4]Ma J, Chen M, Wang J, Xia HH, Zhu S, Liang Y, Gu Q, Qiao L, Dai Y, Zou B, Li Z, Zhang Y, Lan H, Wong BC. Pancreatic duodenal homeobox-1 (PDX1) functions as a tumor suppressor in gastric cancer. Carcinogenesis. 2008 Jul;29(7):1327-33.
[5]Perez-Villamil B, Schwartz PT, Vallejo M. The pancreatic homeodomain transcription factor IDX1/IPF1 is expressed in neural cells during brain development. Endocrinology. 1999 Aug;140(8):3857-60.




영업일 기준 1-2일 내에 답변해 드리겠습니다.