

키메라 항원 수용체 T 세포 (Chimeric antigen receptor T cell, CAR-T) 요법은 유전자 변형 기술을 통해 특이성 항원 인식 도메인 및 T 세포 활성화 신호를 가진 유전 물질을 T 세포로 옮기는 것을 말합니다. T 세포가 종양 세포 표면의 특정 항원을 인식할 수 있도록 하고 다양한 면역 인자를 방출하여 종양 세포를 사멸시켜 종양 치료 목적을 달성할 수 있도록 합니다.
최근 몇 년 동안 CAR-T 요법 관련 연구가 빠르게 발전하고 있으며, 혈액계 종양에서 CAR-T 요법의 탁월한 효능을 바탕으로 과학자들은 이 혁신적인 면역 요법이 고형 종양 분야에 조속히 적용될 것으로 기대하고 있으며, 고형 종양 항원 표적에 대한 CAR-T 요법의 임상 시험은 계속되고 있습니다. ClinicalTrials.gov 에 따르면 2022 년 4 월 현재 1800 개의 세포 임상 실험이 진행 중이며 작년보다 33% 증가했다. 이 중 실체종에 대한 임상실험은 43%, 작년보다 44%, 혈액종양 증가율 (작년보다 25% 증가) 을 초과했다. 이는 CAR-T 요법이 실체종 치료 분야로 빠르게 발전하고 있다는 것을 의미한다.
최근 몇 년 동안 다양한 고형 종양 항원을 표적으로 하는 CAR-T에 대한 연구가 점차 증가하기 시작하여 상당수의 연구가 초기 임상 시험 단계에 진입했습니다.
예를 들어, 신경모세포종에서 ganglioside 2 를 표적으로 하는 CAR-T 치료는 상당한 효과를 달성했습니다.glypican-3 을 표적으로 하는 CAR-T 세포는 간세포암(Hepatocellular carcinoma,HCC) 치료에 좋은 결과를 얻었습니다. 표피성장인자수용체(human epidermal growth factor receptor-2,HER2)는 위암, 췌장암 등 다양한 종양조직에서 과발현되며, 이 표적에 맞게 설계된 CAR-T 세포는 말기 담도암(malignant tumor of biliary tract)과 췌장암을 어느 정도 치료할 수 있다.
메소텔린(mesothelin, MSLN)도 면역 요법의 인기 있는 연구 표적으로, 앵커 체인 막 표면에 당단백질은 다양한 종양에서 고도로 발현되며 종양 증식, 침습 및 나쁜 예후와 밀접한 관련이 있습니다. MSLN을 표적으로 하는 CAR-T 세포의 임상 1상 시험 결과 치료를 받는 췌장암 환자가 상당한 효과를 거둔 것으로 나타났습니다.
밀착 접합 단백질(Claudin 18.2, CLDN 18.2)은 위암 및 기타 암 유형의 잠재적인 치료 표적으로 간주되는 위 특이적 막 단백질입니다. CAR-T 세포 기반 수용체 티로신 키나아제 유사 고아 수용체 1 (receptor tyrosine kinase-like orphan receptor 1, ROR1)은 폐암에서 특이적으로 발현되고 종양 증식, 전이 및 약물 내성에 중요한 역할을 하는 잠재적인 폐암 치료 표적이 되는 것으로 보고되었습니다.
그에 더해, 연구가들은 폐암, 결장암, 위암, 유방암, 췌장암을 치료하는 암 배아 항원 (carcinoembryonic antigen, CEA), 악성 흉막간피종(pleuralmesothelioma) 치료를 위한 섬유아세포 활성화 단백질(fibroblast activation protein, FAP)과 전립선암 치료에 사용되는 전립선특이막항원(Prostate-specific membrane antigen, PSMA) 등이 있다.
종양 세포에 대한 CAR-T 세포의 사멸 효과는 주로 종양 관련 항원(tumor associated antigen, TAA)의 인식에 의존하며, 이러한 항원은 종종 종양 세포 표면에서 과발현되지만 다른 정상 조직 세포에서도 어느 정도 발현됩니다. CAR-T 세포는 종양 세포를 제거하는 동시에 정상 조직 세포를 잘못 공격할 수도 있는, 즉 표적 외 효과(off-target effects). 결과적으로 비종양 세포를 죽이는 심각한 부작용이 발생하여 CAR-T 요법이 기대한 치료 효과를 얻지 못합니다.
혈액 종양에 비해 CAR-T 세포는 혈액 시스템을 통해 고형 종양 조직을 관통하기 어렵습니다. 한편, 고형종은 T세포의 수송을 방해하여 면역 탈출을 할 수 있다. 반면에, 케모카인-케모카인 수용체가 잘못 배합되었기 때문에 접착 분자의 하향 조절 및 종양 새로운 순환기관 시스템(circulatory system)의 이상과 같은 원인으로 인해 CAR-T 세포가 둥지(Homing)로 정확하게 돌아가기 어렵습니다. 또한, 고형종의 또 다른 특징은 기질 세포(stromal cell)에 많은 수의 종양 관련 섬유아세포가 포함되어 있다는 것입니다. 이 세포는 콜라겐을 분비하여 CAR-T 세포의 침윤을 포획하고 방지하며 사멸 활성을 약화시키는 물리적 장벽으로 조밀한 섬유증 기질을 형성합니다.
종양 미세환경(tumor microenvironment,TME)은 암세포가 성장을 촉진하도록 재설계된 미세환경으로 저산소, 저영양, 낮은pH, 높은 침투 특성을 가지고 있습니다. 이 환경은 종양의 증식을 촉진할 수 있지만 CAR-T 세포의 생존에 매우 도움이 되지 않습니다. 또한 TME에는 종양 관련 대식세포(Tumor-associated macrophages, TAM), 조절 T세포(Regulatory Tcells, Tregs), 골수유래 억제세포(myeloid-derived suppressor cells, MDSC) 등 다양한 면역 억제세포(myeloid-derived suppressor cells, MDSC)가 포함되어 있어 다양한 경로를 통해 CAR-T 세포를 억제하고 사멸 효과를 현저히 감소시킵니다.
이러한 도전에 대처하기 위해 연구자들은 많은 준비와 미래 지향적인 작업을 수행했습니다.주요 대응책은 다음과 같다.
예를 들어, CAR-T 세포가 종양의 미세 환경 특성을 변화시킬 수 있는 염증성 사이토카인(proinflammatory cytokines)을 동시에 발현하도록 하는 동시에 체내에서 이러한 인자의 지속적인 발현을 방지하고 독성을 유발하기 위해 CAR-T 세포가 표적과 결합한 후 사이토카인의 발현을 유도하도록 설계되어 사이토카인의 역할을 종양 근처로 제한합니다. 억제성 CAR 분자의 발현, 이중 표적 활성화, scFv 친화도 향상과 같은 다른 전략은 CAR-T 세포의 특이성을 변화시켜 항종양 활성 및 안전성을 최적화합니다.
CRISPR 녹아웃 기술을 사용하면 종양 미세 환경에 대한 CAR-T 세포의 민감도를 줄일 수 있습니다. Tmunity 는 유전자 편집을 이용하여 T 세포의 내인성 T 세포 수용체 (T cell receptor, TCR) 와 PD-1 수용체를 제거했습니다. 그런 다음 뉴욕 식도 편평 세포암 1(New Yorkesophageal squamous cell carcinoma 1, NY-ESO-1) 항원을 표적으로 하는 TCR을 발현하여 CAR-T 세포를 고형종 부위에 보다 효과적으로 도달시켜 종양 미세 환경에서 CAR-T 세포의 종양 제거 효과를 향상시킵니다.
BioNTech은 리포솜(liposome)을 사용하여 CLDN6 mRNA를 인코딩하는 백신을 전달하며, 체내에 주입한 후 비장, 림프절 등의 항원 제시 세포(Antigen-presenting cells, APCs)가 CLDN6 항원을 표면에 제시할 수 있다. 이러한 APC는 CLDN6 CAR-T 세포의 증식을 촉진할 수 있습니다. 또한 면역관문억제제 PD-1과 병용투여를 통해 고형종에 대한 CAR-T 요법의 치료효과도 향상되었다.
최고의 의학 저널인 Nature Medicine에 발표된 최신 연구에서 CAR-T의 아버지인 Carl June 팀이 개발한 새로운 CAR-T 치료법도 고형종 치료에 희망을 주었습니다. 고형종 전이성 거세저항성 전립선암(metastatic castration-resistant prostate cancer, mCRPC)의 미세환경에는 형질전환 성장인자 β(transforming growth factor-β, TGF-β)와 같은 다양한 높은 수준의 억제인자가 존재하여 CAR-T 세포의 효능을 현저히 감소시킬 수 있습니다. 이 연구팀은 유전자 편집 수단을 통해 PSMA 를 목표로 CAR-T 세포의 관련 수용체를 비활성화시켰다. 따라서 TGF-β 신호 전달을 차단하여 TGF-β의 억제 효과에 저항하고 CAR-T 세포의 항종양 능력을 향상시킵니다.
이 치료법은 초기 동물 실험에서 좋은 치료 효과를 거둔 기초 위에서 I 기 임상 실험을 진행했다. 그 결과 치료를 받은 13명의 mCRPC 환자 중 CAR-T 세포가 체내에서 증폭되어 지속될 수 있었고 종양 조직에 유의하게 농축된 것으로 나타났다. 효능 평가 측면에서 13명의 환자 중 4명은 전립선 특이적 항원(Prostate specific antigen, PSA)이 30% 이상 감소했습니다(그림 1-a). 또한 CT 평가에 따르면 5 명의 환자 (38.5%) 가 3 개월간의 영상 평가에서 질병 안정을 유지했으며, 그 중 한 환자는 세포 치료 후 종양이 가라앉았다는 증거를 관찰했다. 그 PSA 는 세포 주입 후 36% 감소했다 (그림 1-b).
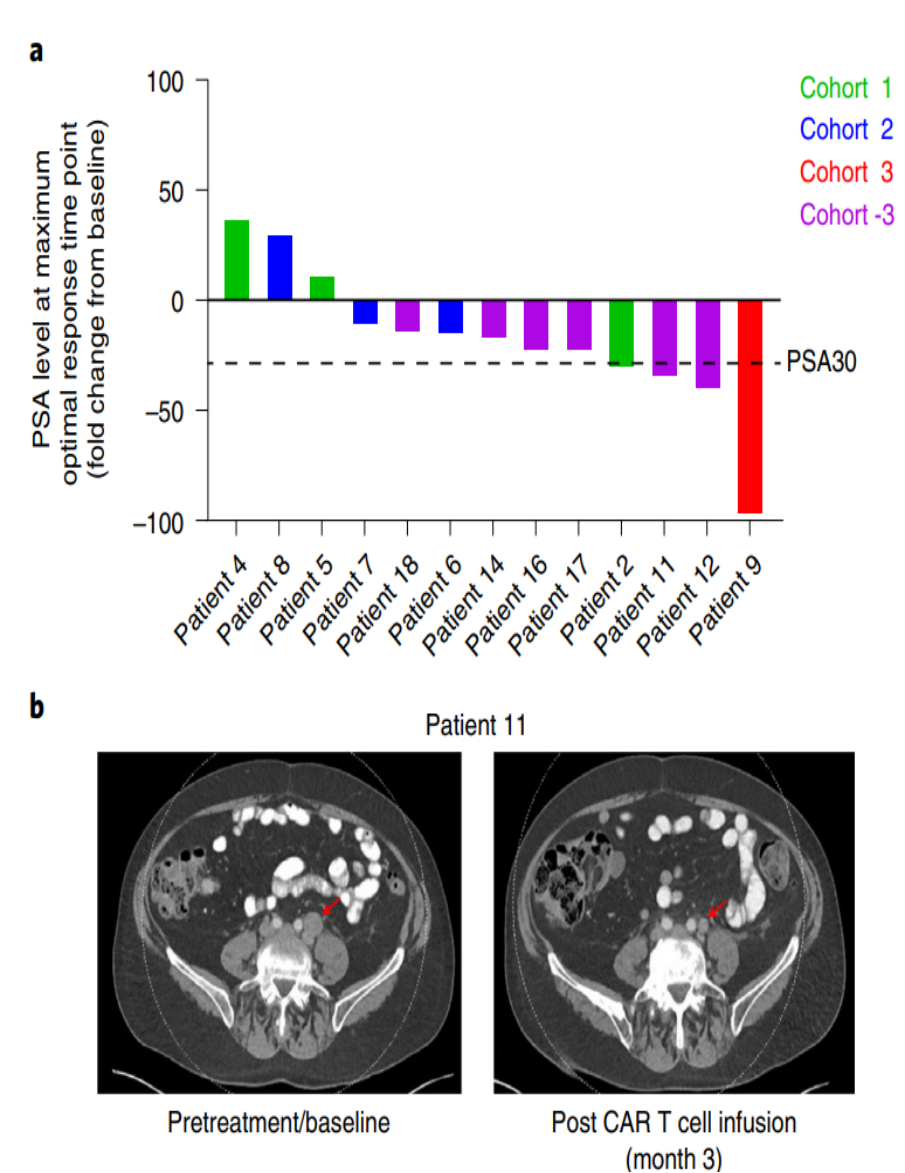
그림 1 CART-PSMA-TGFβRDN 세포 치료 후 병리 및 방사선학 평가 [1]
이 연구는 또한 첫 번째 CAR-T 치료 실체종의 임상 연구로, PSMA 를 겨냥한 항 TGF-베타 CAR-T 세포 요법이 mCRPC 를 치료하는 실체종의 실현가능성과 안전성을 입증해 CAR-T 요법이 고형 종양을 공격하는 길에 큰 동력과 자신감을 제공했다.
CAR-T 요법은 고형종 치료에 여전히 많은 어려움이 있지만 과학자들의 노력과 탐구는 멈추지 않습니다. 종양 미세 환경과 CAR-T의 항종양 효과에 영향을 미치는 요인에 대한 연구가 증가하고 있으며, 다제병용요법(combination therapy)의 시도와 함께 CAR-T 요법이 고형종 분야에서 더 많은 가능성을 볼 수 있을 것이라고 믿습니다.
[1]Narayan V, Barber-Rotenberg JS, Jung IY, et al. PSMA-targeting TGFβ-insensitive armored CAR T cells in metastatic castration-resistant prostate cancer: a phase 1 trial [published online ahead of print, 2022 Mar 21]. Nat Med. 2022;10.1038/s41591-022-01726-1.




영업일 기준 1-2일 내에 답변해 드리겠습니다.