

HD 의 발병 유전자는 4 번 염색체의 HTT 유전자로, 이 유전자 1 번 외현자는 CAG 삼뉴클레오티드(Trinucleotide) 불안정 반복 서열을 가지고 있다. 정상인에서 이 반복 시퀀스의 수는 6-35개이며 40개를 초과하면 HD가 발병하고 댄스 증상이 나타나며 36-39개 사이이면 일부는 발병하고 일부는 무증상입니다. HD의 발병 시기는 CAG 반복 서열의 수와 상관관계가 있으며 반복 수가 많을수록 발병률이 빨라진다는 점은 주목할 가치가 있습니다. 약 40개의 CAG 반복시퀀스를 운반하는 것은 일반적으로 40세에 운동 장애가 나타나기 시작하고 60개 이상을 운반하는 것은 일반적으로 청소년기에 발병합니다.
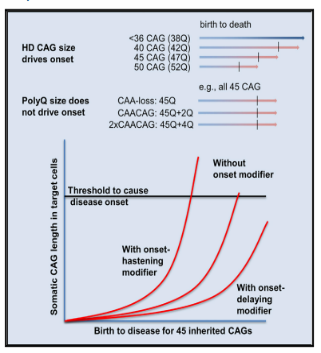
그림 1. CAG 반복 시퀀스는 HD 발병 시간을 결정합니다
HD 유전자 차원의 병원성 요인은 명확하지만 병리학적 기전에 대한 포괄적이고 명확한 보고는 없습니다. 돌연변이 HTT 단백질이 뇌 내선조체(Striatum)에 축적되어 선조체(Striatum) 내 뉴런을 손상시켜 뉴런이 시들고 선조체(Striatum)가 위축되는 것으로 인정됐다. HTT 유전자가 돌연변이되면 돌연변이 HTT의 발현은 작은 CAG 반복 RNA(sCAG RNA)에 의해 형성된 RNA 헤어핀, 비정상적인 반복 관련 비ATG(RAN) 번역 단백질 산물, 비정상적인 스플라이싱에 의해 형성된 아미노 말단 HTT 유전자 1번 엑손 단백질 단편 및 더 작은 단편을 생성하기 위해 추가 가공될 수 있는 돌연변이 HTT(mHTT)를 포함하여 다양한 독성 변이체를 생성할 수 있습니다.이러한 산물은 단량체의 존재를 유지하거나 올리고머(oligomer) 또는 봉입체(inclusion body)를 형성하여 다양한 정도로 HD 발병을 촉진할 수 있습니다.
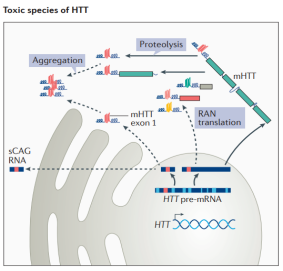
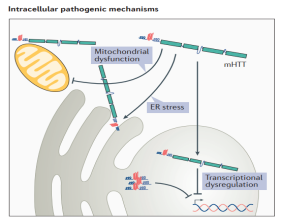
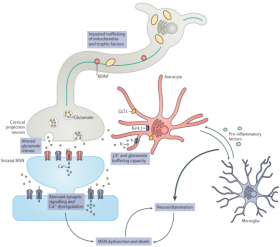
그림 2-4 CAG 반복 시퀀스는 HD 발병 시간을 결정합니다
HD에 대한 유전자 치료는 최근 몇 년 동안 주요 연구 기관과 제약 회사의 핵심 연구 방향입니다. 유전자 치료에는 AAV 벡터 전달, ASO 약물, 소형 핵산 약물 등과 같은 다양한 방법이 있습니다. 현재 임상 단계의 항목은 다음과 같이 나열되며, 하나는 uniQure회사의 AMT-130이며, 유럽에서 수행된 1b/2상 임상 시험에서 첫 번째 2건의 환자 투여가 완료되었습니다. AMT-130은 이회사의 첫 번째 중추 신경계 유전자 치료 제품으로 AAV5 벡터를 기반으로 타깃 micro-RNA를 전송하여 mHTT의 발현을 크게 감소시킬 수 있습니다. 신경외과 수술을 통해 전신마취 환자의 두개골에 2~6개의 작은 구멍을 뚫고 마이크로 카테터를 이용해 AMT-130을 뇌의 두 특정 부위(미상핵과 선조체)에 주입하는 것은 침습적 치료로 위험성이 있다는 점에 유의해야 한다. 둘째, 로슈제약과 Wave생명과학이 연구한 ASO 약물 tominersen은 I/II상 시험에서 심각한 부작용 없이 뇌척수액의 mHTT 수치를 유의하게 감소시킬 수 있음을 보여주었습니다. 그러나 III상 시험에서 이 약이 더 높은 효능을 나타내지 못하자 2021년 3월 III상 연구 중단을 선언하고 두 I/II상 약물 개발도 중단했습니다. 셋째, Novartis 바이오가 개발한 혈뇌 장벽을 통과할 수 있는 경구용 저분자 RNA 스플라이싱(Splicing) 조절제 Branaplam, FDA 는 이미 빠른 통로 자격을 부여해 현재 2 기 임상실험에 있다. Branaplam은 mHTT를 발현하는 mRNA 전구체에 결합하여 mRNA 스플라이싱 과정을 변경하여 mRNA 분해를 유발할 수 있습니다. 연구에 따르면 Branaplam은 시험관 내 세포 모델, 동물 모델 및 초기 임상 시험에서 mHTT 수준을 감소시킬 수 있습니다. 연구자들은 또한 논문에서 이 소분자 요법이 RNAi와 ASO 외부에서 HD 질병의 진행을 변경하는 새로운 전략을 제공한다고 밝혔습니다.
FUDAN UNIVERSITY의 Boxun Lu(鲁伯埙) 팀은 자가소화포(autophagosome) 결합 화합물을 기반으로 한 약물 연구 개발 개념을 선구적으로 제안했으며 연구된 '소분자 접착제'의 일종으로 HD 병원성 단백질 mHTT에 특이적으로 결합하고 세포 자가소화포를 사용하여 mHTT 수준을 낮추고 야생형 HTT를 부착하지 않습니다. 연구에 따르면 이 약은 혈뇌 장벽을 넘을 수 있는 능력도 있어 저량의 복강을 통해 HD 쥐의 대뇌겉질(cerebral cortex)과 선조체(Striatum)의 mHTT 수준을 직접 낮출 수 있는 것으로 나타났다. 야생형 HTT 수준에 영향을 미치지 않고 질병 관련 표현형을 개선하여 경구 또는 주사 약물 개발의 접점을 제공하고 향후 약물 개발을 위한 새로운 방향과 가능성을 제공합니다.
HD 마우스 모델은 크게 두 가지 범주로 나뉩니다. 하나는 유전자 변형 과발형(transgenic)이 HTTexon1에 해당하는 단백질 단편을 발현하는 R6/2 및 R6/1 모델, 더 긴 단편을 발현하는 N171-82Q 모델 등을 포함하여 mHTT의 N-말단 단편을 형질전환에 의해 과발현하는 것이다. 이러한 N-말단 단편은 모두 mHTT의 polyQ 서열을 포함하며 생성된 N-말단 단편은 독성이 높고 쉽게 응집되는 것으로 밝혀졌습니다. 이러한 모델은 변이 유전자의 5-말단 서열만 있고 종종 여러 사본이 있기 때문에 유전학적으로 HD 환자와 일치하지 않으며 표현형은 종종 초기(몇 주에서 십 몇 주)에 나타나며 대부분의 환자와 일치하지 않습니다. 두 번째는 두 가지 방법으로 전체 길이의 mHTT를 표현하는 것입니다. 하나는 유전자 변형 인간화 mHTT를 인공 염색체 방법으로 발현하는 것으로 주로 YAC(효모 인공 염색체)와 BAC(박테리아 인공 염색체)의 두 가지 모델을 포함합니다. 이 방법의 장점은 인간 유전자를 발현하고 프로모터, 인트론 및 기타 게놈 서열을 포함하여 인간 게놈에 있는 유전자의 모든 관련 요소를 포함합니다. 단점은 여전히 유전자 변형 모델에 속하며, 일부 돌연변이 유전자의 사본이 더 많지만 야생형 사본의 수가 감소하지 않아 환자의 유전자형과 일치하지 않는다는 것입니다. 다른 하나는 mHTT를 발현하기 위해 마우스 Htt 유전자의 exon1을 환자 유전자의 exon1로 대체하는 것입니다. CAG 반복 수에 따라 Q140, Q150, Q175 및 기타 모델이 일반적으로 사용됩니다. 이 방법은 내인성 Htt 프로모터를 사용하여 mHTT 단백질을 발현하는 유전자 녹인(KI)에 속하며 유전학적으로 HD 환자에 가장 가까운 원래의 야생형을 대체합니다. 하지만 결함도 있다. 그 표현의 돌연변이 유전자는 exon1 과 일부 intron1 을 제외하고, 나머지는 모두 쥐의 동원유전자 Htt 로, 종차이성을 가지고 있다. 일반적으로 HD 연구에 사용되는 마우스 모델의 장점은 연구 도구가 전면적이고 유전형과 표형이 환자와 잘 맞아떨어져 HD 메커니즘과 치료 연구에 중요한 정보를 제공한다는 점이다.
과학자들은 또한 일련의 큰 동물 HD 모델을 만들었습니다. 하나는 HD 원숭이 모델입니다. 84개의 CAG 반복 유전자를 운반하는 exon1은 렌티바이러스를 사용하여 난세포에 주사된 방법으로 발현되었습니다. 이 연맹의 전문가인 리샤오장(李晓江) 교수와 리세화(李世华) 교수는 Yerkes 국립 영장류(human primates) 연구 센터의 Anthony Chan과 협력하여 2008년 HD 붉은털 원숭이(rhesus monkey) 모델을 구축하여 근긴장 장애 및 댄스 증상과 같은 표현형을 성공적으로 나타냈다고 보고했습니다. 두 번째는 HD 양 모델입니다.수정란을 현미경으로 주사하여 73개의 CAG 반복을 운반하는 HTT 전장 cDNA로 옮깁니다. 이 방법으로 구축된 HD 양 모델은 분자 수준의 HD 병리학적 변화와 대사 표현형을 나타내었지만 신경계 기능의 명백한 질병 표현형은 관찰되지 않았습니다. 세 번째는 매우 유망한 HD 돼지 모델입니다.
왜 돼지 모델이 매우 유망하다고 말합니까?
돼지의 체형, 계통발생, 대사 등이 인간의 상태와 매우 유사하고 뇌의 크기가 비교적 유사하며 사람처럼 뇌의 홈(Sulcus)을 가지고 있다. 따라서 돼지의 뇌질환 모델은 독특한 장점이 있으며 임상 적용으로 전환되기 쉽다. 최초의 HD 돼지 모델은 mHTT를 유전자 변형 과발현하는 N-말단 단편을 통해 구성되었지만, 또한 외인성 질병 치료 유전자 단편을 발현하는 독성이 너무 강하기 때문에 출생 후 생존 시간이 매우 짧고 병원성 유전자를 계대할 수 없다. 신경퇴행성 질환을 보다 정확하게 시뮬레이션하기 위해 연구자들은 CRISPR/Cas 유전자 편집 기술을 사용하여 돼지의 내인성 유전자에 인간 돌연변이 HTT 유전자를 삽입하고 체세포 핵 이식 기술을 통해 HD 유전자 녹인(KI) 돼지 모델을 확립했습니다. 외인성 형질전환 유전자를 도입하지 않고 내인성 야생형 유전자를 질병형으로 직접 변화시켜 HD 유전자형을 환자와 완전히 일치시킨다. 추가 연구에 따르면 이 모델은 뇌 선조체(Striatum)에서 Medium spiny neurons, MSN의 선택적 사망의 HD 환자의 전형적인 병리학적 특성을 잘 시뮬레이션할 수 있으며 체중 감소 및 HD와 유사한 비정상적인 행동 표현형을 나타낼 수도 있습니다. 더 중요한 것은 이러한 표현형이 자손에게 유전될 수 있어 HD 약물 개발을 위한 안정적인 대규모 동물 모델 공급원을 제공한다는 것입니다.
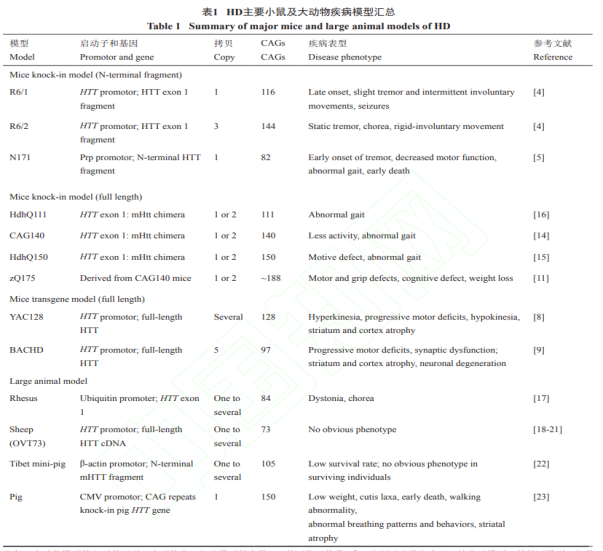
그림 5. CAG 반복 시퀀스는 위에서 언급한 동물 모델 외에도 효모 모델, 선충 모델, 초파리 모델, 제브라피쉬 모델 등을 결정합니다. 이러한 모델도 표현형 테스트 실험 플럭스가 높고 주기가 짧으며 고통량(High throughput) 필터링이 용이한 등 특정 장점을 가지고 있습니다.

홈페이지(https://rddc.tsinghua-gd.org/)에 접속해 즐겨보세요!
*성명: RDDC 데이터와 도구는 과학 연구용으로만 사용되며, 참고용으로만 제공되며, 의학적 진단과 평가의 최종 결론으로 사용할 수 없습니다.
[9] Zhaoyang L , Cen W , Ziying W , et al. Allele-selectivelowering of mutant HTT protein by HTT-LC3 linker compounds[J]. Nature, 2020,2019年575卷7781期:203-209页.
[10] 安平, 鲁伯埙. 亨廷顿舞蹈症研究现状[J]. 中国细胞生物学学报, 2018, 40(10):12.




영업일 기준 1-2일 내에 답변해 드리겠습니다.