

Cyagen는 자체 개발한 TurboKnockout 기술과 최적화된 CRISPR-Pro 기술을 사용하여 망막색소변성증, 선천성 흑몽, 황반 변성, 전색맹과 같은 질병에 대한 일련의 유전자 편집 및 인간화된 마우스 모델을 개발하여 기초 연구와 신약 개발 분야의 동물 모델에 대한 고객의 요구를 충족시키는 동시에 연구자들에게 맞춤형 서비스를 제공합니다.
Q: OCT 검사의 역할과 데이터 해석은 어떤가요?
A: OCT는 Optical coherence tomography의 약자로 정식 명칭은 광간섭 단층 촬영입니다. 이는 비접촉, 고해상도 단층 촬영 및 생체 현미경 영상 장치로 안구 후안부(망막, 망막 신경섬유층, 황반 및 시신경 유두 포함)의 생체 내 관찰, 축 단면 및 측정에 사용할 수 있으며 황반 구멍, 낭포황반부종, 당뇨망막병증, 노인성 황반변성, 녹내장 등의 안질환 진단에 사용할 수 있습니다. 그림 1은 OCT로 검사한 안저망막의 층별 모식도이며 Cyagen의 기존 안질환 모델은 대부분 외핵층(ON) 소실과 망막색소상피(RPE) 소실의 병변 표현형과 관련되어 있습니다.
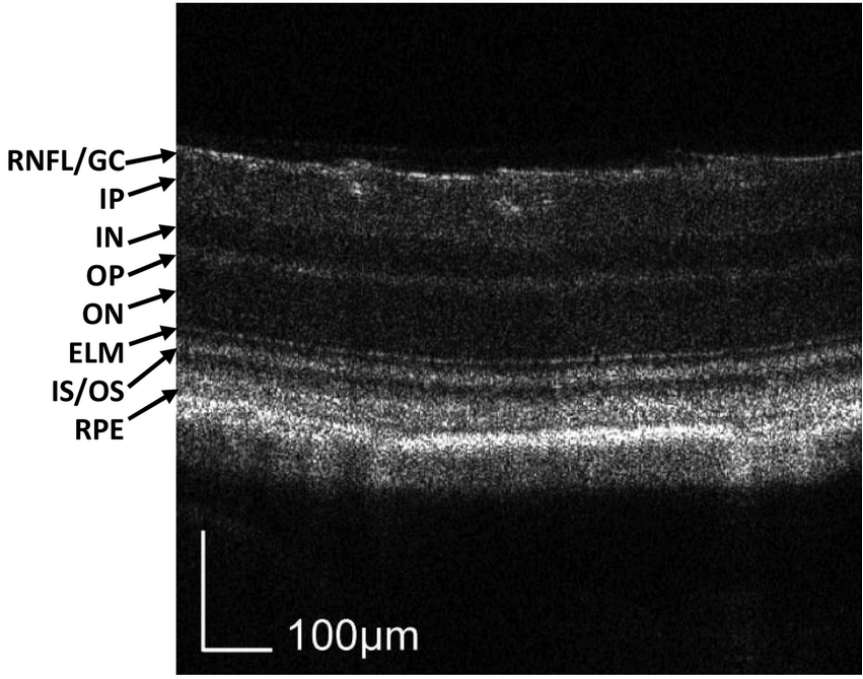
그림 1. 마우스 망막층의 OCT 검사 RNFL/GC: 신경섬유/신경절 세포층, IP: 내망상층, IN: 내핵층, OP: 외망상층, ON: 외핵층, ELM: 외경계막, IS/OS: 광수용체 세포 내/외절, REP: 망막색소상피 [1]
Q: ERG 검사 데이터의 해석은 어떤가요?
A: ERG는 Electroretinogram의 약자로 정식 명칭은 망막전위도입니다. 빛의 자극을 받아 발생하는 복합적인 전위 변화에서 전극을 이용하여 망막의 시각감각세포를 인출하고 적절한 신호증폭장치를 통해 기록하면 이후 망막전위도를 통해 망막의 기능을 알 수 있습니다. ERG의 a파는 주로 광수용체 세포(간상세포와 원추세포)에서 생성되는 음극파이며, b파는 망막 내 뮐러(Müller) 세포와 양극성 세포에서 나오는 양성 전위입니다.
Q: 마우스 ERG의 데이터는 진폭을 기준으로 하는가요, 아니면 피크 높이를 기준으로 하는가요?
A: ERG 데이터는 진폭을 기준으로 판단합니다.
Q: ERG 데이터에서 진폭은 어떻게 정의되는가요?
A: 그림 2와 같이 a파 진폭은 기준선, 즉 기준선에서 a파 최저점까지의 진폭을 나타냅니다. b파의 진폭은 기준선을 기준으로 하는 것이 아니라 a파 즉 a파의 최저점에서 b파의 최고점까지의 진폭입니다.
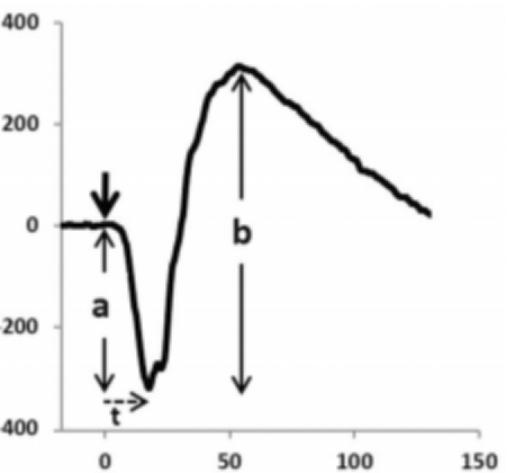
그림 2. ERG 데이터에서 a파와 b파 진폭의 정의
Q: Cyagen 안질환 모델의 ERG 데이터는 어떤가요?
A: Cyagen의 RD1(C001277 및 C001384), RD2(C001385), RD10(C001277), Tub-KO(C001386), Rpe65 R44X(C001360), Rpe65-KO(C001387)와 같은 마우스는 모두 색소성 망막염(RP) 관련 질병 모델이며 문헌 보고에 따르면 임상적으로 대부분의 RP 질병 ERG는 Scotopic ERG가 현저히 감소하는 것으로 나타났습니다[2]. 현재 검증 데이터는 위에서 언급한 모델 모두 Scotopic ERG의 현저한 감소 또는 소멸 표현형을 가지고 있음을 보여줍니다.
Q: RD1 마우스는 조기 발병이고 RD2 마우스는 후기 발병입니다. 조기 발병과 후기 발병의 정의는 무엇인가요?
A: 조기 발병 질환은 발병 연령으로 정의되며 후기 발병 질환은 질병 진행 시간에 따라 정의됩니다. RD1 마우스는 2주령에 ERG 파형이 소실된 심각한 망막병증이 발생했습니다. RD2 마우스는 9개월령에 외핵층의 소실이 관찰되었고 ERG 파형은 12개월령에 완전히 소멸되었습니다. RD1 마우스의 3주령 검사 데이터는 생쥐(눈 뜬지 약 14일)의 경우 이미 조기에 검출되었으므로 RD1이 조기 발병이란 것을 말해줍니다.
RD2 마우스의 질병 진행은 매우 느리며 11주령에 RD1에 비해 표현형의 중증도가 훨씬 낮았으므로 RD2이 후기 발병임을 말해줍니다.
Q: 후기 발병은 발병이 늦게 시작되는가요 아니면 병변이 일정 수준에 도달하는 주기가 길거나 병변 수준이 낮은가요?
A: 후기 발병은 장기간에 걸친 심각한 망막병증을 말합니다. 물론 병변이 짧은 기간 동안 천천히 진행되고 어린 나이에 덜 심하다는 의미로도 이해할 수 있습니다.
Q: C001277과 C001384 두 RD1 마우스의 차이점은 무엇인가요?
A: C001277은 마우스 Pde6b 유전자의 RD1 자발적 돌연변이를 가지고 있습니다[3]. Pde6b 유전자는 시각 신호 전달에 매우 중요한 유전자로, 이 돌연변이는 마우스에서 조기에 심각한 망막 변성을 유발할 수 있습니다. 간상세포 광수용체는 3주 이내에 급속히 사멸하고 외핵층이 사라지는데 ERG 검출 결과 시각 기능이 완전히 상실되었습니다. C001384는 Pde6b 유전자 녹아웃(Pde6b-KO) 모델로, Pde6b 녹아웃은 단백질 발현의 소실을 초래합니다. 마우스도 간상세포 광수용체 사멸, 외핵층 소실 및 ERG 파형 소실의 심각한 표현형으로 나타나며 질병 표현형의 진행 및 중증도는 C001277과 유사합니다. 두 모델 마우스의 유전자 변형 방법, 표현형 출현 시간 및 정도에는 일정한 차이가 있으며 이는 실험 설계와 약물 효능 평가의 특정 요구 사항과 일치해야 합니다.
Q: Tub-KO (C001386)와 Tubby 마우스의 차이점은 무엇인가요?
A:Tub-KO 마우스는 Tub 유전자 녹아웃 모델이고 Tubby 마우스는 유전자 자발적 돌연변이를 지닌 모델입니다[4]. 두 모델 모두 Tub 유전자의 비정상적 발현으로 인한 단백질 기능 장애로 인해 망막 광수용체의 이상을 일으켜 망막 질병을 유발했습니다. Stubdal 등이 Tub 유전자를 녹아웃시켜 만든 Tub-KO 마우스는 Tubby 마우스와 거의 일치하는 질병 표현형을 가지고 있습니다[5]. 현재 검증 데이터는 싸이언에서 Tub-KO 마우스와 Tubby 마우스의 망막 표현형이 거의 동일함을 보여줍니다.
Q: Rpe65 R44X (C001360)와 Rpe65-KO (C001387) 마우스의 차이점은 무엇인가요?
A:두 RD1 마우스의 차이점과 유사하게 Rpe65-KO 마우스와 Rpe65R44X 마우스는 각각 유전자 녹아웃 모델과 자발 돌연변이를 보유한 모델입니다. RPE65 단백질은 시각 주기에서 중요한 역할을 하며 망막에서 광신호를 변환하고 전달하는 핵심분자입니다. Rpe65 유전자의 자발적 돌연변이를 가진 Rpe65 R44X 마우스는 시각 주기 과정에 파괴되고 신경망막과 RPE 세포가 더욱 퇴화되어 결국 돌이킬 수 없는 실명을 일으킵니다[6]. Rpe65-KO 마우스는 Pde6b 유전자 녹아웃 모델입니다. Rpe65 녹아웃은 단백질 발현 소실로 이어져 RPE 세포 기능 파괴, 광수용체 세포의 세포 사멸, 간상세포 외절 막 배열 장애, 간상세포 파형의 소실을 일으켜 심각한 망막 변성을 초래합니다.
참고 문헌:
1.Ruggeri M, Tsechpenakis G, Jiao S, Jockovich ME, Cebulla C, Hernandez E, Murray TG, Puliafito CA. Retinal tumor imaging and volume quantification in mouse model using spectral-domain optical coherence tomography. Opt Express. 2009 Mar 2;17(5):4074-83.
2.Hassan-Karimi H, Jafarzadehpur E, Blouri B, Hashemi H, Sadeghi AZ, Mirzajani A. Frequency Domain Electroretinography in Retinitis Pigmentosa versus Normal Eyes. J Ophthalmic Vis Res. 2012 Jan;7(1):34-8.
3.Chang B, Hawes NL, Pardue MT, German AM, Hurd RE, Davisson MT, Nusinowitz S, Rengarajan K, Boyd AP, Sidney SS, Phillips MJ, Stewart RE, Chaudhury R, Nickerson JM, Heckenlively JR, Boatright JH. Two mouse retinal degenerations caused by missense mutations in the beta-subunit of rod cGMP phosphodiesterase gene. Vision Res. 2007 Mar;47(5):624-33.
4.Coleman DL, Eicher EM. Fat (fat) and tubby (tub): two autosomal recessive mutations causing obesity syndromes in the mouse. J Hered. 1990 Nov-Dec;81(6):424-7.
5.Stubdal H, Lynch CA, Moriarty A, Fang Q, Chickering T, Deeds JD, Fairchild-Huntress V, Charlat O, Dunmore JH, Kleyn P, Huszar D, Kapeller R. Targeted deletion of the tub mouse obesity gene reveals that tubby is a loss-of-function mutation. Mol Cell Biol. 2000 Feb;20(3):878-82.




영업일 기준 1-2일 내에 답변해 드리겠습니다.