

파킨슨병 연구를 위한 PARK2-KO-iPSC 모델 구축
파킨슨병(PD) 은 흑질 치밀층(SNc)에서 중뇌 도파민 신경세포의 점진적 손실을 특징으로 하는 불치의 신경퇴행성 질환으로, 차후 선조체 도파민의 고갈을 초래한다. 산발성 및 가족성 PD의 메커니즘은 주로 미토콘드리아 기능 장애와 산화 스트레스로 인한 것이다. PARK2 유전자(미토콘드리아 기능에 중요한 영향 미침)의 돌연변이는 상염색체 우성 가족성 파킨슨병을 유발할 수 있다.
PD의 메커니즘에 대한 연구에서는 가벼운 질병 표현형만을 보이는 파킨슨병의 유전자 녹아웃 동물 모델을 사용했다. 가족성 PD 환자의 유도만능 줄기세포(iPSCs) 또는 게놈 편집으로 도입된 PARK2 돌연변이를 가진 세포는 체외에서 도파민 뉴런의 파킨슨병 기능 장애를 연구하는 데 사용할 수 있다. PARK2 돌연변이를 가진 PD 환자 iPSC 유래 뉴런은 증가된 산화 스트레스, 알파-시누클레인 축적, 불규칙한 미토콘드리아 형태 및 기능 장애를 보여준다.
저자는 WT-iPSCs를 기반으로 PARK2를 제거하여 PARK2-KO-iPSC를 생성한 다음 WT-iPSCs와 PARK2-KO-iPSCs를 도파민 뉴런으로 분화시켰다. 두 iPSCs의 단백질 변화 경로 분석은 PARK2 KO 뉴런이 세포 주기와 산화 스트레스, 에너지 대사의 조절을 방해했다는 것을 보여주었다. 또한 다양한 실험에서 PARK2-KO 뉴런의 미토콘드리아 형태가 비정상적이고 당분해 및 젖산 대사가 불충분하며 세포 증식 및 생존율이 감소하는 것으로 나타났다. [1]
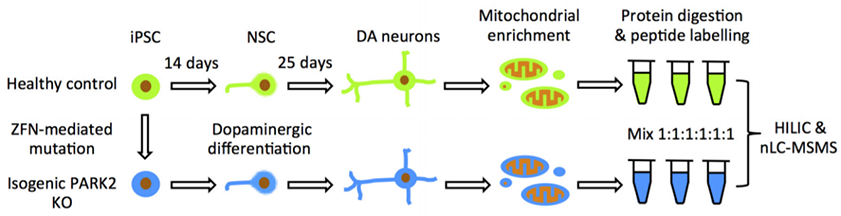
그림 1. 두 iPSCs의 단백질 변화 경로 분석 결과 PARK2 KO 뉴런이 세포 주기와 산화 스트레스, 에너지 대사의 조절을 방해하는 것으로 나타났다. [1]
심근경색의 줄기세포 치료: CCND2의 과발현은 hiPSCs에서 유래된 심장 근육 세포의 증식 능력을 향상시킬 수 있다.
최근 수십 년 동안 울혈성 심부전(CHF) 말기 치료가 많이 개선되었지만 여전히 심장 근육 세포의 재생 능력으로 인해 성공 여부가 제한되고 있다. 진행성 심부전의 분자 및 세포 기반은 손상되고 죽어가는 심장 근육 세포를 대체할 수 없다. 심장 근육 재생을 촉진하기 위한 치료에는 상주한 심장 섬유아세포를 심장 근육 세포와 유사한 세포로 재프로그래밍, 신체 줄기 세포에서 유래한 줄기세포/간세포 이식, 내인성 줄기세포를 모집하거나 내인성 심장 근육 세포의 세포 주기 활동 및 증식을 촉진하는 것을 목표로 하는 치료가 포함된다.
일전에 저자는 CCND2의 과발현이 hiPSCs에서 유래된 심장 근육 세포의 증식을 향상시킬 수 있음을 입증했다. 그런 다음 저자는 WT-CCND2 또는 OE-CCND2로 인간의 유도만능 줄기세포(hiPSCs)를 심장 근육 세포(CCND2WT-CMs 또는 CCND2OE-CMs)로 분화시키고 이를 심근경색이 일어난 돼지 심장에 이식했다. 심장 근육 기능, 심장 근육 세포 증식, 병변 부위의 혈관 신생, 심장 근육 세포 산소 내성을 평가함으로써 저자는 야생형(WT) CCND2 심장 근육 세포에 비해 CCND2 심장 근육 세포의 과발현(OE)이 더 강력한 증식 및 심장 회복 능력과 경색 부위의 크기 감소 및 심장 기능 개선을 가지고 있어 좋은 치료 효과를 보인다는 것을 발견했다. [2]
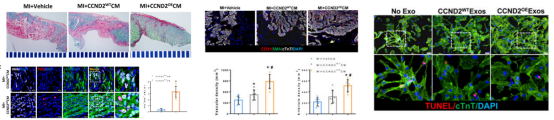
그림 2. CCND2의 과발현은 hiPSCs에서 유래된 심장 근육 세포의 증식 능력을 향상시킬 수 있다. [2]
동종이형 줄기세포 면역요법: iPSCs는 체외에서 무한정 배양할 수 있으며 유도 효율이 높은 림프계로 성공적으로 분화할 수 있다.
입양 세포 치료는 면역 세포를 분리한 후 체외(ex vivo) 조작을 하고 치료적 개입으로 환자에게 전달하는 방식을 말한다. 관심 분야는 키메라 항원 수용체(CARs) 사용을 포함하여 혈액 및 종양 질환의 치료를 위한 세포 또는 면역 요법을 탐구하는 것이다. 범용(동종) 세포 면역 요법 접근법에는 모든 환자들을 치료하는 데 사용할 수 있는 CAR-T와 TCR-T , NK 세포가 포함된다. 이러한 요법은 광범위한 응용 전망과 치료 효과를 가지고 있지만 몇 가지 문제에도 직면해 있다. 그러나 iPSCs와 유전자 편집을 결합하면 이런 문제들 중 일부를 해결할 수 있다.
CAR-T 요법의 치료 원리는 종양 세포의 표면 항원과 일치하는 T 세포 표면에 CAR 분자를 발현시켜 종양 세포를 특이적으로 죽이는 것이다. CAR-T 요법은 일반적으로 환자의 T세포를 이용해 편집 및 형질전환되지만 환자의 T세포 확장 및 기능 제한, T세포 편집의 어려움, CAR-T세포 준비에 많은 시간이 소요되는 등의 문제들이 있어 환자의 치료가 지연된다. NK요법의 원리는 자가면역이나 동종면역 이펙터 세포를 분리해 체외에서 활성화한 다음 환자에게 주입하여 종양을 직접 죽이거나 숙주의 항종양 면역반응을 자극하는 CAR-T요법과 유사하다. 그러나 NK 세포는 제한된 증식 능력을 제공하며 유전자 변형이 어렵다.
iPSCs와 당사의 유전자 편집 기술을 결합하면 이러한 문제를 해결할 수 있으므로 iPSCs는 체외에서 유전적으로 쉽게 변형될 수 있다. 면역과 관련된 인간 백혈구 항원(HLA) 및 T 세포 수용체(TCR) 유전자를 편집함으로써 범용 CAR-T 세포의 개발은 면역원성을 효과적으로 줄이고 적용성과 효율성, 내구성을 높일 수 있다. iPSCs는 체외에서 무한정 배양되어 림프성 세포로 성공적으로 분화될 수 있어 제한된 수의 기본 세포와 확장에서 나서는 문제들을 해결한다. iPSCs를 NK세포로 유도하는 성공률은 높고 기능적 표현형이 성숙하다. [3]
알츠하이머병 약물 검사: Aβ42-OE-iPSCs의 확립은 Aβ42 억제제를 검사하는 데 사용할 수 있다.
알츠하이머병(AD) 은 점진적 인식 및 행동 장애를 특징으로 하는 중추 신경계의 퇴행성 질환으로, 일반적으로 노년기에 발생한다. 현재 베타 아밀로이드 단백질(Aβ42)이 뇌에 과도하게 축적된 것을 질병의 원인으로 보고 있다. Aβ42를 억제하는 약물을 선별하려면 Aβ42-OE-iPSCs(Aβ42를 과발현하는 유도만능 줄기세포)를 구축하고 이를 신경세포로 분화해야 한다. 그리고 고처리량 스크리닝을 수행하여 Aβ42의 효과적인 억제제를 식별할 수 있다.
참고 문헌:
[1]Bogetofte H, Jensen P, Ryding M, et al. PARK2 Mutation Causes Metabolic Disturbances and Impaired Survival of Human iPSC-Derived Neurons. Front Cell Neurosci. 2019;13:297. Published 2019 Jul 5. doi:10.3389/fncel.2019.00297
[2]Zhao M, Nakada Y, Wei Y, et al. Cyclin D2 Overexpression Enhances the Efficacy of Human Induced Pluripotent Stem Cell-Derived Cardiomyocytes for Myocardial Repair in a Swine Model of Myocardial Infarction. Circulation. 2021;144(3):210-228. doi:10.1161/CIRCULATIONAHA.120.049497
[3]Nianias A, Themeli M. Induced Pluripotent Stem Cell (iPSC)-Derived Lymphocytes for Adoptive Cell Immunotherapy: Recent Advances and Challenges. Curr Hematol Malig Rep. 2019;14(4):261-268. doi:10.1007/s11899-019-00528-6




영업일 기준 1-2일 내에 답변해 드리겠습니다.