

만성 췌장염(Chronic Pancreatitis, CP)은 흔하지만 치료가 어려운 질환으로 점진적이고 돌이킬 수 없는 췌장의 형태학적 변화가 특징인 연속적 또는 재발성 염증성 췌장질환이다. 국내외의 많은 학자들이 이 질병의 진단, 치료 및 발병 메커니즘에 대한 많은 연구를 해왔다.
이전의 연구에 따르면, 소화 프로테아제 또는 이들의 억제제를 암호화하는 유전자의 돌연변이는 종종 급성 췌장염의 발병을 촉진시키고 점차 만성 췌장염으로 발전한다. 예를 들어, PRSS1 (cationic trypsinogen), CTRC (chymotrypsin C) 및 SPINK1 (Kazal-type serine protease inhibitor 1)의 병원성 돌연변이는 자발적 활성화를 자극하거나 보호 메커니즘을 방해하여, 트립시노겐(trypsinogen)의 유해한 트립신(trypsin)으로 전환을 촉진한다. 또한 만성 췌장염의 유전적 위험도 트립신 활성과 관련이 없는 메커니즘에 의해 매개될 수 있다. 예를 들어 일부 PRSS1 돌연변이는 트립신 활성에 영향을 미치지 않지만 효소의 misfolding을 유발하여 소포체 스트레스(endoplasmic reticulum stress, ER stress)를 일으킬 수 있다. 마찬가지로 CPA1 (carboxypeptidase A1) 돌연변이는 또한 in vitro에서 효소의 misfolding을 유발하여, CPA1 세포의 retention 및 degradation, 그리고 관련된 소포체 스트레스를 초래한다.
In vitro에서 관찰된 결과, 유전자 돌연변이에 의한 췌장 내 트립시노겐의 자발적 활성화가 직접적으로 병을 유발하는 역할을 하고, 돌연변이에 의해 유도된 misfolding 및 소포체 스트레스를 일으키는 것을 보여주었지만, 적합한 동물 모델에 대한 증거가 부족하다. 이것은 질병 메커니즘에 대한 연구자의 이해를 제한하고, 새로운 치료법의 전임상 시험을 방해한다. 다음으로, 여러분의 연구에 대한 참고 자료를 제공하기 위해 만성 췌장염에 대해 최근에 보도된 세 가지 동물 모델을 소개해 드리고자 한다.
Spink1 유전자는 만성 췌장염(이하 CP)의 중요한 병원성 인자이며, SPINK1 c.194 + 2T> C 돌연변이는 중국 CP 환자에서 가장 흔한 돌연변이이다. 현재까지, 유일한 in vivo 연구는 Homozygous Spink1(SpinK3이라고도 함) Knock-out 마우스의 표현형에 초점을 맞추었으며, 마우스가 생후 15 일 이내에 광범위한 자가 포식성 선포세포 사망으로 사망한 것으로 밝혀졌다. 중국 CP 환자의 80% 이상이 SPINK1 c.194 + 2t> c 변이체의 heterozygous 돌연변이를 가지고 있기 때문에, 연구자들은 CRISPR/Cas 유전자 편집 기술을 이용하여 spink1 돌연변이 마우스(spink1 -/- 및 spink1 +/-)를 만들었는데, 이전 보도된 것과 일치하게, spink1 -/- 마우스는 태어난 지 얼마 되지 않아 사망했다. Cerulein 치료를 동시에 받은 spink1 +/+ 및 spink1 +/- 마우스는 9주차에 모두 선포 위축 및 염증세포 침윤이 나타난다(그림 1). 여기서 주목해야 할 점은 9주 동안 cerulein으로 처리된 spink1 +/- 마우스는 CP와 유사한 증상이 나타났다는 것이다. 또한, spink1 +/- 마우스는 자연 상태에서 13주에 췌장 섬유증 및 성상세포 활성화와 같은 병리학적 변화를 보였다. 이 연구는 생체 내 heterozygous Spink1 c.194+2T>C 돌연변이의 병원성을 입증하였고, 이러한 돌연변이가 다른 인자의 협력없이 CP로 직접 이어진다는 것을 처음으로 발견했다.
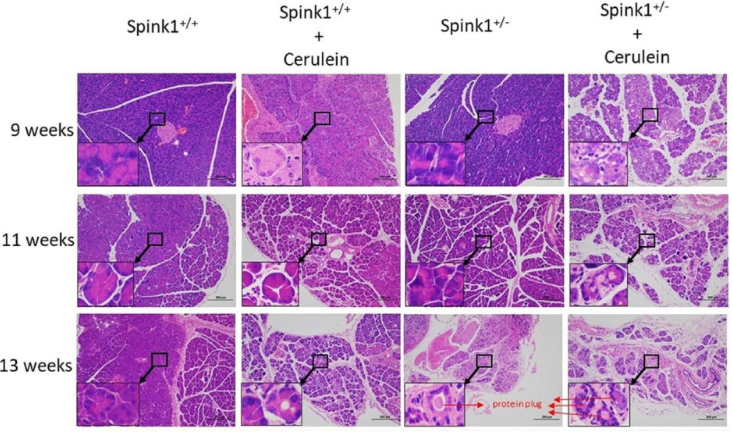
그림 1- SPINK1 +/- 마우스의 연령별 단계 췌장 형태의 변화(각 사진의 왼쪽 하단에 전형적인 변화가 표시되고 닫힘 화살표는 단백질 플러그(protein plug)의 형성을 나타냄)
(Sun C, Liu M, An W, et al, 2019)
그럼에도 불구하고 연구원들은 모든 마우스가 13주에 전형적인 만성 췌장염 증상을 보이는 것은 아니라는 점에 주목하고 있다. 이러한 상황의 원인은 heterozygous Spink1 c.194+2T>C 돌연변이 마우스의 부분 침투 및 관찰 시간의 부족일 수 있다. 그러나, 만성 췌장염의 발병 메커니즘 및 잠재적 치료 표적의 추가 검토에 있어서 heterozygous Spink1 c.194+2T>C 돌연변이 마우스는 여전히 이상적인 동물 모델이다. 또한 단백질 플러그의 존재는 이 마우스 모델이 만성 췌장염에서 췌장 석회화의 형성을 연구하는 새로운 모델이 될 수도 있다는 것을 보여준다.
연구자들은 T7, T8, T9 및 T209 subtype 등 4종의 트립시노겐이 마우스 조직에서 고도로 발현된 것을 발견했으며, 이 중 T7 subtype은 전체 트립시노겐의 40~50%를 차지한다. 연구자들은 T7 subtype 트립신의 자발적인 활성화를 촉진함으로써 만성 췌장염 동물 모델을 제작하려고 했다. T7D23A Knock-In 미우스를 제작하기 위해, 연구자들은 활성화 펩타이드에 Asp23(p.D23A)대신 Ala 돌연변이를 도입하였다. 이 제작된 마우스의 췌장 형태는 2-3 주에는 정상이었지만, 마우스의 절반 이상이 4-5 주에 췌장에서 현저한 변화를 가졌다. 구체적으로는 췌관 확장 및 확산 간질성 섬유증으로 나타날 뿐만 아니라, 염증세포 침윤이 많이 동반되어 있으며, 소엽의 중심 국소 괴사가 나타나는 만성 췌장염과 유사한 증상으로 나타난다.(그림 2 참조)
그림 2- T7D23A Knock-In 마우스의 병리학적 변화
(Geisz, A., Sahin-Tóth, M.,2018)
아밀라아제는 급성 췌장염 진단에 가장 자주 사용되는 지표이다. 따라서 연구자들은 각 연령대의 T7D23A 마우스의 혈장에서 아밀라아제 활성을 측정해 췌장에서 트립신의 활성화가 질병 과정 전반에 걸쳐 지속된다는 사실을 밝혀냈다. 트립시노겐의 자발적 활성화와 관련이 없는 질병 메커니즘을 배제하기 위해, 연구자들은 또한 p.D23A, K24G 이중 돌연변이 마우스를 제작했으며, 트립시노겐의 misfolding과 같은 메커니즘이 T7D23A 마우스 표현형의 변화를 일으키지 않는다는 것을 발견했다.
마지막으로, 연구자들은 T7D23A 마우스의 특징을 인간 췌장염과 비교했다. 이 새로운 모델은 인간 췌장염의 임상 질환의 특징을 나타낸 것으로, 항상 먼저 급성 췌장염으로 발전한 다음 돌이킬 수없는 만성 췌장염으로 발전한다. 요컨대, 그들은 췌장에서 트립시노겐의 자발적 활성화의 증가에 의해 유발되는 만성 췌장염의 최초 전임상 마우스 모델을 보여 주었다. 이 모델은 인간 만성 췌장염의 현저한 특징을 요약한다.
PRSS1 돌연변이는 트립신 활성에 영향을 미치지 않지만 효소의 misfolding을 유발하여 소포체 스트레스(endoplasmic reticulum stress, ER stress)를 일으킬 수 있다. 마찬가지로 CPA1(carboxypeptidase A1) 돌연변이는 또한 in vitro에서 효소의 misfolding을 유발하여, CPA1 세포의 retention 및 degradation, 그리고 관련된 소포체 스트레스를 초래하며 이는 만성 췌장염의 발병에 관여 할 수 있다. 연구자들은 마우스 Cpa1 gene locus에 인간 CPA1 돌연변이 p.N256K를 삽입함으로써 CPA1 N256K 마우스를 얻었다. 이와 동시에, 연구자들은 CPA1 단백질 활성의 손실 또는 CPA1 misfolding을 구별하기 위한 대조로 CPA1 null strain을 제작하였다. 그 결과 CPA1 N256K 마우스가 정상적으로 발달하고 번식할 수 있는 것으로 나타났으나 생후 3개월부터 췌장이 작고, 선포세포 위축 및 염증세포 침윤 등과 같은 만성 췌장염의 전형적인 병리학적 특징이 관찰되었다.
마지막으로, CPA1 N256K strain의 조직학적 변화가 소포체 스트레스 마커 상승과 관련이 있는지 확인하기 위해, 연구자들은 각각 1월령, 3월령, 12월령 마우스의 샤페로닌 Hspa5(BiP)와 전사 인자 Ddit3(CHOP)를 측정하였다. 일련의 실험들은 CPA1 돌연변이 p.N256K에 의해 효소가 misfolding 발생하여 만성 췌장염을 유발하면서 소포체 스트레스와 관련된 pro-apoptotic 전사 인자 CHOP의 상향 조절을 수반하는 것을 보여 주었다. CPA1 null 마우스에서 이러한 병리현상이 관찰되지 않았으며, 이는 CPA1 기능상실 자체가 선포세포 손상을 일으키지 않음을 나타낸다.
요컨대, 이것은 소화 효소의 misfolding 및 소포체 스트레스와 관련된 만성 췌장염의 첫 마우스 모델로, 다양한 환경 요인(예: 알코올, 흡연, 고지방 식이) 또는 약물이 만성 췌장염의 발생 및 발전에 미치는 영향을 테스트하는 데 특히 적합하다.
이 글에서 언급한 세 가지 만성 췌장염 동물 모델: Spink1C.194+2T>C 돌연변이 마우스, T7D23A Knock-In 마우스 및 CPA1 N256K 점 돌연변이 마우스는 모두 Cyagen에 의해 제작되었다. 이러한 동물 모델의 출현은 췌장염의 연구 및 치료에 대한 뛰어난 모델뿐만 아니라 새로운 연구 아이디어를 제공했다. In vitro 실험에서 이미 결론이 났지만 생체실험으로 아직 증명되지 않은 일부의 유전자 변이 질병의 경우, 변이를 가진 마우스 모델을 이용하여 in vivo 연구를 진행하는 것이 실현 가능한 방법이다.
Cyagen의 AI Knock-Out Mouse Model eBank에서는 Nlrp, Mettl, Nrf, Sirt, Tlr, Pten, Fto, Dexi 등과 같은 인기있는 유전자의 90%를 포괄하는 16,000 strains 이상의 KO/cKO 마우스 모델을 보유하고 있으며 고객님들의 연구 진행에 도움이 되도록 최적의 마우스 모델을 제공합니다. 관심이 있으시거나 문의 사항이 있으시면 86 20-31601779 또는 이메일 service-apac@cyagen.com으로 연락 부탁드립니다.
| 제품/서비스 | 상세 내역 | 제작 기간 | 가격 (USD/Strain) |
| Live Knock-Out 마우스 | 수컷과 암컷 각 한마리 | As fast as 2 weeks | $2,599 |
| Live Knock-Out 마우스 | 수컷과 암컷 각 두마리 | As fast as 2 weeks | $3,599 |
| Knock-Out 마우스 (Cryopreserved Sperms) | ≥3 마리 | As fast as 7 weeks | $5,999 |
| Conditional Knock-Out 마우스 (Cryopreserved Sperms) | ≥3 마리 | As fast as 7 weeks | $12,000 |
Mouse 및 Rat Model 제작 분야의 세계적인 선도 기업으로써, Cyagen은 14년 동안 전세계 연구자들에게 50,000개 이상의 맞춤형 동물 모델을 제공해 왔으며 Cyagen의 제품 및 기술은 Cell, Nature, Science 등과 같은 유명한 학술지 저널에서 발표된 3,600건 이상의 논문에 인용되었다. 또한 AI Knock-Out Mouse Model eBank의 출시로, Cyagen은 맞춤형 동물 모델 제작을 넘어, 더 많은 연구기관과 제약 회사에 최고 품질의 포괄적인 제품을 제공하기 위해, 서비스 범위를 지속적으로 확장하는 데 주력하고 있다.
참고문헌:
1. HeterozygousSpink1 c.194+2T>C mutant mice spontaneously develop chronic pancreatitis,Gut 2019;0:1–2. doi:10.1136/gutjnl-2019-318790
2. AndreaGeisz& Miklós Sahin-Tóth ,A preclinical model of chronicpancreatitis driven by trypsinogen autoactivation,DOI: 10.1038/s41467-018-07347-y
3. Human CPA1 mutation causesdigestive enzyme misfolding and chronic pancreatitis in mice,Gut 2018;0:1–12. doi:10.1136/gutjnl-2018-315994




영업일 기준 1-2일 내에 답변해 드리겠습니다.