


렌티바이러스 벡터(Lentivirus,LV)는 세포와 유전자 요법에 상용되는 이송 벡터 중 하나이다. 그 주요 기능은 목적 유전자를 숙주 세포의 유전체 속에 전이하고 통합하는 것이다. 유전자 수준에서의 생물학적 조절 메커니즘을 연구하는 데 사용할 수 있다.숙주 범위가 매우 넓은 바이러스 벡터로 분열과 비분열 세포,예를 들어 뉴런,조혈모세포,면역세포,특히 T세포를 전도할 수 있다. 최근 몇 년 동안 렌티 바이러스 전도 기술은 이미 CAR-T 세포의 제조에 성공적으로 적용되었다.본고에서는 여러분들에게 슬로우 바이러스 벡터체제에 준비된 기초 지식과 응용들을 소개할 것이다.
HIV 에서 렌티 바이러스 다중 플라스미드 시스템에 이르기까지
렌티 바이러스 벡터체계가 인간면역결핍Ⅰ형(HIV-1) 바이러스를 기반으로 개조된 것으로 충분히 연구된 인간병원체 바이러스다.현재 과학연구 및 임상연구에 널리 사용되고 있는 렌티바이러스 4질립자 패키지시스템은 3세대 렌티바이러스 패키지시스템으로 목적 유전자를 포함하는 표현질립자 1개, 패키지질립자 2개, envelope plasmid1개로 이루어져 있다.
패키지 플라스미드에는 패키지, 역전사 및 통합에 필요한 순식서열(RRE,ψ, LTRs) 및 목적유전자 또는 표시유전자(녹색형광단백질 GFP)가 포함되어 있다.이 중 1개의 패키지질 입자는 Gag와 Pol 유전자를 포함하고 있으며, Gag 부호화 핵심단백질(기질단백질, capsid protein, nucleocapsid protein), Pol 유전자 부호화 전구체단백질은 절단되어 Reverse transcripatse,통합효소,단백질분해효소(protease)가 형성되고,다른 1개의 패키지질 입자는 REV 유전자를 포함하고 있으며,그 부호화된 Rev 단백질은 렌티바이러스 게놈의 RRE와 결합하여 유전체 mRNA를 세포핵에서 세포질로 운반한다.
envelope plasmid은 원래 바이러스의 env 유전자를 대체하기 위해 Vesicular stomatitis virus당단백질 G 유전자(VSV-G)를 사용하며,VSV-G envelope을 응용한 pseudotype Lentivirus 벡터는 벡터의 표적세포 기호범위를 넓히면서 벡터의 안정성을 증가시킨다.
유전체 mRNA는 capsid protein, envelope protein등과 pseudovirion로 조립된다. Four plasmids 패키지 시스템은 복제 능력이 있는 렌티바이러스가 생길 가능성을 크게 낮췄고, VSV-G 단백질의 사용도 이런 재조합 가능성을 낮췄다.
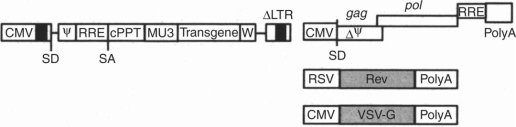
그림1. 3세대 렌티 바이러스의 4플라스미드 시스템 [1]
렌티 바이러스는 일종의 연구 도구
렌티 바이러스 벡터를 이용해 특정 유전자를 안정적으로 표현하거나 작동자의 조절 메커니즘을 연구하거나 RNA 교란 기술을 이용해 특정 유전자의 표현을 침묵시킬 수 있다.렌티 바이러스 표현 벡터는 패키지,트랜스펙션,안정적 통합에 필요한 유전 정보를 담고 있다.트랜스펙션 세포의 효율을 높이기 위해서는 고 역가의 바이러스 입자를 얻어야 하는데,이는 패키지용 세포 상태,목적 유전자의 크기, 플라스미드의 질과 수독 시기와 관련이 있다.패키지된 바이러스 입자는 세포 바깥의 배양기 속으로 분비된다. 원심분비는 상청액을 얻으면 숙주세포의 감염에 직접 사용될 수 있다. 목적 유전자는 숙주세포에 전달된 후 역전을 거쳐 숙주세포 게놈에 통합되어 높은 수준의 단백질을 나타낸다.
각각 다른 실험 목적에 따라, 해당 렌티 바이러스 벡터를 선택할 수 있다. 예를 들어 다음과 같다.
☑일반적인 기능 유전자 과표현/간섭 렌티 바이러스
☑ 비코딩 miRNA/lncRNA/circRNA 렌티 바이러스
☑ 유전자 녹아웃 렌티 바이러스
또한 다양한 프로모터,선별표기,표현 라벨,보고 유전자 등을 선택하여 개인화된 연구 요구를 충족시킬 수 있다.
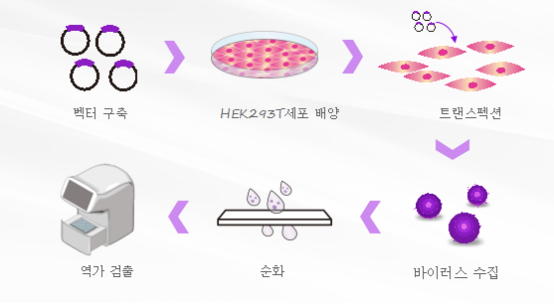
그림 2. 렌티 바이러스 패키지 기술 코스 (출처: Cyagen바이오)
응용 사례
1.렌티 바이러스 트랜스펙션 T세포
정지 상태(Resting state)는 면역체계의 독특한 특징이다. T림프구는 분열되지 않은 상태를 오래 유지할 수 있다[3].혈액 속의 대다수 순환 T세포는 정지 상태에 있다. 대사율이 낮고 전사 수준이 낮으며 크기가 작고 생존 기간이 매우 긴 것이 특징이다[4].
Zack 등의 HIV 바이러스에 대한 연구에서는 HIV 바이러스 감염 정지 상태에서의 T세포의 한계를 상세히 설명하고 있다[3].우선 정지 T세포에서 HIV의 사전정합이 억제되고 활성화된 T세포에 비해 바이러스의 감염능력은 변하지 않지만 역전사는 느린 속도, 바이러스 cDNA 불안정 등 현저한 차이가 있다.둘째,정지 T세포에서 HIV 표현 결함은 LTR 결함, 유전자 통합 전사 억제 영역으로 나타났다.
이미 여러 연구에서 친본 바이러스 HIV-1 및 그 파생 벡터를 포함한 바이러스 시스템은 정지 상태의 T 림프구에 들어갈 수 있지만 복제는 하지 않다[5].주로 다음과 같은 여러 종류가 포함되어 있다.
1. 역전사의 시작과 완료 과정에서의 결함
2. ATP 의존적 핵 입력 부족
3. 초기 바이러스 게놈의 통합 결여
HIV 기반 렌티 바이러스 운반체계가 정식 T세포에 통합된 트랜스펙션은 여전히 어렵다.따라서 트랜스펙션(transfection)을 하기 전에 T세포의 활성화가 필요한다.예를 들어, T세포 수용체와 CD28 공자극 수용체의 자극을 통해 항CD3, 항CD28 항체를 사용하여 정지 T세포가 세포주기의 G1b기로 들어가도록 유도한다.세포를 HIV-1 에 쉽게 감염시키고 복제할 수 있다 [6].또는 T 세포를 세포 분열을 트리거하지 않는 세포인자에 노출시키면 HIV-1 벡터가 형질도입을 완성할 수 있다[7].
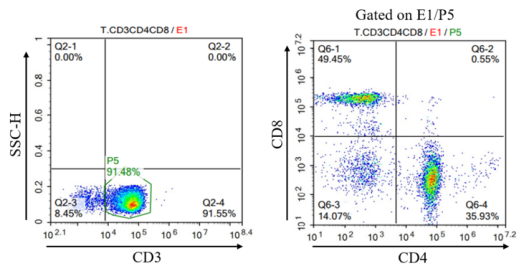
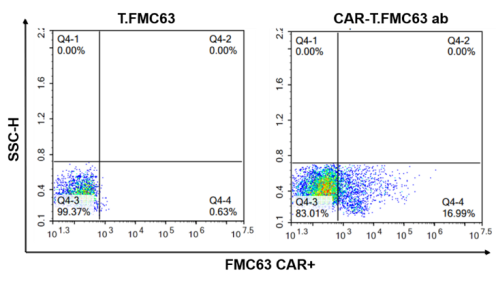
그림 3. Cyagen 바이오 렌티 바이러스의 T세포 트랜스펙션 사례. 위: PBMC 활성화 증폭 10일째 T세포 비중 및 표형 분석 실험 결과. 아래: FMC63 CAR-T 세포 CAR 양성률 검사 결과.
2. 렌티 바이러스 감염 RPE 세포
Leber 선천성 흑내장(LCA16)은 유전성 소아과의 실명으로 KCNJ13 유전자의 병원성 변이에 의해 발생한다.KCNJ13 유전자 부호화는 망막색소상피(RPE)에서 칼륨이온 통로를 정류하여 이온의 안정상태를 유지하고 광감지기를 시각정보 부호화할 수 있도록 하는 사합체(tetramer) 구조의 Kir7.1 서브유닛(Subunit)에 관한 것이다.
Pawan K.Shahi 등의 연구에서 KCNJ13 유전자와 Kir7.1 채널의 작용 메커니즘을 검증하였다[8] .우선,이 연구팀은 KCNJ13 유전자결함이 있는 인간유도다능줄기세포 (hiPSC)-RPE 세포를 얻어 정상 형태를 갖고 있지만 기능적인 Kir7.1 채널을 표현하지 않는 것으로 검증해 생리활성을 갖추지 못했다.연구팀은 KCNJ13 유전자가 Kir7.1아기 발현에 미치는 영향을 알아보기 위해 Cyagen 바이오포장의 렌티 바이러스 pLV-EF1α Kir7.1-GFP를 사용해 KCNJ13 유전자를 hiPSC-RPE 세포로 전달해 Kir7.1 채널 기능을 회복시키는 데 성공했다.Cyagen바이오의 3 세대 렌티 바이러스 패키지 시스템은 복제 가능한 바이러스를 생산할 위험을 줄이고, 유사분열(Mitosis)을 전도한 후 RPE 세포의 효율이 더 높다.
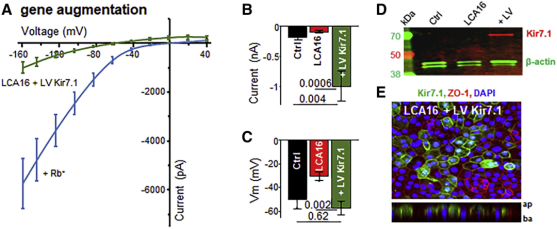
그림 4. 렌티 바이러스로 트랜스펙션시킨 후 hiPSC-RPE 세포막 전위가 정상으로 돌아간다[8]. A-C: 렌티 바이러스 전달 유전자 후 막 전위 회복; D: 면역블러팅법 분석(immunoblotting); E: 렌티 바이러스 트랜스펙션한 후 hiPSC-RPE 가 Kir7.1 (녹색) 을 성공적으로 표현했다.
Cyagen 바이오의 성숙하고 안정된 렌티 바이러스 패키지 플랫폼으로, 3세대 패키지 시스템을 채용하고 있다. 바이러스의 역가가 높고 세포 독성이 적으며 감염 효율이 높으며, 과표현, 간섭, 유전자 녹아웃 렌티 바이러스 및 각종 종양 항원에 대한 CAR 분자 설계와 CAR 바이러스 패키지 서비스를 제공할 수 있다. 또한 CAR-T 세포 치료 체내 및 체외 연구 원스톱 서비스를 제공할 수 있다.필요하시면 저희에게 문의해 주시기 바랍니다.
참고 문헌:.
[1] Merten, O. W., Hebben, M., & Bovolenta, C. (2016). Production of lentiviral vectors. Molecular Therapy-Methods & Clinical Development, 3, 16017.
[2] Gama-Norton, L., Botezatu, L., Herrmann, S., Schweizer, M., Alves, P. M., Hauser, H., & Wirth, D. (2011). Lentivirus production is influenced by SV40 large T-antigen and chromosomal integration of the vector in HEK293 cells. Human gene therapy, 22(10), 1269-1279.
[3] Zack, J. A., Kim, S. G., & Vatakis, D. N. (2013). HIV restriction in quiescent CD4+ T cells. Retrovirology, 10(1), 1-9.
[4] Yusuf, I., & Fruman, D. A. (2003). Regulation of quiescence in lymphocytes. Trends in immunology, 24(7), 380-386.
[5] Verhoeyen, E., Costa, C., & Cosset, F. L. (2009). Lentiviral vector gene transfer into human T cells. In Genetic Modification of Hematopoietic Stem Cells (pp. 97-114). Humana Press.
[6] Korin, Y. D., & Zack, J. A. (1998). Progression to the G1b phase of the cell cycle is required for completion of human immunodeficiency virus type 1 reverse transcription in T cells. Journal of virology, 72(4), 3161-3168.
[7] Unutmaz, D., KewalRamani, V. N., Marmon, S., & Littman, D. R. (1999). Cytokine signals are sufficient for HIV-1 infection of resting human T lymphocytes. The Journal of experimental medicine, 189(11), 1735-1746.
[8] Shahi, P. K., Hermans, D., Sinha, D., Brar, S., Moulton, H., Stulo, S., ... & Pattnaik, B. R. (2019). Gene augmentation and readthrough rescue channelopathy in an iPSC-RPE model of congenital blindness. The American Journal of Human Genetics, 104(2), 310-318.
If you need to read articles in English, please visit our US websites.




영업일 기준 1-2일 내에 답변해 드리겠습니다.