

감합항원수용체(CAR) T세포는 유전자 공학을 거쳐 변형된 T세포로 특정 종양표지물을 식별하기 위한 수용체를 표현하여 혈액종양에 대한 치료를 가능하게 합니다.현재 전세계적으로 이미 7종의 CAR-T 세포요법이 허가되어 있습니다.적응증은 모두 혈액종양입니다.여러 CAR-T요법의 임상시험이 진행 중입니다.그러나 CAR-T 세포요법은 생명을 위협하는 사이토카인 폭풍(CRS),신경독성,항원 뺑소니,치료효과의 지속성 등 여전히 중대한 한계를 가지고 있으며,특히 고형종 치료는 종양 미세환경 등의 요인으로 인해 아직 임상에서 획기적인 성공을 거두지 못하고 있습니다.이 글은 CAR-T 세포 요법이 실체종 치료에 존재하는 도전과 진전에 대해 논의합니다.
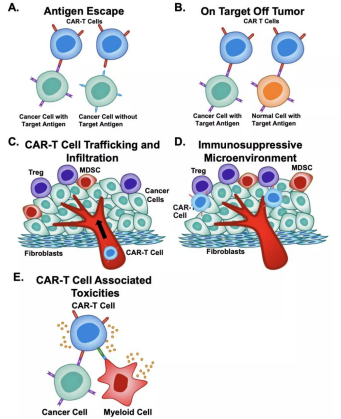
그림 1.CAR-T 세포요법의 한계[1]. A.항원 탈출(Antigen escape):B.탈표적 효과;C.CAR-T 세포 이송 및 침윤;D.면역 억제 미세 환경;E.CAR-T 세포에 관한 독성
CAR 분자 구조
CAR-T세포가 종양세포를 살상하는 원리는 1.CAR분자의 세포외항원결합역 특이성으로 종양항원을 인식합니다.2.식별 신호는 CAR 분자의 포내 도메인으로 전달됩니다.3.포내 도메인은 T세포를 활성화시켜 세포를 증식,천공소와 과립효소 합성,사이토카인 방출 등으로 종양 세포를 살상합니다.이 같은 기능을 극대화하기 위해서는 CAR 분자의 구조 설계가 필수적입니다.
CAR 분자는 4개의 주요 성분으로 구성되어 있다
1.세포외 항원 결합 도메인(domain): CAR 분자에게 표적의 특이성을 부여하는 기능.항체의 variable region of heavy chain(VH)과 variable region of light chain(VL)을 연결하여 Single chain variable segment(scFv)을 형성하여 특이적으로 종양표면 항원을 인식하는 원리입니다.
2.경첩 영역(hinge region): 막횡단영역(Transmembrane domain)과 세포외 단위를 연결하는 구조영역입니다.경첩 영역는 공간적 유연성을 제공하여 공간적 저항을 극복할 수 있고 항원 결합 영역이 목표 표위에 근접할 수 있도록 적합한 길이를 가지는 역할을 합니다[1].
3.막횡단영역(Transmembrane domain): 주요 기능은 CAR 분자를 T세포의 세포막에 닻을 맞추는 것입니다.막횡단영역은 CAR 분자의 표현 수준,안정성에 영향을 줄 수 있으며 신호전달에 작용한다는 연구결과가 있습니다[2][3][4].
4.세포내 신호전달 도메인: CAR 분자 부자극(costimulation)의 효과는 CAR 공정에서 주목되는 이슈다.1~3세대 CAR 분자의 주요 차이점은 세포 내 부자극 도메인에서 나옵니다.FDA 승인을 받은 두 가지의 가장 흔한 부자극역 CD28과 4-1BB 모두 T세포를 효율적으로 활성화시키는 효과가 있으며 T세포가 서로 다른 기능을 하도록 유도할 수 있습니다[5].
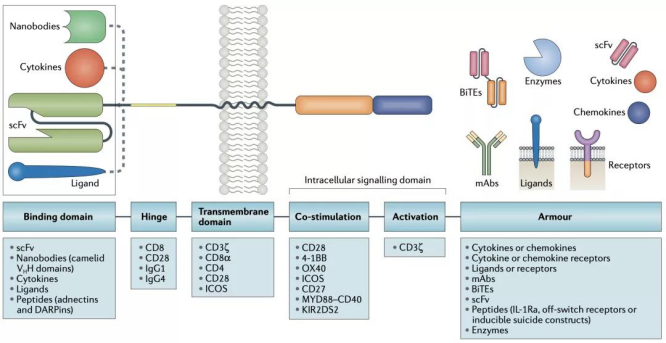
그림 2. CAR 분자 설계 비전 [20]
CAR-T 세포의 고형종 치료 도전
1.종양항원 이질성
종양항원 이질성은 CAR-T세포요법이 고형종에 대항하는 장애 중 하나입니다.종양항원은 크게 두 가지로 구분됩니다.종양관련항원(TAA)과 종양특이성항원(TSA):TAA는 종양세포에서 높게 발현되며 정상조직세포에서도 발현되지만 발현량은 낮습니다.TSA는 종양세포에서만 발현되며 정상조직세포에서는 발현되지 않으므로 가장 이상적인 항원표적점이기도 합니다.TSA의 발견과 선별이 극히 어렵기 때문에 CAR 분자가 가장 많이 사용하는 식별 표적은 TAA입니다.따라서 다른 종양 세포의 TAA에 대한 다양한 표현은 CAR-T 세포의 암세포 인식에 영향을 줄 수 있으며 CAR-T 치료의 효과를 떨어뜨릴 수 있습니다.
이미 CAR-T 세포는 단일 T 세포에 다양한 CAR 분자를 표현하고 프로그래밍 가능한 CAR 표현 조절 등 다양한 종양 관련 항원을 표적 식별할 수 있는 다양한 방법이 있습니다.두 개 이상의 항원식별구조역을 표현하여 하나의 CAR-T세포가 종양세포에 발현된 여러 개의 항원을 인식하게 함으로써 항원의 이질성에 따른 악영향을 없앨 수 있습니다.
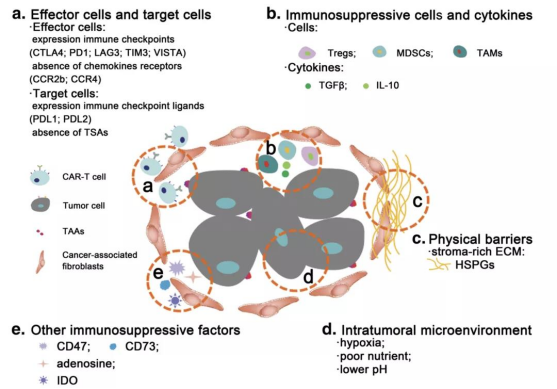
그림 3.고형종에서의 면역억제 미세환경[13].a.효과 세포 및 표적 세포;b.면역 억제 세포 및 사이토카인;c.물리 장벽;d.종양 내부 마이크로 환경;e.기타 면역 억제 요인
2.CAR-T세포의 회송과 종양조직의 침윤
CAR-T세포는 혈액과 림프계에 존재할 수 있습니다.따라서 혈액종양에 대해서는 CAR-T세포가 혈액종양세포와 접촉할 기회가 더 많습니다[1].고형종양에서는 CAR-T세포가 혈액계를 통해 종양조직을 뚫기 어렵습니다[6].또한 T세포가 종양조직에 침투하는 데 관여하는 chemokines 표현의 결여와 고형 종양에는 치밀한 섬유화 기질이 존재하기 때문에 CAR-T세포의 이동 및 종양세포 침입 능력이 저하됩니다[7].
많은 보도에서 CAR-T 세포를 직접 국소적으로 종양 위치(Tumor site)에 주입하는 방법이 있습니다.예를 들어 뇌[8],유선[9],흉막[10],간장등[11].CAR-T 세포의 국소 투여도 탈과녁 효과에 따른 위험을 낮출 수 있습니다.그러나 많은 고형종은 전이성이 있어 CAR-T 세포를 국소 투여하는 데 큰 난점입니다.한편,일부 임상 연구에서는chemokines을 사용하여 CAR-T 세포의 수송을 유도하여 종양에 대한 위치를 높입니다.예를 들어 대식세포집락자극인자 1수용체(CSF-1R)의 CAR-T세포에서의 표현은 이들 세포로 하여금 CSF-1(많은 고형 종양에서 모인 단핵세포의 chemokines)에 반응하게 합니다.CAR-T 세포 증식 신호 전도를 강화하는 동시에 세포의 살상 독성에 영향을 주지 않습니다[12].
고형 종양의 종양 미세환경은 종양의 성장과 증식을 촉진함과 동시에 CAR-T세포에 면역억제를 초래합니다.면역억제세포는 조절성 T세포(Treg),골수체 유도 억제기 셀(MDSC),종양관련 대식세포(TAM)[13]와 같이 고형 종양에서 발생하는 성장인자,국소 사이토카인,CTLA-4 및 PD-1과 같은 면역검사점 분자 등 복합환경에서의 종양 미세환경은 CAR-T세포의 치료효과를 크게 제한합니다.
Burga 등의 연구에서 유전자공학으로 생성된 Gr-1항체 소모 골수체 유도 억제기 셀(MDSC)는 마우스 실험에서 CAR-T의 종양 살상효과를 높였습니다[14].ECM 분해효소를 분비하는 CAR-T 세포를 구축해 고형종에서 물리적 장벽을 허문다는 보도도 있습니다[15].
고형 종양 진행의 CAR-T 세포 치료
최근 고형 종양 표적지점에 대한 연구가 점차 증가하기 시작하여 이미 상당부분의 연구가 임상 2상 단계에 이르렀습니다.표 1에는 흔히 볼 수 있는 고형 종양 표적 및 적응증을 열거합니다.
|
표적 |
암 |
임상 단계 |
|
Mesothelin |
난소암, 자궁경부암, 췌장암, 폐암 |
임상Ⅰ/Ⅱ단계 |
|
MUC1 |
말기 고형암, 폐암 |
임상Ⅰ/Ⅱ단계 |
|
Glypican-3 |
간암 |
임상Ⅰ단계 |
|
GD2 |
뇌암 |
임상Ⅰ/Ⅱ단계 |
|
HER2 |
중추신경계종양, 소아교종양, 유방암 |
임상Ⅰ/Ⅱ단계 |
표1. 고형 종양 흔적 표적 및 적응증(임상데이터는 ClinicalTrails.org에서 유래)
이미 난소암 표면에서 높은 발현을 보이는 종양 관련 당단백질 72(TAG72)가 CAR-T세포 치료의 표적으로 사용되고 있다는 보고가 있습니다[16].이 연구는 2세대 태그72-BBζCAR 분자를 구축한 결과 CAR-T세포가 국소복막 내 이송을 통해 효과적인 항종양 활성을 보이고 난소암 복수 마우스의 생존기간을 연장하는 것으로 나타났습니다.MUC16이나 HER2로 구축된 CAR 분자는 종양표적성을 갖고 난소암 세포의 성장과 증식을 억제한다는 연구도 있습니다.메소텔린(Mesothelin)은 세포표면 당단백질의 일종으로 다양한 암 세포에서 발현되는 것으로 증명되었습니다.
간암 치료에서 CAR-T 세포요법 연구는 이제 막 시작됐다.CAR-T세포에 기반한 암배아항원(CEA),Glypican-3,뮤신-1 등의 표적지 연구는 이미 간암 치료에서 일정한 효과를 거두고 있습니다.Glypican-3(GPC3)항체를 CAR-T요법과 병용하는 것이 간의 악성종양 치료에 효과적인 방법일 수 있습니다[21].
폐암 연구에서 Recombinant Receptor Tyrosine Kinase Like Orphan Receptor1 특이성(ROR1)-CAR-T 세포로 폐암 A549 세포계를 치료한 결과 비교적 강한 항종양 활성을 나타냈습니다[18].또한 Srivastava와 동료들은 ROR1 CAR-T 세포의 침윤성이 떨어지고 기능적인 불균형 발견 후 (Ox/Cy) 화학요법 전처리하여 CAR-T 세포의 종양으로의 이동을 개선하였습니다.이러한 방안은 항PD-L1 검사점 차단제를 배합하여 생존율을 높일 수 있습니다[19].또 CAR-T 세포를 기반으로 메소텔린,적혈구 생성소를 생산하는 간세포암 A2(EphA2), PSCA 와 mucin-1 도 폐암에 이상적인 치료 목표라는 보도가 나왔습니다.
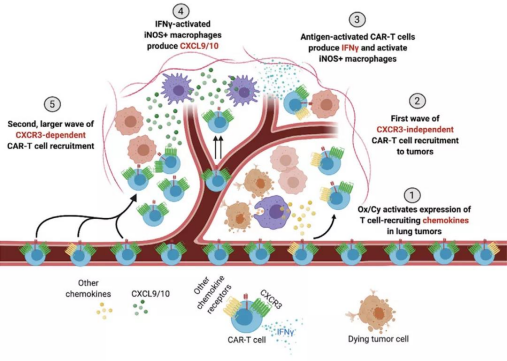
그림 5. Ox/Cy 화학요법 전처리에 의한 CAR-T 세포요법 [19]
CAR-T 세포요법은 혈액종 환자에게 희망을 주고 있으며 특히 말기 악성종양에서 좋은 전망을 갖고 있습니다.그러나 종양 미세환경의 면역 억제,물리적 장벽,항원 이질성 등이 고형종에서 CAR-T 세포의 치료 효과를 저해하고 있어 더 획기적인 진전이 필요합니다.연구자들은 이러한 도전에 대응하기 위해 이미 많은 준비와 비전 있는 작업을 하고 있습니다.참신한 아이디어와 창조적인 CAR 엔지니어링 설계가 끊임없이 반복되고,고형종 CAR-T 치료를 위한 완벽한 솔루션도 기대되고 있습니다.
Cyagen 바이오 세포 치료 원스톱 솔루션
Cyagen바이오는 다년간의 종양면역분야 연구경험에 기초하여 CAR-T 및 기타 세포치료 연구자들에게 CAR 바이러스 제조,종양면역세포 및 동물모델 구축,체내 체외 약효평가에 이르는 전 프로세스 서비스를 제공하여 CAR-T 및 세포치료 연구개발을 더욱 가속화할 수 있습니다.
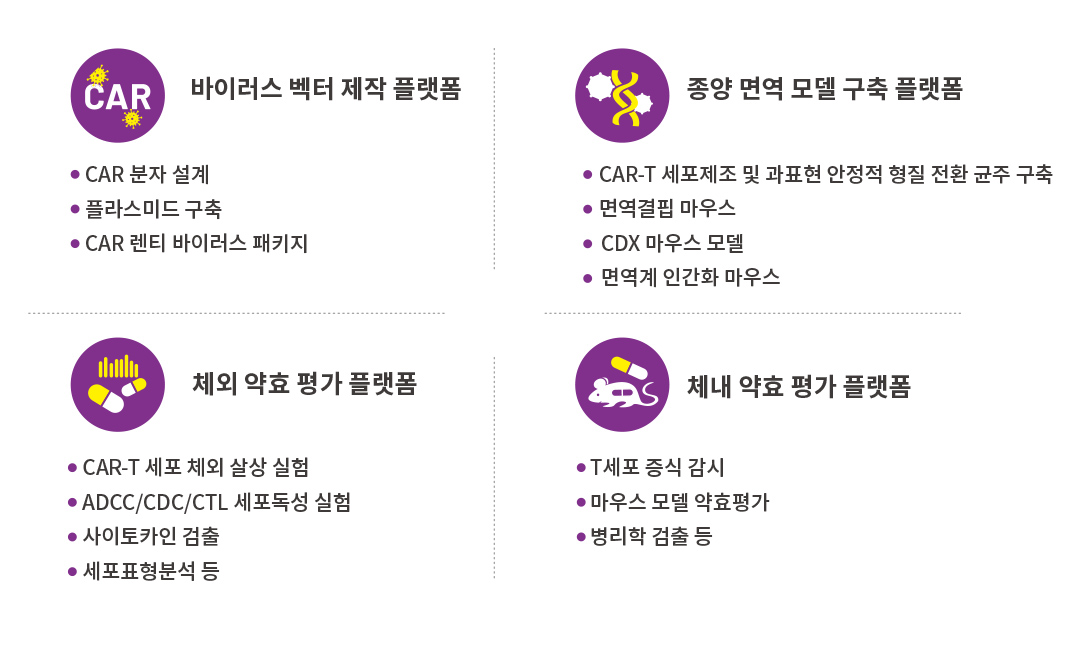
CAR-T 및 세포 치료 연구에 대하여, Cyagen 바이오는 풍부한 종양 면역 연구를 위한 마우스 모델 라이브러리를 구축하여,당신의 필요에 따라 다양하고 효과적인 CDX 모델,면역 결핍 마우스,면역 체계 인간화 마우스,동원 종양 마우스 모델 등의 평가 모델을 제공할 수 있습니다.우리는 각종 피하,제자리 또는 전이종양 모델을 구축할 수 있으며,해당 모델에 대해 고도의 맞춤화된 체내 약효학 서비스를 제공하여 당신의 전반적인 요구를 만족시킬 수 있습니다.필요하신 경우 백스테이지 댓글이나 문의연락을 환영합니다~
참고 문헌:
[1]Sterner, R. C., & Sterner, R. M. (2021). CAR-T cell therapy: current limitations and potential strategies. Blood Cancer Journal, 11(4), 1-11.
[2]Bridgeman, J. S., Hawkins, R. E., Bagley, S., Blaylock, M., Holland, M., & Gilham, D. E. (2010). The optimal antigen response of chimeric antigen receptors harboring the CD3ζ transmembrane domain is dependent upon incorporation of the receptor into the endogenous TCR/CD3 complex. The Journal of Immunology, 184(12), 6938-6949.
[3]Guedan, S., Posey Jr, A. D., Shaw, C., Wing, A., Da, T., Patel, P. R., ... & June, C. H. (2018). Enhancing CAR T cell persistence through ICOS and 4-1BB costimulation. JCI insight, 3(1).
[4]Zhang, T., Wu, M. R., & Sentman, C. L. (2012). An NKp30-based chimeric antigen receptor promotes T cell effector functions and antitumor efficacy in vivo. The Journal of Immunology, 189(5), 2290-2299.
[5]Kawalekar, O. U., O’Connor, R. S., Fraietta, J. A., Guo, L., McGettigan, S. E., Posey Jr, A. D., ... & June, C. H. (2016). Distinct signaling of coreceptors regulates specific metabolism pathways and impacts memory development in CAR T cells. Immunity, 44(2), 380-390.
[6]Salmon, H., Franciszkiewicz, K., Damotte, D., Dieu-Nosjean, M. C., Validire, P., Trautmann, A., ... & Donnadieu, E. (2012). Matrix architecture defines the preferential localization and migration of T cells into the stroma of human lung tumors. The Journal of clinical investigation, 122(3), 899-910.
[7]Li, J., Li, W., Huang, K., Zhang, Y., Kupfer, G., & Zhao, Q. (2018). Chimeric antigen receptor T cell (CAR-T) immunotherapy for solid tumors: lessons learned and strategies for moving forward. Journal of hematology & oncology, 11(1), 1-18.
[8]Brown, C. E., Alizadeh, D., Starr, R., Weng, L., Wagner, J. R., Naranjo, A., ... & Badie, B. (2016). Regression of glioblastoma after chimeric antigen receptor T-cell therapy. New England Journal of Medicine, 375(26), 2561-2569.
[9]Tchou, J., Zhao, Y., Levine, B. L., Zhang, P. J., Davis, M. M., Melenhorst, J. J., ... & June, C. H. (2017). Safety and efficacy of intratumoral injections of chimeric antigen receptor (CAR) T cells in metastatic breast cancer. Cancer immunology research, 5(12), 1152-1161.
[10]G. L., Haas, A. R., Maus, M. V., Torigian, D. A., Soulen, M. C., Plesa, G., ... & June, C. H. (2014). Mesothelin-specific chimeric antigen receptor mRNA-engineered T cells induce antitumor activity in solid malignancies. Cancer immunology research, 2(2), 112-120.
[11]Hardaway, J. C., Prince, E., Arepally, A., & Katz, S. C. (2018). Regional infusion of chimeric antigen receptor T cells to overcome barriers for solid tumor immunotherapy. Journal of vascular and interventional radiology: JVIR, 29(7), 1017-1021.
[12]Lo, A. S. Y., Taylor, J. R., Farzaneh, F., Kemeny, D. M., Dibb, N. J., & Maher, J. (2008). Harnessing the tumour-derived cytokine, CSF-1, to co-stimulate T-cell growth and activation. Molecular immunology, 45(5), 1276-1287.
[13]Zhang, E., Gu, J., & Xu, H. (2018). Prospects for chimeric antigen receptor-modified T cell therapy for solid tumors. Molecular cancer, 17(1), 1-12.
[14]Burga, R. A., Thorn, M., Point, G. R., Guha, P., Nguyen, C. T., Licata, L. A., ... & Katz, S. C. (2015). Liver myeloid-derived suppressor cells expand in response to liver metastases in mice and inhibit the anti-tumor efficacy of anti-CEA CAR-T. Cancer Immunology, Immunotherapy, 64(7), 817-829.
[15]Caruana, I., Savoldo, B., Hoyos, V., Weber, G., Liu, H., Kim, E. S., ... & Dotti, G. (2015). Heparanase promotes tumor infiltration and antitumor activity of CAR-redirected T lymphocytes. Nature medicine, 21(5), 524-529.
[16]Murad, J. P., Kozlowska, A. K., Lee, H. J., Ramamurthy, M., Chang, W. C., Yazaki, P., ... & Priceman, S. J. (2018). Effective targeting of TAG72+ peritoneal ovarian tumors via regional delivery of CAR-engineered T cells. Frontiers in immunology, 9, 2268.
[17]Cao, B., Liu, M., Wang, L., Liang, B., Feng, Y., Chen, X., ... & Zhang, Z. (2020). Use of chimeric antigen receptor NK-92 cells to target mesothelin in ovarian cancer. Biochemical and biophysical research communications, 524(1), 96-102.
[18]Wallstabe, L., Göttlich, C., Nelke, L. C., Kühnemundt, J., Schwarz, T., Nerreter, T., ... & Hudecek, M. (2019). ROR1-CAR T cells are effective against lung and breast cancer in advanced microphysiologic 3D tumor models. JCI insight, 4(18).
[19]Srivastava, S., Furlan, S. N., Jaeger-Ruckstuhl, C. A., Sarvothama, M., Berger, C., Smythe, K. S., ... & Riddell, S. R. (2021). Immunogenic chemotherapy enhances recruitment of CAR-T cells to lung tumors and improves antitumor efficacy when combined with checkpoint blockade. Cancer Cell, 39(2), 193-208.
[20]Rafiq, S., Hackett, C. S., & Brentjens, R. J. (2020). Engineering strategies to overcome the current roadblocks in CAR T cell therapy. Nature reviews Clinical oncology, 17(3), 147-167.
[21]Marofi, F., Motavalli, R., Safonov, V. A., Thangavelu, L., Yumashev, A. V., Alexander, M., ... & Khiavi, F. M. (2021). CAR T cells in solid tumors: challenges and opportunities. Stem cell research & therapy, 12(1), 1-16.




영업일 기준 1-2일 내에 답변해 드리겠습니다.