

유도만능줄기세포(induced pluripotent stem cells,IPS)는 배아줄기세포(Embryonic stem cells,Es)와기능이 비슷하며 말단 분화된(terminal differentiation) 세포가 유도 재프로그래밍을 거쳐 얻어지는 다기능성 세포입니다.분화 능력이 뛰어나고 원세포의 유전적 배경과 일치해 특정 조건에서 IPS세포가 특정 세포 유형이나 조직으로 재분화됩니다.IPS세포는 원대에 추출한 줄기세포에 비해 도덕성 논란이 없고 출처가 다양해 면역거부반응을 피할 수 있다는 장점이 있습니다.최근 몇 년 동안 CRISPR 유전자 편집의 IPS 세포에서의 응용에 대한 관심이 높아지고 있으며 질병 모델의 확립과 메커니즘 연구,세포 치료,약물의 발견과 평가 등에서 잠재적인 응용가치가 커 줄기세포생물학 분야 전반과 임상 재생의학에 새로운 연구 아이디어를 제공하고 있습니다.다음은 IPS에 대한 배경 지식과 유전자 편집 후 활용에 대해 안내해 드립니다.
IPS 세포의 유도
1. 유도 원리
IPS세포의 유도원리는 외원인자를 말단 분화된 세포에 전달하여 다능성 유전자의 표형을 활성화시키고 종말에 분화된 세포를 다능줄기세포,즉 IPS세포로 재프로그래밍하는 것입니다.이들 외원인자는 보통 Oct4,Sox2,Klf4 등이 있습니다.
2.유도방법
역전사 바이러스 또는 렌티바이러스 시스템을 통해 외원인자의 유전자 서열을 숙주세포(예를 들면 섬유세포)에 통합하여 장기간 안정적으로 외원인자를 표현하면 말단 분화 세포의 재구성 과정을 시작할 수 있습니다.유도효율이 높지만 얻은 IPS세포는 일정 부분 혹을 유발합니다.그래서 이런 위험을 피하기 위해 아데노바이러스나 플라스미드 등을 게놈 확률이 낮은 것으로 통합하는 방법도 있습니다.또는 외원인자를 배양기에 직접 첨가하여 세포에 외원인자를 흡수하도록 하는데,이 방법들도 매우 큰 문제가 있습니다.유도효율이 낮습니다.
유도 효율을 높이기 위해 일부 연구자들은 유도 체계에 소분자 약물을 첨가하거나 배양 조건을 조절합니다.예를 들어 소분자 약물을 첨가해 세포 게놈의 메틸화 정도나 특정한 신호 경로 등에 영향을 미쳐 재프로그래밍의 효율성을 높이는 것입니다.따라서 IPS 세포를 유도할 때 소분자 약물을 적절히 첨가하여 유도 효율을 높일 수 있습니다.
또한 체세포의 유형,상태,세포 세대의 대수학 등의 요인으로 유도 성공률에도 큰 영향을 미칩니다.전반적으로 분화 정도가 높은 세포의 유형은 유도 성공률이 낮습니다.이는 수용체세포의 메틸화 수식이나 아세틸화 수식 등 후성유전 수식과 관련돼 유도 조건도 다를 수 있습니다.그래서 적절한 수용체 세포를 골라 유도하는 것도 중요합니다.오늘날 흔히 사용되는 수용체 세포에는 일차 섬유아세포(Primary fibroblasts)가 있는데,이는 취재가 편리하고 배양이 간편하기 때문입니다.
IPS 세포의 선별 및 감정
체세포의 유도를 받은 후 선별 및 검정을 거쳐 목적 IPS세포를 얻어야 합니다.해당 종의 ES세포를 대조하여 분자와 세포수준에서 검사하여 IPS세포유도의 성공여부를 판단합니다.
Oct4,Sox2,Nanog등 내원의 건성 마크업 유전자의 표현 수준을 분자 수준에서 검출할 수 있습니다.이들 유전자의 발현 수준은 종별로 차이가 있지만 일반적으로 높은 편입니다.이들 마커 유전자를 면역형광염색으로 검사할 수도 있고,양성 신호가 있으면 다능건성을 갖고 있음을 보여줍니다.동시에 내원건성 표시 작동자의 메틸화 정도도 검출할 수 있습니다.또한 텔로머레이즈(Telomerase)의 활성을 검출하여 IPS세포의 영생화 능력을 확인해야 합니다.
세포 차원에서는 관찰세포의 형태를 통해 판별할 수 있습니다.IPS세포의 형태가 ES세포와 비슷하며 성장 속도가 빠르고,클러스터 성장이 빠르고,핵질비가 높으며,장기 전대와 AP염색이 양성으로 나타나는 특징이 있습니다.또 분화능력과 핵형 검출이 필요한데,이는 외부 유전자 통합이 무작위적이어서 유도된 IPS 세포에 높은 비율의 핵형 이상이 있기 때문입니다.
IPS 세포가 CRIPSR 유전자 편집을 만났을 때
CRISPR 유전자 편집 기술은 목적 유전자를 효율적이고 정밀하게 Knockout하고 점 돌연변이 및 Knock-in할 수 있습니다.최근 몇 년간 CRISPR와 IPS 세포는 각각 유전자 연구와 질병 치료 등에 활용 가능성이 큽니다.그러면 CRISPR가 IPS 세포에 적용되면 큰 불꽃이 튀게 됩니다.
유전자 편집의 수단을 통해 환자의 IPS 세포의 병원성유전자를 바로잡고,시정된 IPS 세포를 특정 세포,조직,기관으로 분화해 환자의 체내에 이식해 치료하는 것이 IPS 세포와 유전자 편집자가 공동으로 사용하는 가장 좋은 방법입니다.예를 들어 피부나 혈액세포를 IPS세포로 유도하고,CISH 유전자를 CRISPR/Cas9 기술로 녹아웃하여 IPSC-CISH-/세포를 얻고,다시 IPSC-CISH-/--NK 세포로 분화합니다(그림1).연구결과 백혈병 이종이식모델에서 IPSC-CISH-/--NK세포는 종양 성장에 대한 억제력이 더 강하고 체내에서의 IPSC-CISH-NK세포의 지속성도 현저히 증가한다고 합니다.
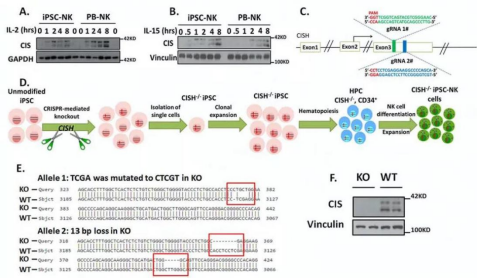
그림 1. 인간 IPSC에 CISH-/-IPSC-NK 세포를 구축한다[1]
유전자 편집 후 IPS 세포는 각종 세포와 조직,기관으로 유도돼 각종 질병 모델을 구축할 수 있으며 유전자 기능 연구,질병 메커니즘 탐색,약물 선별 등에 활용됩니다.예를 들어 Kung 등은 인간 iPSC 세포에서 miR-26b를(그림 2) 녹아웃한 miR-26b 의 발육과 질병에서의 역할을 탐구합니다.이 miR-26b 녹아웃된 IPS 세포는 정상적인 핵형을 보이며 다능성 마크를 표현하고 세 개의 배아층으로 분화하는 세포를 나타냅니다.이것은 연구 발육을 위한 좋은 실험 모델을 제공하고,IPSC 에서 파생된 인간 장기질환 모델에서 miR-26b 하류 조절 이상 메커니즘을 천명했습니다.
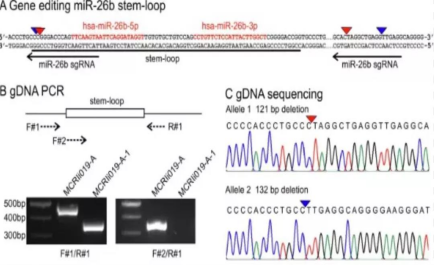
그림 2. IPSC세포에서 miR-26b의 녹아웃 및 감정 [2]
IPS 세포에서 유전자 편집의 응용 난점
CRISPR와 IPS 세포는 모두 응용 전망이 크지만 둘을 완벽하게 결합하는 것은 쉽지 않습니다.이 둘을 완벽하게 결합시키는 데는 여러 가지 요인이 작용합니다.앞에서도 알 수 있듯이 IPS세포 유도는 복잡하고 기구한 과정으로 유도율이 낮고 배양조건이 까다롭다는 등의 난점이 있습니다.그렇다면 IPS 세포에 유전자 편집을 적용해도 비슷한 문제가 있습니다.예를 들어 편집 과정에서 IPS 세포의 배양 조건이 일반 세포계보다 훨씬 까다로워 자칫 IPS 세포를 분화시키고 건성을 잃기 쉽습니다.또한 편집 후 싱글클론 선별이 어려워 탈과녁이 발생할 수 있습니다.
Cyagen 바이오는 세포 유전자 편집과 줄기세포 배양에 오랜 경험을 갖고 있으며 IPS 세포에서 유전자 편집을 구현할 수 있는 능력을 갖추고 있습니다.예를 들어 CRISPR/Cas9 유전자 편집 기술을 통해 유도성 다능성 줄기세포 IPS 에서 Human TNFAIP8L2 유전자를 제거할 수 있습니다.작은 조각의 녹아웃 방법을 통해 TNFAIP8L2 의 2번 외현자에 sgRNA 두 개를 설정하고 2 번 외현자 300 bp 를 녹아웃합니다 (그림 3).TNFAIP8L2 유전자가 녹아웃된 순합 IPS세포를 PCR과 순차검사를 통해 확인되었습니다(그림4).면역형광염색을 통해 NANOG,OCT4,SOX2 세 개의 건성표지 유전자를 검사하면 모두 양성신호가 검출되어 이 녹아웃세포가 건성을 가지고 있음을 나타냅니다(그림5).
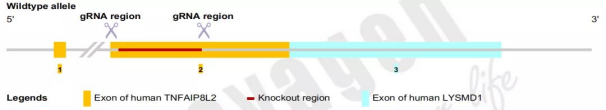
그림 3. hTNFAIP8L2의 녹아웃 정책입니다
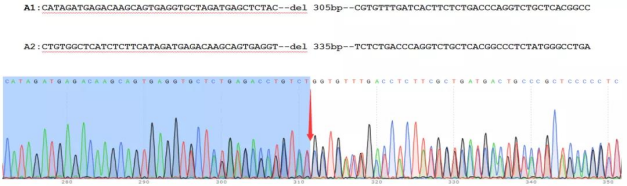
그림 4. IPS-hTNFAIP8L2-KO 시퀀스 검출
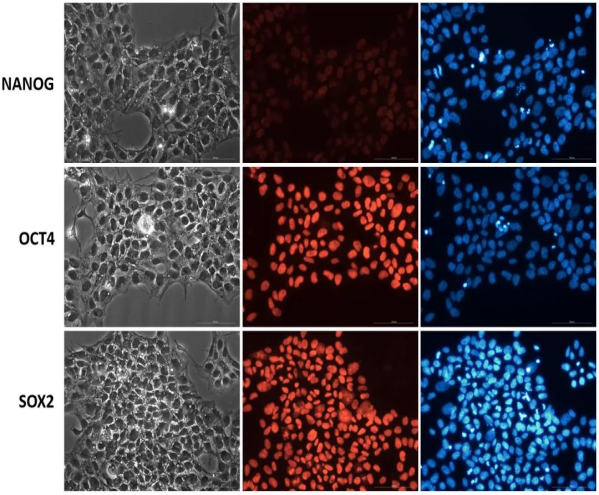
그림 5. IPS-hTNFAIP8L2-KO 건성검출
스마트 KO 솔루션 설계 시스템, IPS 세포 녹아웃 손쉬운 해결
Cyagen바이오는 다년간 성숙하고 안정된 패턴동물과 체외세포에서의 CRIPSR 유전자 편집기술,풍부한 (줄기)세포 배양기술 경험을 바탕으로 IPSC와 기타 각종 세포계의 유전자 녹아웃(KO),Knock-in(KI) 및 점 돌연변이(PM)를 쉽게 결정할 수 있습니다.
참고 문헌:
1. Zhu, Huang et al. “Metabolic Reprograming via Deletion of CISH in Human iPSC-Derived NK Cells Promotes In Vivo Persistence and Enhances Anti-tumor Activity.” Cell stem cell .27,2(2020): 224-237.e6.
2. Kung, Louise H W et al. "Generation of a miR-26b stem-loop knockout human iPSC line, MCRIi019-A-1, using CRISPR/Cas9 editing." Stem cell research. 50 102118. 10 Dec. 2020.




영업일 기준 1-2일 내에 답변해 드리겠습니다.