


CAR-T 세포면역요법의 기본원리는 유전공학적(genetic engineering) 수단을 이용하여 T세포 표면에 CAR분자를 표현하는 것입니다. CAR-T세포는 그 표면에 발현된 scFv를 통해 특이하게 종양세포 표면의 항원을 인식해 종양세포를 살상할 수 있습니다.
CAR-T 세포면역요법은 여러 해에 걸쳐 이미 종양치료 분야에서 괄목할 만한 성과를 거뒀지만 여전히 많은 도전에 직면해 있습니다.CAR-T 세포는 임상 사용 과정에서 사이토카인 방출 증후군, 탈표적 독성, 종양분해 증후군 등 심각한 독부작용이 발생하는데 이는 임상적용을 제한합니다. 따라서 차세대 CAR-T세포 개발의 방향은 CAR분자의 구조 최적화, T세포 개조를 통한 독부작용을 감소시키는 동시에 CAR-T세포의 항종양 효과를 증대시키는 데 있습니다. 또한 환자 자신의 T세포는 질병 자체나 치료로 인해 세포수가 부족하거나 기능이 결여되어 CAR-T세포 제작에 실패하는 경우가 많습니다.
따라서 범용적인 차세대 CAR-T세포를 개발하는 것도 CAR-T세포 면역요법의 중요한 방향입니다. 그러나 이체 T 세포의 사용은 보통 심각한 GVHD 를 초래하며, CRISPR/Cas9 기술의 출현은 이 문제를 해결할 수 있는 가능성을 제공합니다. 현재 CRISPR/Cas9는 αβ T세포의 내원성을 녹아웃 한 TCR로 제작된 범용 CAR-T세포는 임상 전에 이미 좋은 치료 효과를 거두고 있습니다[1].본문에서는 CAR-T세포 면역요법의 연구 개황을 설명해 드리는 한편, 유전자 편집 기술인 CRISPTR/Cas9의 CAR-T세포 안전성과 유효성 강화 방면에 대한 응용에 대해 설명합니다.
CAR-T 기술의 발전
CAR분자는 일종의 유전자공학으로 구축된 융합단백질로서 TCR단백질과 유사한 구조로 종양항원을 인식하는 엑토도메인(ectodomain)과 하나 또는 몇몇 세포내 신호통로 구조역을 포함하고 있습니다.CAR 분자의 엑토도메인(ectodomain) 단백질은 단일사슬항체 가변영역에서 유래하는 경우가 많으며, 세포내 신호 채널 구조역은 CD28, 4-1BB 또는 OX40과 같은 부 자극(costimulation) 신호 구조역과 CD3ζ 신호 구조역을 포함합니다.
1세대 CAR 분자의 신호통로 구조역에는 CD3ζ 신호만 들어있기 때문에 T세포를 충분히 활성화시키지 못해 응용에 큰 효과를 거두지 못합니다.이를 바탕으로 학자들은 CAR 분자의 구조를 더욱 개선해 하나 또는 두 개의 협동 부 자극(costimulation) 분자를 도입해 각각 2세대 CAR와 3세대 CAR 분자를 형성했습니다.최근에는 4세대 CAR 분자가 진화했는데, 그 구조는 전통적인 CAR 분자의 소자 외에도 T세포의 사이토카인(cytokines) 분비를 유발할 수 있는 구조를 도입했습니다. 또한, TCR α 또는 β 사슬로 녹아웃 된 범용형 CAR-T 세포의 연구는 차세대 CAR-T 세포 연구의 중요한 방향을 나타내며, 이를 5세대 CAR-T 기술이라고 합니다[2].역대 CAR-T 세포의 발전 역정은 그림 1과 같습니다[3].
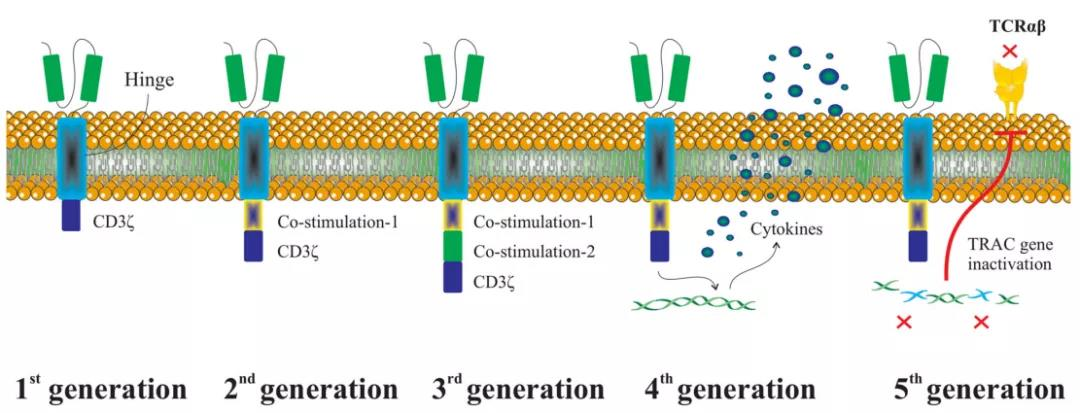
그림1. CAR-T 세포의 발전 과정[3].
CAR-T 면역요법에 CRISPR/Cas9 기술 응용
현재 CRISPR/Cas9 기술은 한편으로 범용형 CAR-T 세포의 개발에 널리 사용되고 있으며 CAR-T 세포의 응용 범위를 확장하고 있습니다. 다른 한편으로는 T세포를 포함한 면역세포의 수식을 위해 널리 사용되어 항종양 효과를 높일 수 있습니다. CRISPR/Cas9 기술의 적용은 여전히 많은 안전성, 유효성 등의 문제에 직면하고 있지만, 이 기술이 차세대 새로운 CAR-T 기술 개발에 중요한 역할을 할 것임은 의심의 여지가 없습니다.
1//CRISPR/Cas9 기술 사용
T세포 기능에 영향을 미치는 억제성 분자를 파괴
종양세포는 음성을 나타내는 신호통로를 통해 분자를 조절해 면역반응을 억제하거나 면역세포의 살상을 피할 수 있는데, 이를 면역검사점이라고 합니다.PD1 은 중요한 면역 검사점 분자로,그 신호 통로의 활성화는 T 세포의 증식과 면역 반응을 현저히 억제할 수 있습니다.
현재 CRISPR/Cas9이 편집하고 있는 TCRα 유전자와 PD-1 유전자 녹아웃 CAR-T세포 임상적용에 대한 안전성과 그 치료의 타당성은 한 연구에서 검증되었습니다. 한 연구에서 연구자들은 CRSISPR/Cas9이 내원성의 TCRα와 PD-1 유전자에 대해서는 높은 편집 효율을 보이고 있지만 TCRβ 유전자에 대해서는 편집 효율이 낮다는 사실을 발견했습니다.한편 이번 연구결과 CRISPR/Cas9편집된 T세포는 체내에서 9개월 가까이 생존할 수 있으며 낮은 수준의 임상독부작용만 있는 것으로 나타났습니다[4].
또 다른 연구에서 Rupp 등은 Cas9과 표적 PD-1 유전자 1번 외현자의 sgRNA를 전기적으로 회전시켜 T세포로 옮긴 뒤 CD19 CAR 유전자를 함유한 렌티바이러스로 이 세포를 감염시켰습니다.그 결과 PDL1+CD19+종양세포로 구성된 마우스 모델에서 PD-1 유전자가 녹아웃한 CD19 CAR-T세포가 종양세포를 효과적으로 제거한다는 결과가 나왔습니다.이 같은 결과는 PD-1/PDL1 신호통로가 T세포 기능을 조절하는 데 중요한 역할을 한다는 것을 보여줍니다[5].
2//항 자살 CAR-T 세포의 구축
최근 새로운 표적 CD7의 항자살 CAR T 세포에 대한 연구 보도가 있었습니다.이 연구에서 연구원들은 CRISPR/Cas9 기술을 사용하여 T세포의 TCR과 CD7 분자를 녹아웃하였습니다. TCR 의 녹아웃은 CAR-T 가 이체치료에 사용될 때 발생하는 GVHD 위험을 피할 수 있고, CD7 의 녹아웃은 CAR-T 세포가 서로 자살하는 것을 막을 수 있게 합니다.
이 연구에서 CD7 CAR-T 세포는 체내외 다양한 CD7+ 백혈병 세포계와 종양 동물모델에서 양호한 항종양 활성을 보였으며 GVHD 반응을 일으키지 않았습니다.따라서 이 CD7 CAR-T 기술의 개발은 난치성 급성 T림프구 백혈병과 비호지킨 T세포 림프종 치료에 매우 중요한 의미를 갖게 됩니다[6].
3//CAR-T 세포의 임상 적용에서 사이토 카인 폭풍을 낮추
입세포-대식세포집락자극인자(GM-CSF)가 사이토카인 폭풍유발에 중요한 역할을 하는 점을 고려할 때,일부 연구자들은 GM-CSF의 사이토카인 폭풍 유발을 어떻게 약화시키느냐에 초점을 맞추고 있습니다.GM-CSF는 조혈모세포 분화 및 증식에 중요한 역할을 합니다.
2019년, Sterner 등은 CRISPR/Cas9을 사용하여 CD19 CAR-T 세포의 GM-CSF 유전자를 녹아웃합니다. 이 연구결과에 따르면 GM-CSF 유전자 녹아웃 CAR-T 세포의 GM-CSF 분비가 확실히 감소한 것으로 나타났습니다. 그러나 CAR-T세포의 중요한 기능에는 영향을 미치지 않습니다. 무엇보다 GM-CSF 결함의 CD19 CAR-T세포는 야생형의 CD19 CAR-T세포보다 체내에서 뚜렷한 항종양 효과를 나타냅니다[7].
4//범용형 CAR-T세포의 제작
범용형 CAR-T(UCAR-T)세포는 건강한 제공자의 T세포를 사용하여 제조할 수 있으며 대량생산도 가능해 제품의 균일성이 더 좋아 CAR-T세포 면역요법의 응용범위를 크게 넓힐 수 있습니다. 따라서 범용형 CAR-T세포 치료제품은 차세대 CAR-T세포 개발의 중요한 방향입니다.
현재 통용형 CAR-T 세포의 개발은 주로 T 세포 TCR 유전자와 β2M 유전자의 녹아웃이나 침묵을 통해 이뤄지고 있으며, CRISPR/Cas9 유전자 녹아웃 기술은 범용 CAR-T 개발 응용의 주류 기술입니다. Eyquem 등은 CRISPR-Pro 기술을 사용하여 TCRα 일정불변 영역을 녹아웃하는데, sgRNA 표적은 TCRα의 첫 번째 외현자(expressed region) 5'끝입니다.그런 다음 AAV 를 사용하여 동원팔로 둘러싸인 CD19 CAR 유전자 서열을 해당 세포로 전달하고, CD19CAR 유전자를 동원재구성을 통해 TCR 지점에 삽입합니다.그 결과 95%에 가까운 T세포의 TCR이 녹아웃된 것으로 나타났습니다.추가적인 NALM6 마우스의 체내 종양 모델 실험 결과 다음과 같은 결과가 나왔습니다.1×105 개의 CAR-T 세포만 수혈하면 종양 세포의 성장을 효과적으로 통제할 수 있고, T 세포의 2% 만이 PD1, LAG3, TIM3 과 같은 억제성 수용체를 표현할 수 있습니다[8] .이들 억제 수용체의 낮은 표현은 좋은 항종양 효과를 거두는 주요 원인일 수 있다.이번 연구결과는 유전자 편집기술을 통해 CAR-T세포의 항종양 효과를 증대시키는 방법에 대한 아름다운 그림을 그리고 있습니다.
전망
CRISPR/Cas9 기술의 CAR-T세포 면역분야 적용 연구가 계속 진행됨에 따라 향후 이체치료의 거부반응 해결, CAR-T의 강직신호 극복, T세포 기능 소모 개선, 종양 미세환경 억제 극복 및 CAR-T 치료의 독부작용 저감 등에 중요한 역할을 하게 될 것입니다.
또한 CRISPR/Cas9 를 기반으로 한 대규모 고처리량 유전자 검진 방법의 개발은 T 세포의 수백 개 유전자 선별에 효율적이고 특이적으로 가능성을 제공합니다. 이와 함께 CRISPR/Cas9 기술을 적용해 CAR-T 세포의 고갈을 역전시킬 수 있는 새로운 유전자의 감정에도 큰 연구 공간이 있습니다. 그러나 CRISPR/Cas9 시스템은 세포 치료의 새로운 기술로서 현재 학술 및 제약 업계의 많은 연구 실험실에서 응용되고 있습니다.CRSPR/Cas9 응용의 빠른 발전과 새로운 유전자 편집 기술의 등장으로 CAR-T 세포가 종양 면역 치료 분야에서 더 큰 진전을 이룩할 수 있기를 희망합니다.
Cyagen 바이오 세포 치료 원스톱 솔루션
Cyagen는 다년간의 종양면역분야 연구경험에 기초하여 CAR-T 및 기타 세포치료 연구자들에게 CAR 바이러스 제조, 종양면역세포 및 동물모델 구축부터 체외체내 약효평가에 이르는 전 프로세스 서비스를 제공하여 CAR-T 및 세포치료 연구개발을 더욱 가속화할 수 있습니다.

참고 문헌:.
1. Li C, Mei H, Hu Y, et al. Applications and explorations of CRISPR/Cas9 in CAR Tcell therapy. Brief Funct Genom. 2020.
2. Chylinski K, Makarova KS, Charpentier E, et al. Classification and evolution of type II CRISPR-Cas systems. Nucleic Acids Res. 2014.
3. Razeghian E, Nasution MKM, Rahman HS, et al. A deep insight into CRISPR/Cas9 application in CAR-T cell-based tumor immunotherapies. Stem Cell Res Ther. 2021.
4. Stadtmauer EA, Fraietta JA, Davis MM, et al. CRISPR‐ engineered T cells in patients with refractory cancer. Science. 2020.
5. Rupp LJ, Schumann K, Roybal, KT, et al. (2017). CRISPR/Cas9‐mediated PD‐1 disruption enhances anti‐tumor efficacy of human chimeric antigen receptor T cells. Scientific Reports. 2017.
6. Cooper ML, Choi J, Staser K, et al. An “off-the-shelf” fratricide-resistant CAR-T for the treatment of T cell hematologic malignancies. Leukemia. 2018.
7. RM Sterner, Cox M J, Sakemura R , et al. Using CRISPR/Cas9 to Knock Out GM-CSF in CAR-T Cells[J]. Journal of visualized experiments. JoVE. 2019.
8. Mansilla-Soto, Jorge, Odak, et al. Targeting a CAR to the TRAC locus with CRISPR/Cas9 enhances tumour rejection[J]. Nature, 2017.
About Cyagen
Cyagen 바이오테크놀로지 그룹은 모델 동물 약물 개발을 기반으로 하는 국제화된 혁신적인 CRO 플랫폼입니다.품계가 풍부한 유전자 편집 마우스 자원 라이브러리,효율적이고 지능적인 패턴 동물 맞춤형 플랫폼,약물 선별 평가 마우스 모형 플랫폼,원스톱 마우스 표형 분석 플랫폼,원스톱 무균 마우스 기술 서비스 플랫폼 및 선진 세포 기술 서비스 플랫폼에 의해 다중 일체화된 혁신적인 CRO 플랫폼 서비스 네트워크를 구축하여 종양,면역,대사,내분비, 심혈관,신경 및 전염병 등의 방향에 대한 과학적 연구 및 약물 개발,또한 전 세계 100여개국 수만명의 과학자 및 기업체들과 광범위한 협력을 맺고 제품과 기술은 CNS(Cell,Nature,Science) 3대 저널을 포함한 5700여편의학술논문에 직접 활용되고 있습니다.Cyagen은 ISO9001:2015와 AAALAC의 인증을 받았으며,많은 전문가 학자들에게 제공되는 모든 제품과 기술 서비스가 국제 표준에 적합함을 확보함과 동시에 동물 복지와 윤리를 존중하고 생물 안전을 중시하는 우리의 책임 있는 태도를 나타냈습니다. 필요하시면 백스테이지 댓글이나 문의 주세요.




영업일 기준 1-2일 내에 답변해 드리겠습니다.