

BRGSF(BALB/c Rag2tm1Fwa Il2rgtm1Cgn SirpαNOD Flk2tm1lrl) 마우스는 현재 면역결핍 정도가 가장 높은 마우스 중 하나이다. Rag2와 Il2rg 유전자의 제거는 BRGSF 마우스의 T, B, NK 세포를 결핍되게 하고, SIRPaNOD는 인간세포에 대한 마우스 대식세포의 식균작용을 억제하였으며, Flk2-/-유전자의 제거는 마우스 골수세포 구성성분(특히 마우스 수지상세포, Dc)을 크게 감소시켰다(그림 1). 이와 같은 면역체계의 심각한 결핍은 BRGSF 마우스가 각종 CDX와 PDX의 이식편과 높은 호환성을 가지고 이식효율이 높아 항암제의 약리학과 약력학 연구에 매우 적합하다. 또한 N*G 마우스(Nod 유전적 배경: 보체 C5-/-)와 달리 BRGSF 마우스는 BALB/c 배경이며 체내에 온전한 보체 시스템이 존재하므로 보체의존세포독성(complement-dependent cytotoxicity, CDC)을 연구하는 아주 유력한 도구이다. 예를 들어, CDC 메커니즘을 이용하여 수요에 따라 CAR-T를 제거해야 하는 약물에 대해 유효성과 안전성 평가를 진행한다.
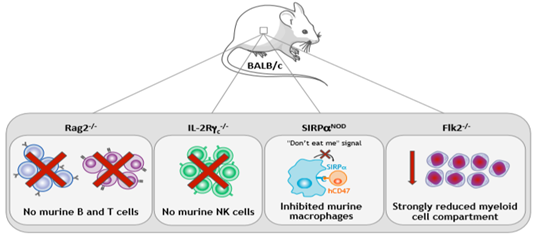
그림 1. BRGSF 중증면역결핍 마우스
보체(complement)는 활성화 후 효소활성을 가지는 혈청 단백질이며 주로 간세포와 대식세포에 의해 생성되고, 유기체 염증반응 및 항미생물의 면역반응에 관여한다. 보체의존세포독성(complement-dependent cytotoxicity,CDC)이란 보체계가 활성화된 후 표적 세포막 표면에 막공격복합체(membrane attack complex,MAC)를 형성하고 세포막 천공을 통해 결과적으로 세포 용해를 초래하는 세포 파괴효과를 말한다. 보체 활성화에는 고전 경로, MBL 경로, 대체 경로 등 3가지 경로가 있다(그림 2). 세 가지 경로 모두 보체 5(C5)가 관여해야 최종적으로 C5b6789(C5b-9)로 구성되는 MAC를 형성한다. NOD 유전적 배경의 마우스는 C5 유전자 결핍으로 체내 보체계가 온전하지 못해 CDC 효능을 발휘할 수 없다. 반면, BRGSF 마우스는 BALB/c 배경으로, 체내에 온전하고 유효한 보체계가 존재하므로 CDC를 연구하는 유력한 도구이며 CDC 메커니즘을 이용해 치료 효과를 발휘하는 약물에 대한 유효성과 안전성의 평가에 사용할 수 있다.
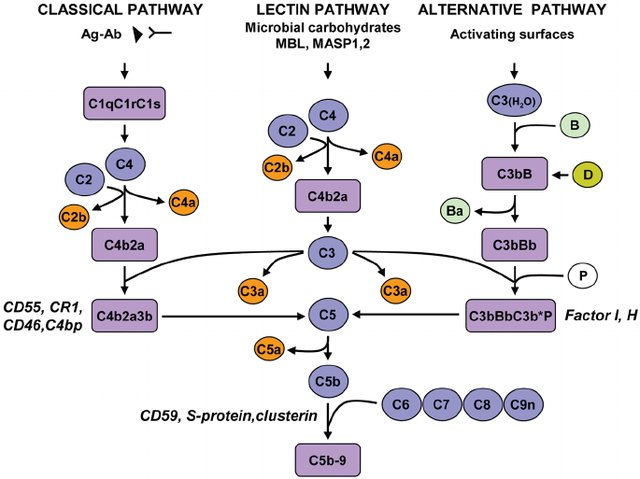
그림 2. 보체활성화의 세 가지 경로[1]
CAR-T세포 면역요법은 인체의 자가면역체계를 이용해 종양세포를 공격하는 새로운 항암요법이다. 2017년 연말에 FDA가 CD19를 표적으로 하는 두 종류의 CAR-T 요법(Novartis사의 Kymriah와 Kite/Gilead사의 Yescarta) 출시를 승인한 데 이어 2020년 7월에 Kite/Gilead사의 Cd19를 표적으로 하는 CAR-T 요법인 Tecartus도 승인을 받아 출시됐다. 최근(2021년 2월 5일)에 또다시 좋은 소식이 우리에게 전해졌다. 즉 Bristol-Myers Squibb(BMS) 산하의 Juno Therapeutics사가 개발한 마찬가지로 CD19를 표적으로 하는 네 번째 종류 CAR-T 치료법으로, 재발성이나 난치성의 미만성거대B세포림프종(DLBCL) 치료에 사용하는 Breyanzi가 승인됐다고 FDA가 발표했다.
현재 CAR-T세포 면역요법은 주로 선별된 환자의 T세포에 대한 유전자 변형과 개조를 통해 그 표면에 암의 특이성 키메라 항원 수용체(chimeric antigen receptor, CAR)를 발현케 하고 체외 증식 배양 후 다시 환자 체내에 수송하여 암 치료 목적에 달성한다(그림 3). 이와 같은 치료법은 항원항체 고특이성과 고친화성의 장점 및 T세포의 파괴작용을 결합하였으며 암세포를 표적으로 파괴할 수 있다. 허나, 이와 동시에 일부 요소도 CAR-T요법의 가일층 발전을 저해하고 있으며 이는 사이토카인 방출 증후군(Cytokine release syndrome,CRS)과 신경독성 등을 포함한 CAR-T요법의 흔한 부작용이다. 그중에서 CRS는 치명적일 수 있는 급성 전신성 염증반응이며 활성화된 면역세포가 염증 촉진성 사이토카인을를 다량 분비해 발생하므로 CAR-T 요법의 유효성을 가늠하는 일종 발현으로 볼 수 있다.
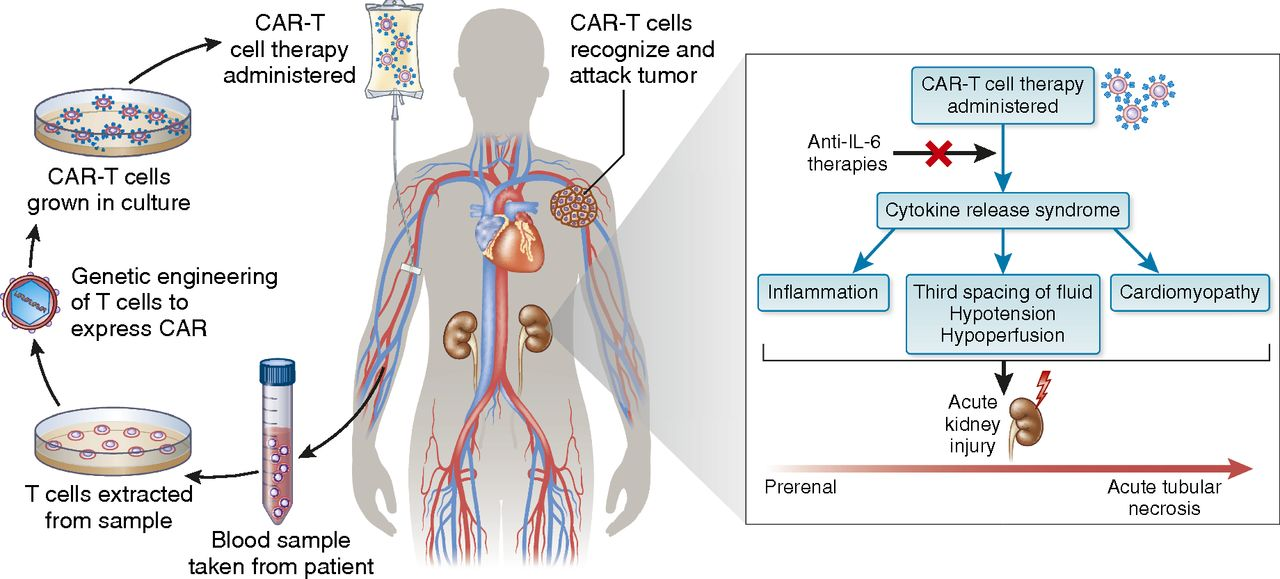
그림3. CAR-T 세포 면역요법 Flow Diagram[2]
CAR-T요법의 유효성을 저하시키지 않는 동시에 부작용이 환자의 신체에 주는 심각한 손상을 피하기 위해 연구자들은 CAR-T세포를 마음대로 처리할 수 있는 방법을 찾아내기를 희망했다. 즉, CAR-T세포가 치료 효과를 발휘한 후, 필요에 따라 빠르게 제거할 수 있기를 원한 것이었다..
2018년 프랑스 바이오제약회사 Cellectis의 과학자들이 Scientific Reports에 CDC 메커니즘을 이용하여 필요에 따라 CAR-T 세포 제거에 관한 논문 ‘A Versatile Safeguard for Chimeric Antigen Receptor T-Cell Immunotherapies’를 발표했다. 논문은 이들이 설계한 검출(detection), 정제(purification) 그리고 필요에 따라 제거(on-demand depletion) 등 세 가지 기능을 일체화하여 다발성 골수종(multiple myeloma·MM) 치료에 사용하는 CAR-T 세포인 CubiCAR-T를 소개했다.
이 CubiCAR-T세포의 CAR에는 B 세포 성숙 항원에 대항하는 단쇄 항체(anti-BCMA ScFV)를 포함하였다. BCMA는 다발성 골수종 세포 표면에 광범위하게 존재하는 중요한 치료 표적이며, CD34 에피토프(epitope)는 CD34 항원와 단일클론 항체로 결합되어 CAR-T 생산 과정 중 세포 검사와 정제에 사용된다. 또한 CD20 미모토프(mimotope)는 항 CD20의 리툭시맙(Rituximab, RTX)과 특이성으로 결합되어 CDC 메커니즘을 이용해 필요에 따라 세포를 제거할 수 있다(그림 4). CD20은 CubiCAR-T세포에서 “안전 스위치” 역할을 한다.
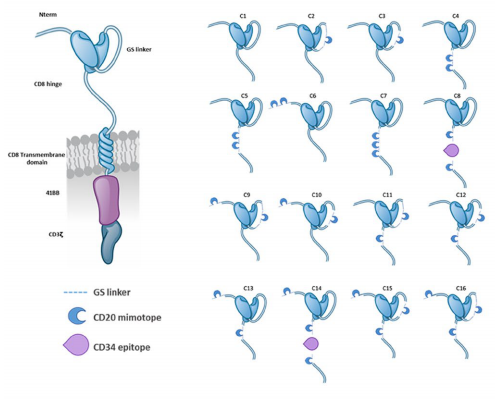
그림 4. CAR 구조 설계 방안[3]
In vitro실험에서 보다시피 CubiCAR-T세포의 제거 동력학은 투여한 RTX 농도에 의해 결정된다(그림 5). 보체와 50µg/mL RTX가 존재하는 상황에서 CubiCAR-T세포의 반감기는 약 10분이며 이 농도는 보도된 환자 RTX 혈중 최고 농도(Cmax)에 비해 약 10배 낮다[4].
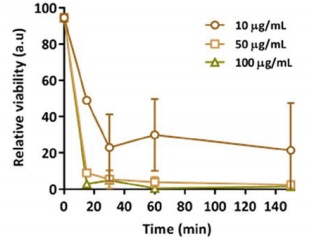
그림 5. 보체를 통해 CubiCAR-T 세포 제거 동력학[3]
2×105개 CubiCAR-T세포에 서로 다른 농도의 RTX(10-100µg/mL)와 보체를 넣거나 처리하지 않는다.
세포 상대 생존력(relative viability) = 처리된 세포생존력/처리되지 않은 세포 생존력 ×100
나아가 실험에서 CubiCAR-T 세포의 유효성을 검증하고 RTX 특이성에 의해 제거될 수 있다는 점을 검증하기 위해 연구자들은 BRGS 마우스로 체내 실험을 실시했다(그림 6). 이 마우스는 그것의 업그레이드 버전인 BRGSF 마우스와 마찬가지로 T, B, NK 세포가 결핍하며 인간 세포에 대한 대식세포의 식균작용이 약하고 기능적인 보체계가 존재하기 때문에 CDC 메커니즘을 이용하여 CAR-T 세포를 제거하는 RTX 유효성과 안전성을 평가할 수 있다.
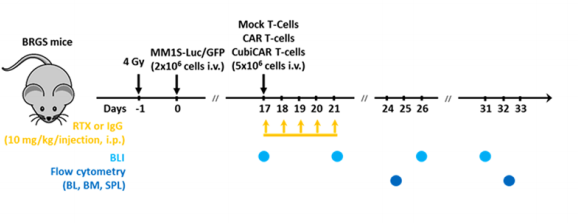
그림 6. BRGS 마우스 체내실험 Flow Diagram[3]
마우스 형광 이미징 실험 결과 표시(그림 7):
이 결과는 CubiCAR-T세포가 변형되지 않은 CAR-T세포와 마찬가지로 암세포의 증식을 효과적으로 억제할 수 있고 또한 CubiCAR-T세포가 RTX에 의해 빠르고 특이하게 제거될 수 있다는 것을 설명한다.
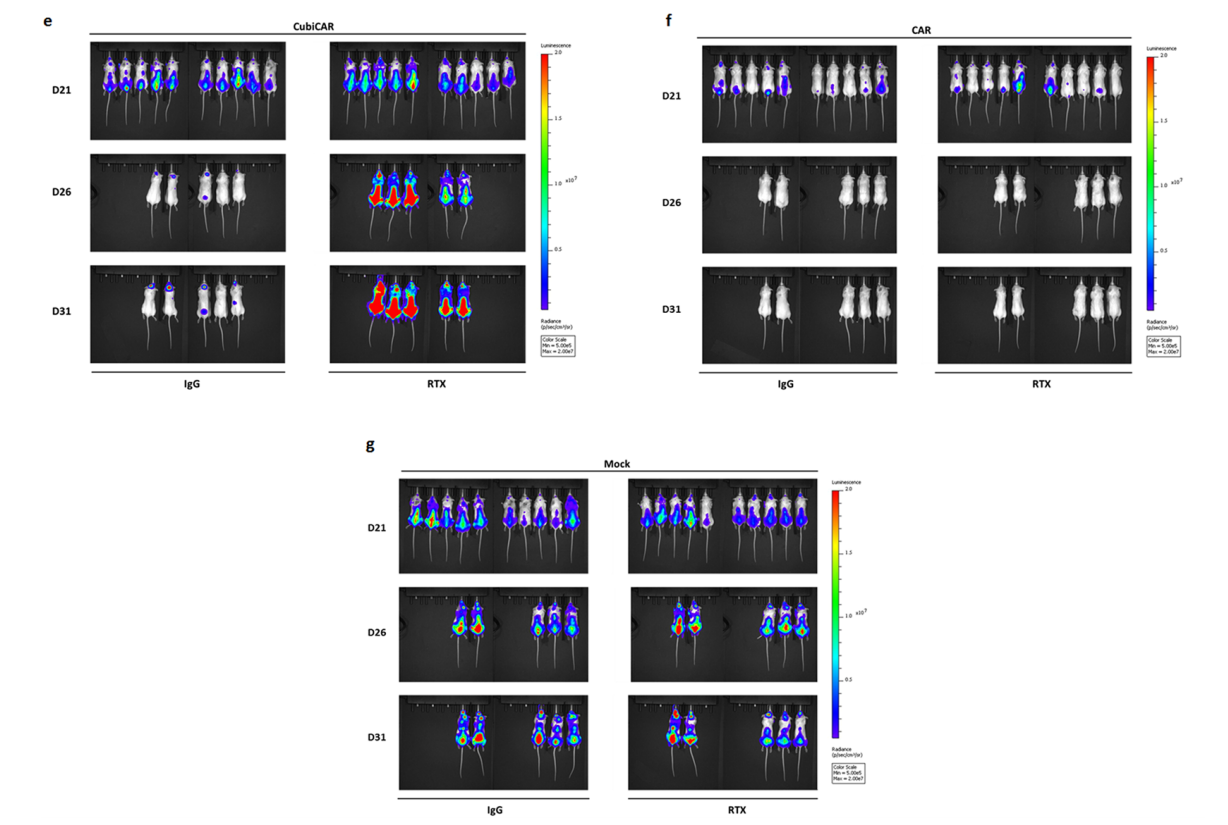
그림 7. CubiCAR-T세포가 마우스 체내에서 항암 활성을 나타내며 RTX에 의해 특이적으로 제거 가능[3]
BRGS 마우스에 루시페라아제와 GFP 라벨을 지닌 인간 다발성 골수종 셀(MM.1S-Luc GFP)을 접종 후 제17일째 무작위로 여러 그룹으로 나누고 CubiCAR-T, CAR-T 또는 T세포(mock-transduced T cells)를 주사했다. 또한 RTX를 사용하거나 사용하지 않은 식으로 처리하며 제21일째, 제26일째와 제31일째에 형광 이미징 분석을 진행했다.
CAR-T세포 면역요법은 암 치료에 있어서 더 폭넓게 밝은 전망을 갖고 있으나 이와 동시에 심각한 약물 부작용을 포함한 일련의 도전에 직면해 있다. 많은 연구자들이 필요에 따라 CAR-T 세포를 제거할 수 있는 “안전 스위치”를 설계했으나 이들 모두 약물 부피 과다, 잠재적 면역원성, 허가되지 않은 소분자를 활성화제로 의존하는 등 얼마간의 단점을 갖고 있다. 이 외에도, 이들에게 하나의 중요한 공통점이 있다. 즉 이 “안전 스위치”는 전부 CAR와 분리된 세포 표면에 존재하고 이와 같은 설계는 CAR과 안전 스위치 비율(CAR/safeguard)의 균형을 상실케 할 수 있어 "안전 스위치"를 지니지 않은 CAR-T 세포의 출현을 초래할 수 있다. 그러나 CubiCAR-T는 "안전 스위치" CD20을 CAR에 용해되게 설계되었으며, FDA 승인을 받은 항체 약물 RTX를 사용하여 CDC 메커니즘을 통해 CubiCAR-T 세포를 필요에 따라 제거함으로써 약물의 유효성을 보장하는 동시에 약물의 안전성을 높였다. 이밖에 CubiCAR-T세포는 CD34 에피토프를 CAR에 용해하여 기업의 생산 과정에서 CAR-T 세포에 대한 검출과 정제 효율을 효과적으로 높일 수 있다. 특히 연구자들은 CubiCAR에서 BCMA를 표적으로 하는 ScFV를 CD123, CD22, Cd19를 표적으로 하는 ScFVs로의 교체도 시도하였고 이와 같은 CubiCAR-T 세포는 체외 실험에서도 항암 활성을 보여줬고 RTX에 의한 특이성 제거가 가능했다. 이와 같은 데이터는 CubiCAR가 다양한 암 유형에 적용할 수 있는 “범용형 안전 스위치”가 될 수 있음을 보여준다.
References:
[1]Tegla CA., et al. Membrane attack by complement: the assembly and biology of terminal complement complexes[J]. Immunologic Research 51(1):45-60 (2011).
[2]Kenar D. Jhaveri and Mitchell H. Rosner. Chimeric Antigen Receptor T Cell Therapy and the Kidney. Clinical Journal of the American Society of Nephrology 13(5)796-798(2018).
[3]Valton J., et al. A Versatile Safeguard for Chimeric Antigen Receptor T-Cell Immunotherapies. Scientific Reports 8:8972(2018).
[4]Rubenstein JL., et al. Multicenter phase 1 trial of intraventricular immunochemotherapy in recurrent CNS lymphoma. Blood 121:745–51(2013).
BRGSF 마우스의 특징
(1) 생체내 CDC 메커니즘이 온전하며 CDC 메커니즘에 관한 연구에 사용할 수 있다.
N*G 마우스와 달리 BRGSF 마우스는 BALB/c background이며 in vivo에서 완전한 보체연쇄반응을 가지고 있으며 보체의존세포독성(CDC) 메커니즘을 연구하는 데 사용할 수도 있다. 예를 들어, CDC 메커니즘을 이용한 CAR-T 제거 약물의 효능과 안전성 평가에 사용할 수 있다.
(2) 다양한 유래의 CDX 및 PDX와 높은 호환성을 가지고 있다.
BRGSF 마우스에는 T, B, NK 세포가 없다. NOD background에서 유래된 Sirpα 유전자(SirpαNOD)가 BALB/c background에서 유래된 Sirpα 유전자를 대체했다. 마우스 대식세포가 인간세포에 대한 병탄작용이 약하고 다양한 유래의 CDX 및 PDX와 높은 호환성을 가지며 고형종양 및 혈종 연구에 사용할 수 있다.
(3) 높은 조사 내성을 가져 방사선 치료의 효과 평가 및 HIS 마우스의 제작에 적합하다.
BRGSF 마우스의 응용 및 표현형 검증에 대한 정보 알아보기
*If you require any further information, please contact us.




영업일 기준 1-2일 내에 답변해 드리겠습니다.