

현재 알츠하이머병에 대해 승인된 일부 약물은 질병 진행을 완화하는 효과가 없습니다. 지난 '신경질환 연구' 시리즈 기사에서 연구자들은 노화 마우스, Aβ 유도 AD 모델, 유전자 편집 등 일련의 AD 동물 모델을 구축했다고 언급했습니다. 알려진 병리학적 특징을 시뮬레이션하여 그 발병기전을 이해합니다. [뒤돌아보기를 클릭하시면 됩니다]. 오늘 우리는 유전자 편집을 위해 몇 가지 중요한 AD 쥐 모델을 함께 조사했습니다.
• AD 마우스 유전자 편집 모델-APP/PS1, Tg2576 등
• AD 쥐 유전자 편집 모델—AppNL-G-F
• 기타 신경질환 모델 추천
AD 마우스 유전자 편집 모델
현재 연구에서 사용된 AD 생쥐 유전자 편집 모델은 주로 유전자 변형을 통해 인간 AD 관련 유전자를 생쥐 게놈으로 전달하는 것입니다. 현재 관련 문헌에서 더 자주 사용되는 마우스 모델은 APP/PS1, Tg2576, 3xTg-AD, 5xFAD 순입니다[1].
▪ APP/PS1 모델
프리온(Prion) 단백질 프로모터, 인간 APP 및 PSEN1 유전자(APP K670_M671delinsNL (Swedish) 과 PSEN1: deltaE9 의 두 가지 인간 돌연변이 부위를 휴대합니다) 를 마우스 게놈에 전달하면 이 모델은 연령에 따라 뇌에서 Aβ 및 아밀로이드 플라크(senile plaques)의 발현 수준이 증가합니다.
생쥐는 생후 약 4개월에 피질에서 아밀로이드 플라크가 관찰될 수 있으며, 생후 6개월에는 해마에서 아밀로이드 플라크가 관찰될 수 있습니다.아밀로이드 플라크 침착은 뇌 영역에서 차이가 있으며 피질의 플라크 밀도는 해마체 및 아몬드 핵의 플라크 밀도보다 높습니다[3]. Morris 수중 미로에서 6개월에서 10개월 사이에 인지 결함이 감지되었으며 나이가 들수록 악화되었습니다.
▪ Tg2576모델
인간 APP 유전자(인간 돌연변이 부위: APPK670_M671delinsNL(Swedish))를 마우스 게놈으로 옮기면 마우스는 연령에 따라 뇌에서 Aβ 및 아밀로이드 플라크의 발현 수준을 증가시킵니다.
생쥐는 4.5개월에 해마 CA1 구역의 가지돌기 가시(dendritic spine)를 잃었고 일부 연구에서는 생후 6개월 이내에 학습 능력, 상황 공포 조건 반사 및 작업 기억 능력이 손상되었지만 인지 능력은 정상임을 보여주었습니다[6]. 인지 능력은 12개월 후에 점진적인 손상이 나타나기 시작했으며, 생쥐의 뇌에는 11-13개월에 다량의 Aβ 플라크가 나타났습니다.
▪ 3xTg-AD 모델
인간 APP, PSEN1 및 MAPT 유전자(3개의 돌연변이 부위: APP Swedish, MAPTP301L 및 PSEN1 M146V 포함)를 마우스 게놈에 전달하면 해당 마우스는 뇌에서 Aβ 및 아밀로이드 플라크의 발현 수준이 증가하고 Tau 단백질의 비정상적인 응집에 의해 형성된 신경 섬유 엉킴이 연령에 따라 발생합니다.
이 마우스는 연령 관련 진행성 아밀로이드 플라크 침착 및 비정상적인 Tau 단백질 응집에 의해 형성된 신경 섬유 엉킴을 나타냈습니다. 생후 6개월에 피질에 세포외 Aβ 침착이 관찰될 수 있으며 생후 12개월에 더 널리 분포되어 있으며 비정상적인 Tau 단백질 응집에 의해 형성된 신경 섬유 엉킴이 명확하게 관찰될 수 있습니다. 생후 3-6개월에 학습 인지 능력의 저하를 관찰할 수 있습니다[9-10].
▪ 5xFAD모델
인간 APP 및 PSEN1 유전자(5개의 돌연변이 부위: APPK670_M671delinsNL(Swedish), APPI716V(Florida), APPV717I(London), PSEN1 M146L(A>C), PSEN1 L286V 포함)를 마우스 게놈으로 전달하면 이 모델의 마우스는 연령에 따라 뇌에서 Aβ 및 아밀로이드 플라크의 발현 수준을 증가시킵니다.
생쥐의 아밀로이드 플라크의 병리학적 특성은 매우 일찍 나타났고(2-4개월령 단계에서 모두 보고되었으며 뇌 영역에 널리 분포되어 있으며 해마, 피질, 시상 및 척수에서 아밀로이드 플라크가 관찰되었습니다[11-13]. 6-12개월령에 학습인지능력 및 작업기억능력이 손상되었습니다[7].
AD 마우스 유전자 편집 모델
대부분의 쥐 모델은 Aβ 단백질의 침착을 관찰할 수 있지만 비정상적인 Tau 단백질의 인산화로 인한 신경 섬유 얽힘과 같은 다른 병리학적 특성은 나타나지 않아 일부 학자들은 rat 모델에 주목했습니다. 마우스에 비해 AD 관련 유전자(예: MAPT)의 다형성은 rat에서 인간과 더 가깝고 rat의 크기가 상대적으로 커서 수술 재료 채취 및 특정 희귀 샘플(예: 뇌척수액 샘플) 수집에 더 편리합니다.
▪ App NL-G-F Knock-in Rat 모델
2021년 칭화대학교의 저명한 신경과학자 루바이(鲁白) 교수가 이끄는 연구팀은 세계 최초로 인간 AD를 종합적으로 시뮬레이션한 rat 모델 AppNL-G-F[14]를 개발하여 rat가 Swedish, Iberian 및 Arctic의 세 가지 인간 가족 돌연변이를 가지고 있으면서 뇌에서 APP 단백질과 그 단편의 시간과 공간의 발현 수준을 변경하지 않도록 했습니다. 다른 모델과 비교하여 이 모델은 인간과 더 유사한 병리학적 및 질병 진행을 보여주었으며 돌연변이의 인간화된 APP 녹인만으로 Aβ 응집 및 Tau 관련 병리학적 표현형을 모두 생성할 수 있는 현재 유일한 설치류 모델이기도 합니다.
Aβ 침착의 출현은 동형 접합체 rat 에서 1개월령에 감지될 수 있으며 Aβ 침착은 나이가 들수록 증가하며 암컷 쥐는 수컷보다 병리학적 진행 속도가 빠릅니다. 야생형 rat 에 비해 AppNL-G-F rat의 뇌 무게 감소, 해마와 피질의 뉴런 손실, 측뇌실 확장 등은 AD 환자와 유사했으며 과학자들이 AD 동물 모델에서 뇌실 확장을 관찰한 것은 이번이 처음입니다. 동형 녹아웃 rat의 해마 뉴런은 12개월에 야생형 rat보다 30% 적고 뇌 무게는 9% 낮았으며 이러한 차이는 50개월에 각각 16% 및 22%로 증가했습니다. 손상된 학습 및 인지 능력은 생후 5~7개월에서 관찰될 수 있으며, Tau 단백질의 인산화 수준은 생후 6개월에서 증가하고 Tau 단백질의 응집은 생후 12개월에서 관찰될 수 있습니다.
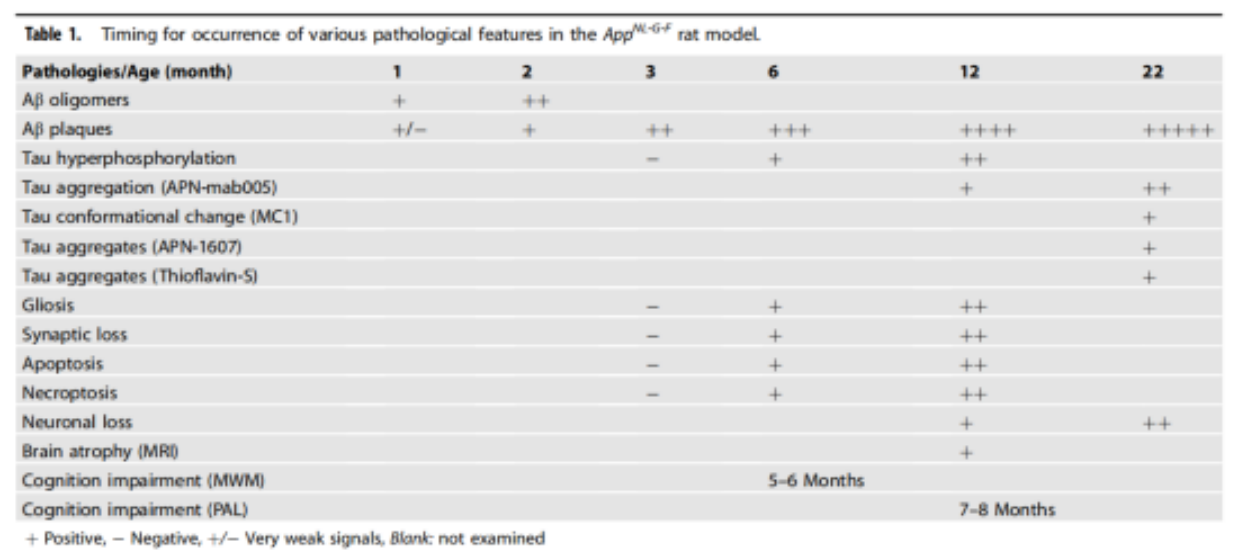
App NL-G-F rat 모델의 병리학적 특성의 시간 분포[14]
신경질환 마우스 모델 추천
알츠하이머뿐 아니라 헌팅턴증, 루게릭병 등 신경퇴행성 질환의 치료법 개발도 여전히 미흡한다. 이러한 신경 질환에 대응하여 사이업바이오는 일련의 유전자 편집 마우스 모델을 개발함과 동시에 연구자의 요구에 따라 유전자 녹아웃, 유전자 녹인, 점 돌연변이, 인간화 마우스 모델 및 생쥐 수술 질병 모델과 같은 유전자 편집 마우스 모델을 맞춤화하거나 협력하여 신경 약력학 검증 실험의 발전을 가속화할 수 있습니다.
|
신경 질환 |
관련 유전자 |
표적 유형 |
|
알츠하이머병 (AD) |
App/Psen1 |
MU |
|
App |
KI |
|
|
Trem2 |
MU、KO |
|
|
파킨슨병 (PD) |
Snca |
MU、Humanization |
|
Lrrk2 |
MU |
|
|
루게릭병 (ALS) |
Sod1 |
KO、CKO、MU |
|
Fus |
KO、CKO、Humanization(WT、MU) |
|
|
Tardbp |
Humanization |
|
|
헌팅턴병 (HD) |
Htt |
KI |
|
불안상관 (Anxiety) |
Rgs2 |
KO、CKO |
|
자폐증 (Autism) |
Tbx1 |
CKO |
|
Shank3 |
KO、CKO |
|
|
Cacna1C |
KO、CKO |
|
|
Cntnap2 |
KO、CKO |
|
|
우울증 (Depression) |
Slc18A2 |
CKO |
|
Psmd1 |
KO、CKO |
|
|
Tph2 |
KO、CKO |
|
|
척수 소뇌성 운동 실조 (Spinocerebellar Ataxias) |
Atxn3 |
Humanization |
|
전두측두엽성 치매 (FTD) |
Mapt |
Humanization |
|
척수성근위축 (SMA) |
Smn1 |
Humanization |
|
Smn2 |
KI |
참고 문헌:
[1]Kosel F , Pelley J , Franklin T B . Behavioural and psychological symptoms of dementia in mouse models of Alzheimer's disease-related pathology[J]. Neuroscience & Biobehavioral Reviews, 2020, 112:634-647.
[2]Minkeviciene R, Ihalainen J, Malm T, Matilainen O, Keksa-Goldsteine V, Goldsteins G, Iivonen H, Leguit N, Glennon J, Koistinaho J, Banerjee P, Tanila H. Age-related decrease in stimulated glutamate release and vesicular glutamate transporters in APP/PS1 transgenic and wild-type mice. J Neurochem. 2008 May;105(3):584-94. PubMed.
[3]Minkeviciene R, Rheims S, Dobszay MB, Zilberter M, Hartikainen J, Fülöp L, Penke B, Zilberter Y, Harkany T, Pitkänen A, Tanila H. Amyloid beta-induced neuronal hyperexcitability triggers progressive epilepsy. J Neurosci. 2009 Mar 18;29(11):3453-62. PubMed.
[4]Minkeviciene R, Ihalainen J, Malm T, Matilainen O, Keksa-Goldsteine V, Goldsteins G, Iivonen H, Leguit N, Glennon J, Koistinaho J, Banerjee P, Tanila H. Age-related decrease in stimulated glutamate release and vesicular glutamate transporters in APP/PS1 transgenic and wild-type mice. J Neurochem. 2008 May;105(3):584-94. PubMed.
[5]https://www.jax.org/strain/005864
[6]Lanz TA, Carter DB, Merchant KM. Dendritic spine loss in the hippocampus of young PDAPP and Tg2576 mice and its prevention by the ApoE2 genotype. Neurobiol Dis. 2003 Aug;13(3):246-53. PubMed.
[7]Spires-Jones T , Knafo S . Spines, Plasticity, and Cognition in Alzheimer's Model Mice[J]. Neural Plasticity,2012,(2011-11-28), 2011, 2012(2090-5904):319836.
[8]Irizarry MC, McNamara M, Fedorchak K, Hsiao K, Hyman BT. APPSw transgenic mice develop age-related A beta deposits and neuropil abnormalities, but no neuronal loss in CA1. J Neuropathol Exp Neurol. 1997 Sep;56(9):965-73. PubMed.
[9]Billings LM, Oddo S, Green KN, McGaugh JL, LaFerla FM. Intraneuronal Abeta causes the onset of early Alzheimer's disease-related cognitive deficits in transgenic mice. Neuron. 2005 Mar 3;45(5):675-88. PubMed.
[10]Billings LM, Oddo S, Green KN, McGaugh JL, LaFerla FM. Intraneuronal Abeta causes the onset of early Alzheimer's disease-related cognitive deficits in transgenic mice. Neuron. 2005 Mar 3;45(5):675-88. PubMed.
[11]Richard BC, Kurdakova A, Baches S, Bayer TA, Weggen S, Wirths O. Gene Dosage Dependent Aggravation of the Neurological Phenotype in the 5XFAD Mouse Model of Alzheimer's Disease. J Alzheimers Dis. 2015;45(4):1223-36. PubMed.
[12]Jawhar S, Trawicka A, Jenneckens C, Bayer TA, Wirths O. Motor deficits, neuron loss, and reduced anxiety coinciding with axonal degeneration and intraneuronal Aβ aggregation in the 5XFAD mouse model of Alzheimer's disease. Neurobiol Aging. 2012 Jan;33(1):196.e29-40. PubMed.
[13]Giannoni P, Arango-Lievano M, Neves ID, Rousset MC, Baranger K, Rivera S, Jeanneteau F, Claeysen S, Marchi N. Cerebrovascular pathology during the progression of experimental Alzheimer's disease. Neurobiol Dis. 2016 Apr;88:107-17. Epub 2016 Jan 8 PubMed.
[14]Pang K, Jiang R, Zhang W, Yang Z, Li LL, Shimozawa M, Tambaro S, Mayer J, Zhang B, Li M, Wang J, Liu H, Yang A, Chen X, Liu J, Winblad B, Han H, Jiang T, Wang W, Nilsson P, Guo W, Lu B. An App knock-in rat model for Alzheimer's disease exhibiting Aβ and tau pathologies, neuronal death and cognitive impairments. Cell Res. 2022 Feb;32(2):157-175. Epub 2021 Nov 17 PubMed.




영업일 기준 1-2일 내에 답변해 드리겠습니다.