

환경 내분비 방해물이 드러나면 남성의 건강한 생식 기능을 해칠 수 있다. 환경 내분비 방해물은 살충제와 제초제에 널리 존재하고 식품 포장재를 통해 환경에도 유출될 수 있다.환경 내분비 방해물은 인체 조직과 혈액에 축적될 수 있으며 안정 농도에 도달할 수 있다.환경 내분비 방해물이 내분비 호르몬의 작용을 시뮬레이션해 체내 호르몬 분비, 합성 장애를 초래한다는 연구결과가 나왔다.프탈산다이옥틸(DEHP,Dioctyl Phthalate)는 널리 사용되는 환경 내분비 방해물로 남성의 생식 기능 장애를 일으키는 것으로 입증됐다.현재 역학 연구에 따르면 DEHP 폭로는 남성 정자의 질 저하를 일으킬 수 있다.임신 중 DEHP 폭로는 다음 세대에 잠복고환(cryptorchidism)과 요도하열(hypospadias)을 유발할 수 있다.그러나 DEHP 자극이 고환세포의 기능장애를 일으키는 메커니즘은 아직 완전히 밝혀지지 않았다.
2021년 12월 중국 충칭(重庆)의과대학 부속 아동병원 비뇨기과 우성더(吳盛德) 연구팀은 Journal of Hazardous Materials에서 'Di-(2-ethylhexyl) phthalate exposure leads to ferroptosis via the HIF-1 α/HO-1 signaling pathway in mouse testes'라는 논문을 발표했다.논문의 제1저자는 오우호(吴雨昊) 박사 대학원생입니다.

一.연구 사고
01 체내외에서 DEHP 자극이 고환 손상을 초래한다는 것을 검증한다.
02.Omics analysis과 실험 검증을 통해 HIF-1 알파 등의 신호 통로에 이상이 생긴 것으로 밝혀졌다.
03 HIF-1α 신호 통로의 작용 메커니즘을 탐색한다.
04 체외에서 HIF-1α를 녹아웃해 HIF-1α의 역할을 더욱 검증한다.
二.결과
1●체내에서 DEHP 자극에 의한 고환 손상 가능성을 검증하였다
생쥐가 DEHP를 복용한 뒤 저자는 HE염색을 통해 생식세포가 빠지고 미세정관(seminiferous tubule) 층수가 줄어드는 현상을 발견해 DEHP가 고환 손상을 일으킬 수 있음을 입증했다. RNA-Seq를 이용하여 DEHP를 복용한 실험조와 그렇지 않은 대조조을 검측한다.GO분석을 통해 차이 표현 유전자가 산화스트레스(Oxidative Stress)과 철대사와 관련이 있다는 것을 알아냈다.아울러 KEGG는 철 이온 대사와 관련된 ferroptosis 경로와 글루타티온(glutathione) 대사 경로를 선별해 분석했다.추가적인 분석을 통해 HIF-1 신호통로도 영향을 받은 것으로 드러났다.그 다음 저자의 실험은 RNA-seq의 분석과 일치한다.이로써 저자는 DEHP 처리 후 체내 Ferrous ion 이온의 농도 상승, 지질 과산화 반응 증가, 철 이온 대사와 관련된 단백질 발현 변화, HIF-1α 발현 증가로 고환 손상을 초래한다는 점을 분명히 했다.
2●체외에서 MEHP 자극이 세포사멸을 가속화시킨다는 검측하였다
저자는 DEHP가 고환 손상과 연관성이 있다는 것을 체내에서 검증한 뒤 체외에서 검증한 결과 체외 실험의 결과가 체내와 일치한다는 것을 알아냈다.MEHP는 DEHP의 주요 생체노폐물로 DEHP를 대체해 체외실험에 활용된다.MEHP는 DEHP의 주요 생체노폐물로 DEHP를 대체해 체외실험에 활용된다.저자는 MEHP를 DEHP의 대체물로 사용하여 TM3 간질세포계(TM3 Leydig cell line) TM4 지지세포계(TM4 Sertoli cell line)를 처리하여 두 가지 세포계의 사멸을 가속화한다는 사실을 발견하였다.체내 실험생각과 유사하게 대조조과 실험조를 RNA-Seq하여 GO 분석을 통해 차이 표현 유전자가 산화스트레스(Oxidative Stress) 및 철안정 상태와 관련이 있음을 밝혀냈다.KEGG 분석에서도 ferroptosis 경로와 글루타티온(glutathione) 대사 경로, HIF-1 신호 채널이 영향을 받는 것을 발견했다.또 RNA-seq의 분석 결과도 실험적으로 검증됐다.따라서 저자의 체외 실험 결과 MEHP 자극 후 고환 간질세포와 지지세포 후 ROS의 현저한 증가, Hmox1을 비롯한 철 이온대사와 관련된 유전자 발현 패턴 변화, Ferrous ion 예시의 농도 상승과 미토콘드리아 형태 이상 등이 밝혀졌다.
3● HIF-1 α는 HO-1 의 표현을 조절함으로써 Ferrous ion 농도에 영향을 미친다
이어 저자는 메커니즘을 전개해 탐구한다.HIF-1 신호 채널과 관련된 차이 표현 유전자를 분석하여 PHD를 코딩한 Egln1, Egln3가 MEHP 자극 후 하향 조정되는 것을 발견하였다.PHD 복합체는 보통 HIF-1α를 분해하며, Egln1, Egln2, Egln3가 HIF-1α, HIF-1β의 표현 패턴과 반대되는 것을 RT-qPCR과 WB 검출을 통해서도 검증한다.이어 Leydig 와 Sertoli 세포의 세포질 단백질과 핵단백질을 분리해 MEHP 의 자극이 HIF-1 알파 안정성과 축적에 영향을 미치고 ME 를 발견하여 HIF-1 α가 세포질 전좌(translocation)에서 세포핵으로 들어가는 것을 발견했다.이어 ChIP-qPCR 분석을 통해 HIF-1α가 Hmox1의 프로모터(Promoter)와 결합하여 HO-1(Hmox1에서 코딩)의 표현을 제어할 수 있음을 알아냈다.결국 HO-1 표현 상향으로 Ferrous ion 농도가 높아졌다.
4● 체외에서 HIF-1α를 녹아웃하고 HIF-1α의 작용을 더욱 검증한다
이 같은 일련의 실험을 통해 저자는 고환세포 손상과 관련된 유전자인 HIF-1α를 선별하고 조절 메커니즘을 조기에 발견한다. 이 결과를 더 확인하기 위해 저자는 HIF-1α 유전자가 녹아웃하는 Leydig와 Sertoli 세포계 (HIF-1α 유전자가 녹아웃하는 Leydig와 Sertoli 세포계는 Cyagen 바이오가 제공한다)를 구축해 후속 실험에 활용하고 있다. Sanger 시퀀싱(sequencing)과 Western blotting 검측을 통해 세포주의 HIF-1α 을 녹아웃하는 것이 성공적으로 제거되었음을 확인했다.HIF-1α-KO의 세포계는 야생형 세포에 비해 MEHP 자극으로 세포활력이 손상되는 정도가 현저히 개선되었다. 동시에 과산화지방질 (그림 1b, I) 와 Ferrous ion과부하도 억제된다(그림 1c, J).QPCR 과 Western 블러팅(Blotting)을 각각 사용하여 Hmox1 과 HO-1 수준의 표현을 평가한 결과, Hif-1α을 제거하면 MEHP 자극에 따른 Hmox1 (그림 1d, K) 과 HO-1 (그림 1g, N) 표현 수준 상승을 역전시킬 수 있다는 사실이 밝혀졌다.이 밖에 MEHP 자극 후 ROS 폭발(그림 1E, L)과 세포사멸(그림 1F, M) 정도도 HIF-1α를 제거한 후 감소한다.Western 블러팅(Blotting)은 HIF-1α가 ACSL4, FTH1, SLC7A11의 표현을 복원하고 GPX4의 표현을 억제한 것을 나타낸다(그림 1 G, N). 전반적으로, 이러한 결과는 MEHP 자극이 HIF-1 α에 의존하는 방식으로 고환 Leydig 와 Sertoli 세포의 철 의존성 세포 사망(Ferroptosis )을 초래한다는 것을 보여준다.
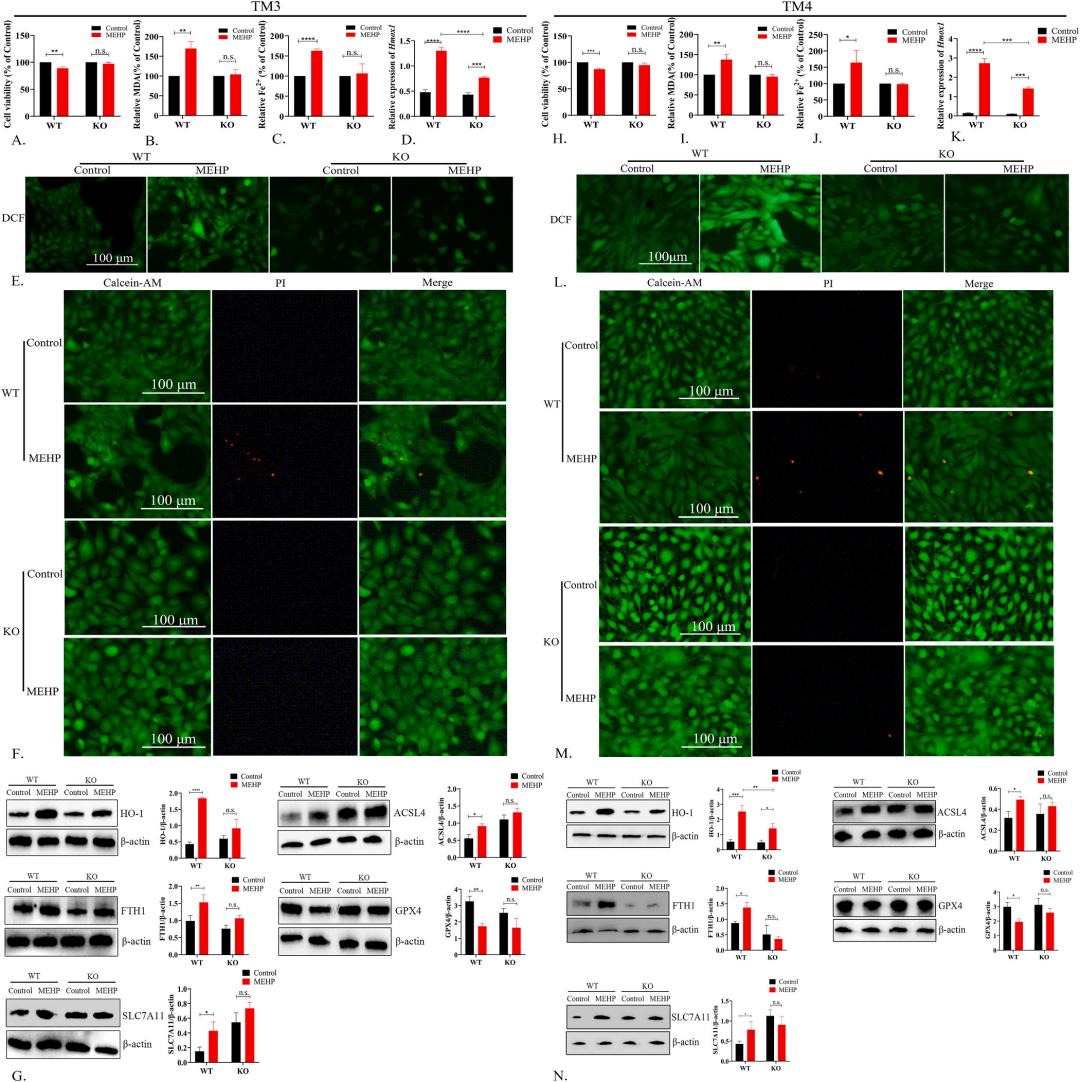
그림 1 HIF-1α 유전자 녹아웃은 MEHP 가 유도한 Ferroptosis을 구했다
三.결론
저자는 MEHP 자극 후 표형 분석, RNA-Seq 분석, ChIP-qPCR 분석 등을 통해 고환세포 기능장애와 관련된 조절 유전자: HIF-1α를 발견한다. MEHP (체내 DEHP 의 주요 생물대사물) 는 PHDs 를 억제하고 HIF-1α 축적과 안정에 영향을 주어 HIF-1α 전좌(translocation)를 세포핵으로 유도하고 Leydig 와 Sertoli 세포의HIF-1/Hmox1 결합을 유도하는 메커니즘을 초보적으로 발견했고 HO-1의 표현을 상향 조정한다. HO-1의 과발현으로 Ferrous ion이 과부하되고 ROS가 축적되어 결국 Ferroptosis 하고 Leydig와 Sertoli 세포의 활성이 손상된다.이는 HIF-1α유전자가 녹아웃한 세포계에서 더 검증된다.
정밀한 연구로 완전한 실험 과정이 필요하며, 일반적으로 그룹학적 분석으로 과학적으로 유전자를 선별하고, 다양한 실험 결과를 얻으려면 상호 인증이 필요한다.
유전자 녹아웃은 여전히 유전자 기능 연구의 일반적인 전략 중 하나이며, 성공적인 유전자 녹아웃 세포주는 검증 결과의 정확성에 매우 중요한다.
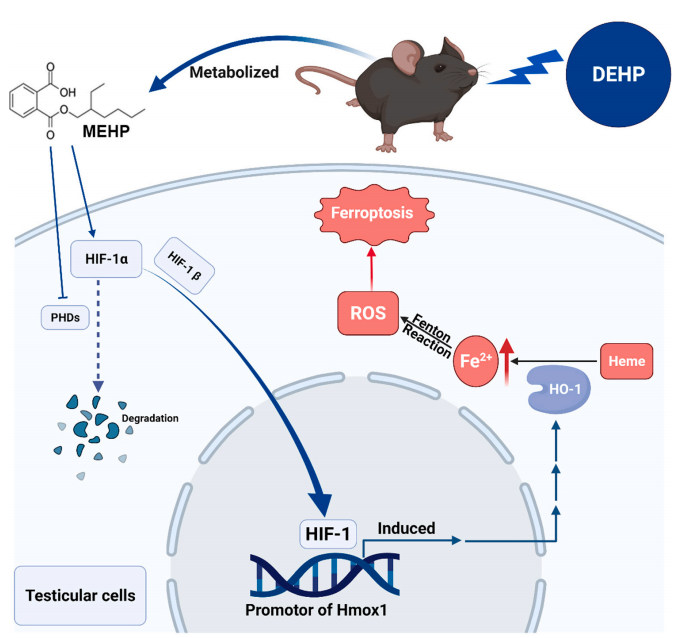
그림2. DEHP는 HIF-1α/Hmox1 신호 통로를 통해 생쥐의 고환 손상을 초래한다
스마트 KO 솔루션 설계 시스템, 유전자 조절 메커니즘 연구의 필수
Cyagen바이오는 다년간 성숙하고 안정된 패턴동물과 체외세포에서의 CRIPSR 유전자 편집기술, 풍부한 (건)세포 배양기술 경험을 바탕으로 IPSC와 기타 각종 세포계의 유전자 녹아웃(KO), 노크인(KI) 및 점 돌연변이(PM)를 쉽게 결정할 수 있다.봄철 세포주 주문, 최저 혜택받습니다,86 20-31601779으로 주문문의 해주세요!
참고 문헌:
Wu Y, et al. Di-(2-ethylhexyl) phthalate exposure leads to ferroptosis via the HIF-1α/HO-1 signaling pathway in mouse testes. 2021, 127807. DOI: https://doi.org/10.1016/j.jhazmat.2021.127807
About Cyagen
Cyagen바이오는 2006년 설립된 AI 기술을 활용한 약물 개발 혁신 CRO 회사다.현재 직원 수가 900명을 초과하고,총 규모는 40,000제곱미터를 초과하며,중국 광저우,쑤저우,베이징구안(固安)에 완전 자본 자회사를 설립하고 있다.청두,베이징,상하이,우한,창사 등에 사무소를 두고 있으며 미국 Santa Clara와 일본 도쿄에 지사를 두고 있다.지난 10여 년 동안,Cyagen 바이오는 품계의 풍부한 유전자 편집 마우스 자원 라이브러리,효율적이고 지능화된 Mouse와 Rat맞춤형 플랫폼,규모화된 빠른생육 플랫폼,그리고 엄격한 품질 제어를 위한 무균 마우스 기술 서비스 플랫폼에 의존하여 모델 동물 유전자 편집 기술 분야에서 업계 선두에 서고 있으며,또한 대량의 생체 정보 및 유전자 편집 분야의 데이터를 축적하고 있다.인공지능 분야의 심도있는 탐색을 결합하여 Cyagen 바이오는 유전자 치료와 세포 치료를 하는 연구자에게 원스톱 솔루션을 제공하고 AI 표적 선별 및 기능 연구,동물 모델 구축,치료적 벡터 설계 및 최적화,바이러스 포장,약리 약효학 연구 등 전 프로세스 서비스를 원스톱으로 제공하여 유전자 치료와 세포 치료 기초 연구의 임상 전환 효율을 높이는 데 도움을 줄 수 있다.
현재 Cyagen바이오는 전 세계 100여 개국의 과학자 및 기업체와 광범위한협력을 맺고 과학연구기관 및 의약산업에 종합적인 동물모델 제작,생육보종,AI 표적선별,약리 약효평가,유전자치료와 세포치료 분야의 과학연구와 임상전환 등의 서비스를 제공하는 데 주력하고 있다.필요하시면 문의 연락 주세요.




영업일 기준 1-2일 내에 답변해 드리겠습니다.