

Dr. L | Mar, 26 2020
신종 코로나바이러스(SARS-CoV-2)의 전파로 신종 코로나바이러스에 저항하는 '전쟁'도 전세계에서 신속하고 전면적으로 전개됐다. 바이러스와의 싸움에서 연구자들은 역학, 병리적 증상, 바이러스 추적 및 방역 조치의 모든 측면을 통해 바이러스 및 숙주 수용체에 대한 연구를 진행했다. SARS-CoV-2와 결합하는 인간 수용체로서, 앤지오텐신전환효소2(ACE2)의 기능 탐구가 특히 중요하다. 그렇다면 ACE2는 신종 바이러스의 ‘종범’외에 어떤 역할을 맡고 있는가? 다음과 같이 살펴보도록 하겠다.
1. ACE2와 레닌-앤지오텐신계(renin-angiotensin system,RAS)
앤지오텐신전환효소(angiotensin-converting enzyme, ACE)는 805개의 아미노산을 암호화하는 금속단백질 분해효소로, X 염색체(Xp22.2)에 위치하며 단일 세포외 촉매 도메인을 가진 막횡단 당 단백질이다. ACE는 레닌-앤지오텐신계(renin-angiotensin system, RAS)에서 중요한 조절 기능을 하며 활성이 없는 앤지오텐신I(AngI)을 혈관 수축을 조절하는 앤지오텐신II(AngII)로 전환할 수 있다. AngII는 RAS 시스템의 핵심 효과 분자이며 앤지오텐신 수용체(AT1 및 AT2)를 통해 많은 생물학적 반응을 매개한다. 또한, 앤지오텐신전환효소2(ACE2)는 ACE의 동족체로, Ang1-7 폴리펩티드로 절단 할 수 있으며, 심장 보호, 혈관 이완, 항성장 및 항증식 효과를 가질 뿐만 아니라 브래디키닌의 활성도 향상시킬 수 있다.
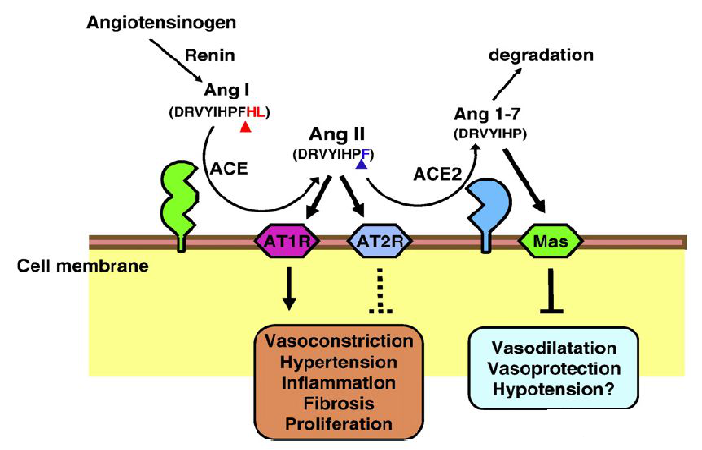
(Keiji Kuba et al, 2010)
2000 년에, 연구자들은 심부전 환자 및 인간 림프종의 cDNA 라이브러리로부터 ACE2를 클로닝 한 후, ACE2의 기능에 대한 연구가 다양한 분야에 걸쳐 퍼져 나갔다.
2. ACE2와 SARS-CoV-2
ACE2는 SARS 바이러스의 수용체이다. 연구에 따르면 SARS 코로나바이러스가 ACE2를 발현하는 cell cavity 표면을 통과하여 감염되었을 때 그 감염의 효력이 10배 향상된다. SARS 바이러스 RBD는 외부 구조역을 이용하여 수용체의 N말단과 결합함으로써 RBD/ACE2 상호 작용에서 주도적인 위치를 차지하는 하나의 친수성 접촉 네트워크를 형성한다. ACE2에 결합한 후, SARS-CoV 바이러스막과 숙주 세포막 사이의 융합은 S2 서브유닛으로 이루어졌다. 여기서 두 가지 단백질분해효소를 언급할 필요가 있는데, 하나는 금속단백질 분해효소17(ADAM17)이고, 다른 하나는 막횡단 세린 단백질 분해효소2(TMPRSS2)이다. 현재 이 두 효소는 코로나바이러스가 숙주 세포에 들어가 ACE2와 결합할 때 역할을 하는 것으로 보도되어 있다. 그럼 구첵적으로 어떻게 역할을 하는가?
Keiji Kuba 등의 2010년 연구에서, ACE2가 SARS 바이러스와 결합한 후 Clathrin 의존적 방식으로 숙주 세포에 들어갈 수 있으며 거의 동시에 ACE2는 ADAM17 에 의해 절단됨으로써 바이러스가 ACE2와의 결합은 차단될 것으로 밝혀졌다. 마찬가지로 Markus Hoffmann 등은 얼마 전에 《cellpress》에서 SARS-CoV-2가 숙주 세포에 들어갈 때 ACE2와 SARS-CoV-2의 결합을 돕기 위해 TMPRSS2의 참여가 필요하다는 견해를 제시했다. 우리는 수용체 ACE2가 주요 작용 인자라는 것을 알 수 있지만, 코로나바이러스가 숙주 세포로 들어가는 과정에서는 ACE2만 기능을 발휘하는 것이 아니다. ACE2를 절단할 수 있는 ADAM17 및 ACE2와 SARS-CoV-2의 막융합 과정을 참여하는 TMPRSS2와 같은 막횡단 단백질의 작용 연구 또한 의미가 있다. 표적 약물 개발 면에서, 신체 손상을 최소화하고 예후에 좋은 효과를 낼 수 있기 위해 유전자의 다양한 측면을 탐구해야 한다. 다른 면에서, 인간이 SARS-CoV-2에 감염될 때 손상된 주요 기관은 폐인 이유는 폐에서 ACE2의 분포와 불가분하다. 따라서, 폐 섬유증, 폐 염증, 심지어 폐암과 같은 폐질환에 대해 ACE2를 관심 유전자로 사용하여 연구할 수 있다.
3. ACE2와 신장 질환
초기 유전자 발현 연구에 따르면 ACE2는 심장, 신장 및 고환에서만 발현되는 것으로 나타났지만, 후속 연구에서는 폐, 간, 뇌, 췌장 및 결장에서도 존재한다는 것으로 나타났다. ACE2 단백질은 Ang II를 가수분해하여 Ang 1-7을 형성할 수 있다. 신장에서 Ang 1-7은 G 단백질 결합 수용체 Mas에 작용하며 혈관 이완, 항섬유화, 항증식, 항염 등 혈관 보호 역할을 한다.
신장 손상은 Ang II에 의해 주로 매개된다. ACE2 유전자의 제거로 당뇨병 마우스의 혈압 상승, 사구체 손상 및 신장 섬유증을 유발할 수 있으며, 외인성 재조합 ACE2는 알부민 배설 증가의 감소를 통해 당뇨병성 신장질환(DKD)의 진행을 늦출 수 있다는 연구도 있다. ACE2는 신장, 주로 근위세뇨관 솔가장자리, 신장 혈관의 내피와 평활근 세포, 그리고 족세포에서 고도로 발현된다. 보도에 따르면 손상된 신장 세뇨관에서 증가된 Ang II는 인간 신장 질환에서 추가적인 신장 손상의 가능한 매개체일 수 있다. 따라서, 신장 내 ACE와 ACE 2 사이의 균형이 붕괴되고 그에 따른 Ang II 증가가 신장 손상을 유발할 수 있다. 고혈압성 신장병은 고혈압의 흔한 합병증으로 그 주된 메커니즘 중 하나는 Ang II와 관련된 염증, 산화스트레스 및 신장조직의 섬유화이다. 주목할 만한 것은, 2019년 4월, 중국 길림 대학교 약학 대학원(吉林大学药学院)은 진세노사이드 Rg3가 신장 조직에서 ACE2를 증가함으로써 rat와 mouse에서 AngII에 의해 매개된 신장 손상을 약화시켰으며, Rg3는 항종양 활성 외에도 항염, 항산화 스트레스, 항섬유화를 포함한 다양한 메커니즘을 통해 심혈관계를 보호할 수 있다는 것을 발견했다.
4. ACE2와 심혈관 질환
ACE2는 심근세포, 심근 섬유아세포, 관상동맥 내피세포에서 광범위하게 발현된다. RAS 시스템은 체액, 혈압 균형을 조절하는 동시에 혈관 장력을 유지하며 ACE2는 RAS 시스템에서 중요한 조절 단백질이다. RAS의 과도한 활성화 (혈관 수축 증가) 또는 소진 (혈관 이완 감소)은 혈관 기능 장애를 유발할 수 있으며 혈관 기능 장애는 심혈관 질환(CVD)과 동맥경화증의 주요 원인이다. 혈관 기능 장애 및 다른 병리 질환을 치료하는 한 가지 방법은 Ang II의 효과를 균형 있게 함으로써 ACE2의 활성을 증가시키는 것이다. Craceower 등은 심장 기능에서 ACE2의 중요성을 설명했다. 그들은 ACE2 Knock-Out 마우스는 심각한 심장 기능 장애를 가지고 있고, ACE2는 심장 기능을 재구성하며 조절할 수 있는 잠재력이 있을 수 있다는 것을 발견했다. 또한 연구자들은 ACE2의 국소적 과발현이 초기 동맥경화증의 발병을 현저히 억제하며, ACE2의 항동맥경화 효과는 혈관 평활근 세포의 증식이전 억제 및 내피 기능의 개선과 관련이 있음을 발견했다. 추가 연구에 따르면 좌심실수축기능장애 환자의 혈장에서 ACE2 활성이 증가하며 좌심실수축기능장애는 관상동맥심질환, 돌연 심장사, 심부전과 뇌졸중 등의 중대한 위험 요인으로 나타났다. 동시에, Uri 등은 혈청에서 ACE2의 활성과 심부전 악화 사이의 상관관계를 검증했다. 고혈압에서 심부전으로의 발전 과정에서 혈청에서 ACE2 활성의 감소는 심장수축기능이상의 선택적 바이오 마커인 것에 특히주의를 기울였다. Vaibhav B. Patel 등의 연구는 ACE/Ang1-7 축이 RAS 시스템 활성화에 있어 중요한 반조절 작용을 입증하고, ACE2의 결손은 심부전에 대한 민감성을 증가시키지만 ACE2 level를 증가시키면 심부전의 표현형을 예방하고 역전시킬 수 있다. ACE2와 Ang1-7은 이미 심부전 저항에 대한 주요 보호 경로가 되었다. 이러한 증거들은 모두 ACE2가 심혈관 연구에서 매우 중요한 역할을 하고 있다는 것을 증명한다.
5. ACE2와 당뇨병
RAS 시스템과 나트륨이뇨펩타이드(natriuretic peptide,NPS) 시스템은 당뇨병성 심근증(DCM)의 발생 및 발달의 원인이며, 중성 효소 억제제는 NPS level을 증가시켜 RAS 차단제(ARB 앤지오텐신 차단제 및 ACE 억제제 포함)를 높임으로써 심혈관 보호하는 역할을 한다. 또한, ACE/Ang II/AT1 수용체 경로의 활성화는 염증, 산화 스트레스, 섬유화와 인슐린 저항 등의 과정과 관련이 있다.
당뇨병 마우스 모델에 관한 연구는 망막과 신장에서 ACE/ Ang II/AT1 수용체 경로가 상향 조절됨으로써 ACE2/Ang (1-7) /Ma 수용체 경로가 하향 조절되는 것을 보여준다. 이것은 당뇨병성 신장병을 앓고 있는 제2형 당뇨병 환자의 신장에서도 확인된다. 이러한 데이터는 ACE / Ang II / AT1 수용체와 ACE2 / Ang (1-7) / Mas 수용체 경로 사이의 불균형이 당뇨병 합병증의 발생 및 발달의 흔한 기반임을 보여준다. ACE / Ang II / AT1 수용체와 ACE2 / Ang (1-7) / Mas 수용체 경로 사이의 불균형은 신경성 동통을 유발하는 데 중요하다. 제2형 당뇨병 마우스에서 관찰된 신경성 동통은 ACE2 / Ang (1-7)/ Mas 수용체 경로의 하향 조절에 관련되며, 이러한 하향 조절은 ACE2를 발현하는 척수배각 뉴런(Spinal dorsal horn neurons)의 상실에 의해 야기된다. ACE2 / Ang (1-7) / Ma 수용체 경로를 활성화하면 통각과민을 완화시킬 수 있으므로, Ang (1-7)의 외부 보충은 제2형 당뇨병의 신경성 동통 완화에 효과적인 치료 전략이 될 수 있다. 연구 결과에 따르면 내피 기능의 균형을 유지하기 위해서는 ACE2의 발현과 활성화가 필요하다는 것이 밝혀졌다. DIZE는 ACE2의 활성제로 당뇨병 마우스에게 DIZE를 경구 투여하면 ACE2의 과발현을 촉진하고 혈관기능을 개선시킬 수 있다. DIZ1이 투약된 후, 연구자들은 당뇨병 마우스의 혈장에서 Ang1-7의 level이 올라가 NO 생성을 증강시키며, 동맥 내피 세포에서 대동맥 평활근 세포로 방출함으로써 혈관기능을 변화시킨다는 것을 발견했다.
6. ACE2와 중추신경계
ACE2는 주로 위장관, 심장, 신장, 폐와 고환에서 발현되며, 뇌에서도 low level의 ACE2 발현이 발견된다. 신경 생화학에서, 유전자 변형과 유전자 녹아웃 동물 모델은 신경 호르몬 시스템을 연구하는 데 사용되며, 이 시스템에서 개별 성분의 변화가 생리적 과정 전체에 미치는 영향을 설명하는 데 사용된다. (예: RAS 시스템) 5-하이드록시트립타민은 뇌에서 신경 전달 물질이라는 역할을 한다. 트립토판은 5-하이드록시트립타민 합성의 전구체이므로, 트립토판 섭취가 손상되면 5-하이드록시트립타민의 합성이 감소되며 혈액과 뇌의 5-하이드록시트립타민 level이 낮아진다. 세로토닌은 운동으로 유발된 신경세포의 생성에 필수적이다. 연구자들은 운동에 의해 유도된 해마 치아이랑(hippocampal dentate gyrus) 세포 증식이 ACE2가 결손되는 마우스 모델에서 제거되었지만 글리코실-1-트립토판을 경구 투여를 통해 뇌의 5-하이드록시트립타민을 대체하는 경우, 운동 유도의 신경 생성을 살릴 수 없다는 것을 발견했다. 연구에 따르면, 유전자 변형 마우스 모델에서 전뇌 또는 시상하부에서의 ACE2 과발현 또는 녹아웃/녹다운에 대한 연구가 중추 신경계에서 ACE2의 주요 기능을 밝혀내는 데 도움이 될 수 있는 것으로 나타났다. ACE2가 심장, 스트레스 반응, 불안, 인지, 뇌 손상 및 신경 발생에서 분명한 조절 작용을 하는 것을 관찰할 수 있기 때문에, ACE2의 활성화는 다양한 신경계 질환의 치료 표적이 되었다.
중년 고혈압과 뇌혈관 기능 장애는 향후 노인성 치매(알츠하이머병 포함) 발병 위험이 높아지는 것과 관련이 있다. ACE2의 향상은 AD 임상전 모델에서 아밀로이드 단백과 관련된 해마체 병리학적 변화와 인지 장애를 예방하고 역전시킬 수 있다. 연구는 CNS 손상 실험 동물 모델에서, ACE에 의해 유도된 rRAS 경로 활성이 감소되고, ACE2의 유도 또는 Ang- (1-7) MasR 신호의 활성화는 허혈성 뇌졸중과 신경성 고혈압에 대한 신경 보호 효과를 갖는 것으로 나타났다. Tg2576 마우스 AD 모델에서, ACE2의 활성화는 인지능력 저하를 방지하고 아밀로이드 단백의 병리학 현상을 약화시킬 수 있다. 연구에 따르면, DIZE는 늙은 Tg2576 래트에서 기억 관련 인지 장애를 역전시키고 Aβ 병리를 감소시킬 수 있다. ACE2에 의해 매개된 기억 인지 기능의 개선은 라벨 성상교세포, 미세교세포 또는 혈관 기능과 연관되는 것이 아니라 염증 감소 (IL-1β)와 관련이 있는 것으로 나타났다.
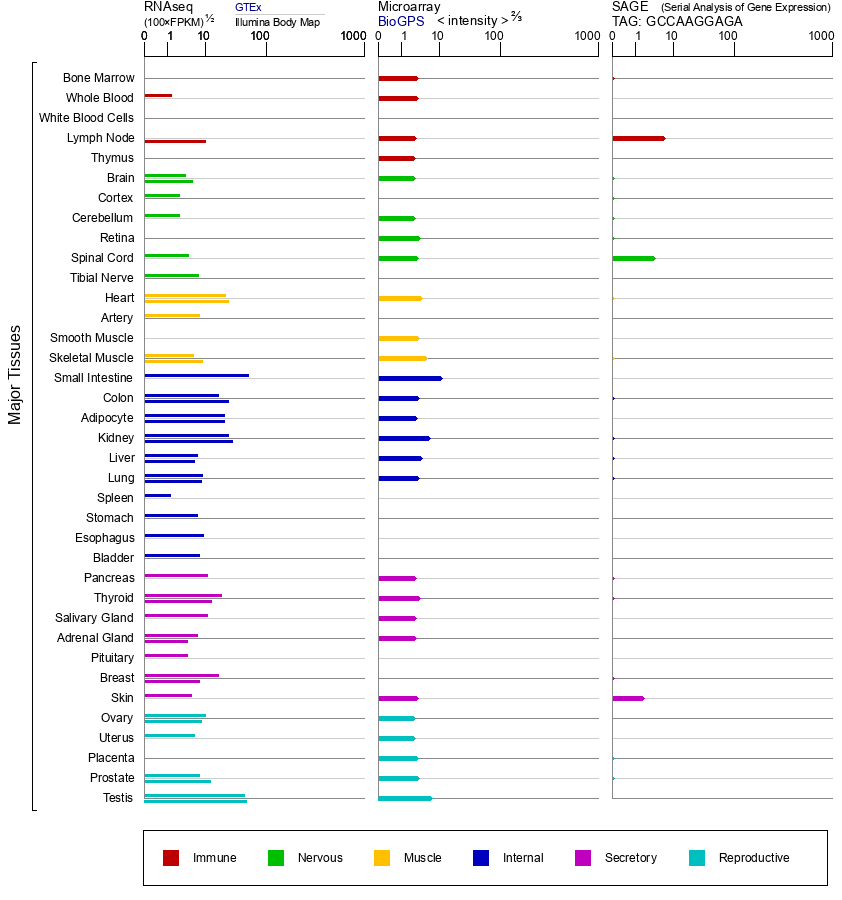
Gene-expression of ACE2 from gene card
조직의 발현 상황 및 상기 연구의 결과를 보면, 체내 ACE2의 분포는 매우 광범위하다. RAS 시스템의 중요한 조절 분자로서, ACE2는 구강 편평상피세포암의 발달에 참여하고 구강 점막 상피에서 발현된다. 또한 만성 담도 섬유증 과정 및 갑상선 암 과정에 참여하며 위장관에서의 발현은 바이러스가 위장관에서의 확산에 영향을 미친다. ACE2는 X 염색체에 위치하며 고환에서 고도로 발현되기 때문에 ACE2의 결손이 남성 생식계 기능에 미치는 영향이 매우 크다. 따라서 SARS-CoV-2에 감염된 남성 회복 환자에 대해서는 생식기능의 검사가 필요하다. 이 일련의 연구는 ACE 2의 기능이 매우 강력하다는 것을 보여준다. 다양한 질병 모델에서 우리는 ACE2의 기능에 대해 점점 더 많이 알게 되었고 모델 동물의 적용이 현대 생물의약과학의 발전을 가속화 시켰다는 것도 알 수 있다. 유전자 자체의 기능을 검증하기 위해서는 유전자 knockout, knockin 동물 모델이 필요하며 신약의 기능을 검증하기 위해서는 humanized 동물 모델을 사용할 수 있다. 백신 평가 측면에서, 모델 동물은 또한 임상 전에 추가 검증을 진행 시 필요한 모델이며, 유전자변형 동물 모델을 통해서 우리는 인간에서 질병의 발생과 발전 과정을 최대한도로 시뮬레이션할 수 있는 데다가 질병에 따른 각종 병리현상 및 원인 등을 보다 명확하게 이해할 수 있다. 모델 동물은 기초 연구, 약물 개발 및 백신 평가의 모든 측면에서 중요한 역할을 맡고 있다.
참고문헌:
1. Hao Xu, Liang Zhong, Jiaxin Deng et al. High expression of ACE2 receptro of 2019-nCoV on the epithelial cells of oral mucosa. International journal of oral science. 2020.
2. Tawar Qaradakhi, Laura Kate Gadanec, Kristen Renee McSweeney et al. The potential actions of angiotensin converting enzyme II (ACE2) activator diminazene aceturate (DIZE) in various diseases. Clinical and experimental pharmacology and physiology. 2020.
3. Natalia Alenina. Michael Bader. ACE2 in brain physiology and pathophysiology: evidence from transgenic animal models. Neurochemical research. 2019.
4. Charles E. Evans. James S. Miners. Giulia Piva et al. ACE2 activation protects against cognitive decline and reduces amyloid pathology in the Tg2576 mouse model of Alzheimer’s disease. Acta neuropathologica. 2019.
5. L. Anguiano, M. Riera, J. Pascual and M.J. Soler. Circulating ACE2 in cardiovascular and kidney diseases. Current medicinal chemistry. 2017.
6. Crackower, M.A. Sarao, R. Oudit, G.Y. Yagil, C. Angiotensin-converting enzyme 2 is an essential regulator of heart function. Nature. 2002.
7. Burrell, L.M. Risvanis, J. Kubota, E. et al. Myocardial infarction increases ACE2 expression in rat and humans. Eur. Heart J. 2005.
8. Zhang, C. Zhao, Y.X. Zhang, Y.H. Zhu, L. et al. Angiotensin-converting enzyme 2
attenuates atherosclerotic lesions by targeting vascular cells. Proc. Natl. Acad. Sci. USA, 2010.
9. Zhang, Y.-H. Zhang, Y.H. Dong, X.F. et al. ACE2 and Ang-(1-7) protect endothelial cell function and prevent early atherosclerosis by inhibiting inflammatory response. Inflamm. Res. 2015.
10. Dong, B. Zhang, C. Feng, J.B. et al. Overexpression of ACE2 enhances plaque
stability in a rabbit model of atherosclerosis. Arterioscler. Thromb. Vasc. Biol. 2008.
11. Zhang Y, Liu J, Luo JY, et al. Upregulation of Angiotensin (1-7)-Mediated Signaling Preserves Endothelial Function Through Reducing Oxidative Stress in Diabetes. Antioxid Redox Signal. 2015.
12. Vaibhav B. Patel, Jiu-Chang Zhong, Maria B. Grant et al. Role of the ACE2/Angiotensin 1-7 axis of the renin-angiotensin system in heart failure. Circ tes. 2016.
13. Hui Liu, Yichuan Jiang, Min Li et al. Ginsenoside Rg3 attenuates angiotensin II-Mediated renal injury in rats and mice by upregulating angiotensin-converting enzyme 2 in the renal tissue. Evidence-Based Complementary and Alternative Medicine. 2019.
14. Keiji Kuba, Yumiko Imai, Takayo Ohto-Nakanishi, Josef M. Penninger. Trilogy of ACE2: A peptidase in the renin-angiotensin system, a SARS receptor, and a partner for amino acid transportors. Pharmacology & Therapeutics. 2010.
15. Indu G. Rajapaksha, Lakmie S. Gunarathne, Khashayar Asadi et al. Liver-Targeted angiotensin converting enzyme 2 therapy inhubits chronic biliary fibrosis in multiple drug-resistant gene 2-knockout mice. Hepatology communications. 2019.
최근 진행중인 프로모션:
1. 코로나바이러스 수용체 ACE2&DPP4 마우스 모델, 온라인 주문 시작!
2. TurboKnockout® cKI 마우스, 최저가 $20,000~ 부터
3. Cyagen AI Knock-Out Mouse Model eBank - 2,000 Live Knock-Out 마우스




영업일 기준 1-2일 내에 답변해 드리겠습니다.